Согласно современных данных, при переработке молибденовых руд процент потерь молибдена составляет около 30 — 40 %, что для современного производства является очень высоким показателем. Поэтому перед современной химической промышленностью стоит задача разработать методы и пути переработки отходов производства молибдена с целью повышения его выхода.
Актуальность темы:, Цель работы:
Задачи : разработать пути совершенствования обработки молибденсодержащих отвалов и отходов с целью повышения выхода молибдена из сырья.
Объект: отходы после переработки молибденовых руд, а также отвалы и шлаки после выделения молибденового ангидрида МоО3 .
Предмет : предметом работы является рассмотрение основных методов переработки молибденовых руд и выделения из них молибденового концентрата в разном виде для дальнейшей переработки.
Молибден находит широкое применение в современной технике, как в виде чистого металла, так и как компонент сплавов. Большие количества молибдена потребляет металлургия для получения легированных сталей и чугунов, жаропрочных и корозионностойких сплавов. В советском Союзе собственное производство молибдена было налажено в 1928 году. Широкое применение молибдена потребовало проведения широких научных исследование его свойств, методик получения его соединений из руд, получения чистого молибдена. Поэтому в печати вышло достаточно большое количество книг и монографий, которые рассматривали свойства молибдена, а также различные аспекты получения данного металла.
Использование минералов, содержащих молибден, история открытия данного элемента подробно рассмотрена Б. В. Некрасовым в [12].
Также в [12] дано обзор основных минералов, содержащих молибден. Более подробно минералогию молибдена рассмотрено в [20], где поведено полное описание всех минералов, которые содержат молибден. Также проведено анализ запасов молибденовых руд на основе территориального принципа, приведены приблизительные запасы молибденовых руд в различных странах, а также экономически обоснованные данные по их разработке. Рассмотрены причины разработки скарновых руд молибдена.
Свойства молибдена подробно рассмотрены К. А. Большаковым в [20].
Также основные свойства молибдена подробно рассмотрены в [22], а также различных справочниках, например [6], [16], где приведены не только основные физические свойства молибдена, но и свойства его основных соединений и различные константы, например комплексных соединений. Надо отметить некоторое несовпадение основных констант для молибдена взятых из различных источников. Поэтому при написании работы ориентировались, в основном, на данные, взятые из [22].
Активные угли. Свойства, применение и технология получения
... свойством водоочистных углей наряду со способностью поглощать вещества, придающие воде неприятный запах и привкус, считалась также хорошая адсорбционная способность ... обработанного активного угля позволяет значительно увеличить срок службы подобных вакуумных камер. Угли, активированные водяным ... показывают сильную адсорбционную активность угля в области низких давлений. При получении высокого вакуума ...
Химические свойства молибдена подробно рассмотрены многими авторами. Свойства молибдена довольно полно описаны К. А. Большаковым в [20].
Свойства комплексных соединений молибдена рассмотрены в [3] А. И. Бусевым, в монографии которого основной упор сделано на методы и способы выявления соединений молибдена в растворах и рудах, рассмотрены способы растворения соединений молибдена и перевода их в раствор. Биологическая роль молибдена и его соединений, их токсичность раскрыты в [22], где показано влияние молибдена и его соединений на процессы окисления ферментами различных веществ белковой природы. Показана также антираковая активность молибдена, приведены дневные нормы потребления молибдена в зависимости от возраста человека.
Переработка молибденовых руд и получение полуфабрикатов для изготовления металлического молибдена, приведены в работах [8], [9], [14], [17], [20], [23].
Наиболее полно получение оксида молибдена МоО 3 из молибденсодержащих руд показано в работе [8], [20].
В работе [8] А. Н. Зеликман и Б. Г. Коршунов показали получение оксида молибдена из молибденовых руд, также в работе [8] показано получение оксида молибдена из руд, содержащих вольфрам. Технология гравитационного обогащения молибденовых руд описана в работе [2].
Наиболее полно технология получения полуфабрикатов молибдена и переработка молибденовых руд показана в работе [20].
В ней К. А. Большаков детально остановился на описании процессов протекающих при переработке молибденовых руд и получении оксида молибдена. Показана роль окислительного обжига молибденового концентрата для получения оксида молибдена. В работах [8], [20] рассмотрено получение различных соединений молибдена из огарков после обжига молибденового концентрата. В работе [20] детально рассмотрено получение различных соединений молибдена: парамолибдата аммония (NH 4 )6 Mo7 O24 × 4H2 O, молибденовой кислоты Н2 МоО4 или молибдата кальция СаМоО4 , гетерополикислот молибдена. В работе [20] К. А. Большаков детально остановился на переработке отвалов и отходов молибденового производства с целью получения товарного молибдена. Согласно работы [20] отвалы от выщелачивания раствором NH3 огарков, полученных после обжига богатых молибденовых концентратов, могут содержать до 20 – 25% Мо в составе соединений, не разлагаемых растворами аммиака, — СаМоО4 , MoO2 , MoS2 . в работе [20] К. А. Большаков рассматривает различные методы извлечения молибдена из отвалов, а именно при помощи спекания отвалов с содой и последующим выщелачиванием спекшейся массы водой, при помощи выщелачивания растворами соды в автоклавах и обработкой отвалов кислотами.
Наиболее интересен метод обработки отвалов кислотами, поскольку он позволяет проводить обработку отвалов, содержащих значительное количество соединений вольфрама. В работе [20] показано, что вольфрамат кальция соляной кислотой на холоду не разлагается, что позволяет частично разделять соединения вольфрама и молибдена. Поэтому солянокислая обработка рациональна, если в отвалах от аммиачного выщелачивания есть соединения вольфрама.
Процесс получения металлокерамики
... обработку. Каждая из указанных операций оказывает значительное влияние на формирование свойств готового изделия. Теоретические, методологические и практические вопросы получения металлокерамики являются ... соединений, быть мало растворимыми в тугоплавких соединениях, а также иметь близкие значения коэффициентов линейного расширения, теплопроводности и модуля упругости. Технология изготовления ...
При переработке отвалов молибденового производства наиболее рациональным является использование процессов ионного обмена или экстракции, что позволяет не использовать сложной аппаратуры, высоких давлений и температур. Процессы экстракции молибдена из растворов рассмотрены в работах [11], [13].
В работе [11] Меркин Э. Н. на основе данных исследований рассмотрел возможность выделения некоторых металлов, среди которых был и молибден, органическими жирными кислотами. В работе рассмотрено влияние на экстракцию вида неорганического аниона, РН среды, растворителя и других условий экстракции.
Экстракция молибдена детально рассмотрена в работе [13].
Г. Ритчи и А. Эшбрук показали, что из анионообменных экстрагентов молибден достаточно успешно экстрагируется триоктиламином (C 8 H17 )3 N и аммониевым основанием – диалкилметилбензиламмоний хлоридом. Рассмотрена также экстракция молибдена трибутилфосфатом (C4 H9 )3 PO4 , метилизобутилкетоном C5 H12 CO, циклогексаноном (СН2 )5 СО и ацетофеноном СН3 СОС6 Н5 . Экстрагирование молибдена дорганическими веществами с целью его выделения из отходов молибденового производства является наиболее рациональным способом получения молибдена.
Рассмотрим основные физические и химические свойства молибдена, что поможет в дальнейшем объяснить его способы переработки и извлечения из руд.
2.1 История открытия элемента
Молибденит (дисульфид молибдена, MoS 2 ) был известен древним грекам и римлянам с незапамятных времен [1, 12]. Этот свинцово-серый с металлическим блеском минерал (другое название – молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом. Мягкость минерала позволяла использовать его (вместе с графитом) как грифель для карандашей, поэтому долгое время молибденит путали с галенитом и графитом, хотя, в отличие от последнего, он оставлял на бумаге зеленовато-серый цвет. В средневековой Европе три минерала (PbS, MoS2 и графит) имели одно название – Molybdaena. История открытия элемента № 42 связана со Швецией. В 1758 шведский минералог и химик Аксель Фредерик Кронштедт (1722–1765) высказал предположение, что графит, галенит и молибденовый блеск три самостоятельных вещества [12].
Двадцать лет спустя, в 1778, химическим составом молибденита заинтересовался шведский химик Карл Вильгельм Шееле. Прокипятив его с концентрированной азотной кислотой, он получил белый осадок «особой белой земли», которую назвал молибденовой кислотой. Хотя во времена Шееле и не знали, что «земли» представляют собой оксиды металлов, уникальная химическая интуиция подсказывала ему, что металл можно получить прокаливанием молибденовой кислоты с углем. Экспериментальные трудности (у него не было подходящей печи) не позволили Шееле самостоятельно решить эту задачу и лишь в 1782 шведскому химику Петеру Якобу Гьельму, которому Шееле прислал образец молибденовой кислоты, удалось восстановить ее углем и получить королек металла (сильно загрязненного карбидами) [12, 17, 18]. После удачно проведенного опыта Шееле писал Гьельму: «Радуюсь, что мы теперь обладаем металлом – молибденом!». Относительно чистый металл удалось получить много лет спустя Йенсу-Якобу Берцелиусу в 1817 [18].
Совершенно чистый молибден, способный к ковке, получили лишь в начале 20 века [14].
2.2 Физические свойства молибдена
Внешний вид металлического молибдена зависит от способа его получения. Компактный (в виде слитков, проволоки, листов, пластин) молибден – довольно светлый, но блеклый металл, а молибден, полученный в виде зеркала разложением, например, карбонила – блестящий, но серый [20, 23]. Молибденовый порошок имеет темно-серый цвет. Плотность молибдена 10280 кг/м 3 . Температура плавления 2623° С, кипения 4639°С [ 6, 16]. Основные физические свойства молибдена приведены в таблице 1.
Таблица 1. Основные физические свойства молибдена
| Атомный радиус, А° | 1,36 |
| Грамм-атомный объем, см 3 | 9,41 |
| Ионный радиус, А: | |
| Мо 2+ , А | 1,01 |
| Мо 4+ , А | 0,68 |
| Мо 6+ , А | 0,5 – 0,62 |
| Плотность, г/см 3 | 10,21 |
| Т. пл., °С | 2622±10 |
| Т. кип., °С | ~ 4864 |
| Кристаллическая решетка |
Пространственно-центрированная кубическая |
| Потенциал ионизации, В | 7,2 (Мо 0 → Мо1+ ) |
| Поперечное сечение захвата тепловых нейтронов, барн/атом | 2,7 |
Известна только одна (при обычном давлении) кристаллическая модификация металла с кубической объемно центрированной решеткой. В совершенно чистом состоянии компактный молибден пластичен, ковок, тягуч, довольно легко подвергается штамповке и прокатке. При высоких температурах (но не в окислительной атмосфере) прочность молибдена превосходит прочность большинства остальных металлов. При загрязнении углеродом, азотом или серой молибден, подобно хрому, становится хрупким, твердым, ломким, что существенно затрудняет его обработку. Водород очень мало растворим в молибдене, поэтому не может, заметно влиять на его свойства. Молибден – хороший проводник электричества, он в этом отношении уступает серебру всего в 3 раза. Электропроводность молибдена больше, чем у платины, никеля, ртути, железа и многих других металлов [20].
В обычных условиях молибден устойчив даже во влажном воздухе.
2.3 Природные соединения молибдена
Из 17 известных минералов Мо наиболее существенное промышленное значение до сих пор имеет молибденит MoS 2 [20].
Из руд, содержащих молибденит, добывают подавляющую массу молибдена. В зоне окисления молибденовых, медно-молибденовых и вольфрамо — молибденовых месторождений встречаются повеллит, молибдит (ферримолибдит) Fe 2 Os ∙3MoO3 ∙7H2 О молибдошеелит Са(Мо,W)O4 , вульфенит РЬМоО4 , чиллагит Pb(Mo, W)O4 , линдгренит Си3 (МоО4 )2 (ОН)2 и другие комплексные минералы (с висмутом, мышьяком, оловом и т. д.) Первые три минерала последнее время приобретают некоторое промышленное значение [23].
Это связано с тем, что по мере выработки богатых чисто сульфидных молибденовых и комплексных месторождений начинают разрабатываться месторождения смешанных сульфидно-окисленных руд. В сульфидных месторождениях окисленные минералы встречаются как в виде пленок на молибдените, так и в виде самостоятельных кристаллов вторичного происхождения.
Молибденит – минерал черного цвета, внешне очень похожий на графит. Имеет чешуйчатое строение. Кристаллизуется в гексагональной слоистой решетке [20].
При нормальной температуре химически устойчив. Начинает окисляться на воздухе выше 300 – 400°С. При 500 – 550°С сгорает полностью до МоО 3 и частично до МоО2 . При более высокой температуре получающийся МоО3 возгоняется и, охлаждаясь, образует друзы бледно зеленоватых игл. Плотность минерала 4,75, твердость по Моосу 1. Молибденит обладает хорошими смазывающими свойствами. Постоянная примесь в нем – рений.
Повеллит – наиболее распространенный минерал зоны окисления молибденовых месторождений. Серый. Плотность 4,3, твердость
по Моосу 3,5. Кристаллизуется в бипирамидах тетрагональной системы. При облучении ультрафиолетовым излучением люминесцирует.Это может использоваться в анализе и обогащении руд. Цвет люминесценции желтый. Очень хрупок и поэтому переизмельчается при дроблении.
Молибдо — шеелит – разновидность шеелита, в которой часть атомов W замещена атомами Мо (обычно не выше нескольких процентов).
Разности, содержащие до 15% Мо, носят название зейригит [20, 23]. Кристаллы молибдо — шеелита, как и повеллита, — тетрагональные бипирамиды. Плотность 5,8—6,2, твердость по Моосу 4,5. Минерал, содержащий более 0,5% W, в ультрафиолетовых лучах люминесцирует желтым цветом.
Молибдит Fe 2 (MoO4 )3 ∙7H2 O, или Fe2 O3 ∙xMoO3 ∙yH2 O, — чешуйчатый, мягкий минерал серо-желтого цвета. Образуется в участках месторождений, содержащих большое количество железных минералов.
Вульфенит РЬМоО 4 – минерал тетрагональной сингонии. Образует буро-коричневые или красные бипирамиды.
Другие минералы молибдена встречаются, в частности, в урановых полиметаллических месторождениях, осадочных породах органического происхождения.
Промышленные молибденовые руды делятся по форме рудных тел и минеральному составу на жильные (кварцевые), прожилково-вкрапленные (медно-молибденовые, медные порфировые, с молибденом) и скарновые (молибденовые, волъфрамо-молибденовые, медно-молибденовые).
Ранее наибольшее значение имели кварцевые жильные месторождения. Среднее содержание молибдена в них было 0,3 – 0,4% и до 1 %. Они в основном выработаны. Сейчас наибольшее значение имеют молибденовые, медно-молибденовые и медно-порфировые месторождения прожилково-вкрапленного типа, а также скарновые. В первых молибдена 0,05 – 0,15%, а в наиболее крупных (Клаймакс, США) – до 0,4% [20].
Вкрапленность молибдена в них значительно более мелкая, чем в жилах. Сопутствующие рудные минералы – халькопирит, пирит, реже другие сульфиды, арсениды, магнетит. Как из медно-молибденовых, так и из медно-порфировых руд молибден добывают попутно с медью. Это экономически выгодно и в случае очень низкого содержания молибдена.
Скарновые руды – это руды, образовавшиеся на контакте известняков и кислых пород типа гранитов. Сопутствующие рудные минералы в них те же, что и в предыдущих типах руд. Но особенно обычен комплекс с шеелитом и другими вольфрамсодержащими минералами. Из нерудных минералов преобладают кварц, кальцит, флюорит. Оболочки вторичных окисленных образований осложняют обогащение сульфидной руды. Обогащение осложняется также мелкой вкрапленностью сульфидных минералов, большим содержанием кальцита, доломита, флюорита.
2.4 Электронная структура атома, его расположение в периодической системе химических элементов Д. И. Менделеева
Порядковый номер элемента в периодической системе химических элементов Д. И. Менделеева равен 42 [1, 5, 12]. Это значит, в молекуле молибдена будет 42 электрона.
Электронная формула молибдена будет такова: ![]()
Составим также его электронно-графическую формулу:
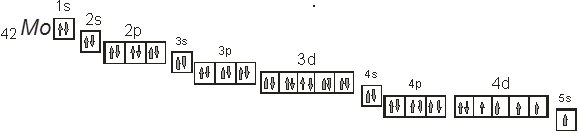
Рис. 1. Электронно-графическая формула молибдена.
На рис. 1 приведена электронно-графическая формула молибдена, на которой указано расположение всех электронов в атоме молибдена.
Порядковый номер химического элемента в периодической системе химических элементов – 42. У молибдена на электронных уровнях находится 42 электрона, а в ядре должно находится также 42 протона.
Молибден расположен в периодической системе химических элементов в пятом периоде, это значит, что у него будет пять электронных слоев с расположенными на них электронами. Главное квантовое число внешнего электронного уровня равно 5.
Молибден расположен в шестой группе, побочной подгруппе. Молибден относят к элементам подгруппы хрома, в которую входят хром, молибден и вольфрам, которые обладают похожими свойствами. У него будет на электронных уровнях один s-электрон и 5 d-электронов на предвнешнем уровне.
В состав ядра атома изотопа молибдена-96 входят 42 протона ( p ) и 54 нейтрона (n ): ![]() , где массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента; верхний индекс означает массовое число, нижний – заряд ядра. Количество нейтронов ядра элементов определяют по массовому числу элемента за вычетом количества протонов.
, где массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента; верхний индекс означает массовое число, нижний – заряд ядра. Количество нейтронов ядра элементов определяют по массовому числу элемента за вычетом количества протонов.
Таким образом, в состав атома молибдена входят ядро, состоящее из 42 протонов, 54 нейтронов и электронное облако, представленное 42 электронами.
Вследствие устойчивости d 5 -конфигурации энергетически оказывается более выгодным переход одного из ns-электронов в (n-1) d-состояние. Поэтому молибден, как и хром в s-состоянии внешнего уровня имеют по одному, а в предпоследнем слое по 13 электронов. Таким образом, имеет место «проскок» электрона:
![]()
Проскок электрона можно объяснить с точки зрения квантово-механических представлений повышенной энергетической стабильностью конфигурации: 4d 5 [1, 5].
Покажем расположение валентных электронов в атоме молибдена. Как видно из электронной формулы молибден относится к d-элементам, поскольку у него заполняется 4d-подуровень.
![]()
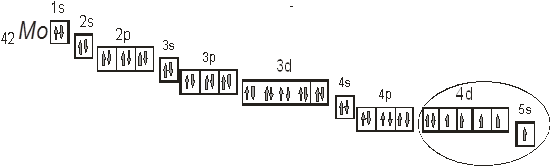
Рис. 2. Расположение валентных электронов в атоме молибдена.
На приведенном рис. 2 эллипсом выделено расположение валентных электронов в атоме молибдена. Как видно в создании химической связи будут брать участие электроны как 5s- так и 4d-подуровня.
Поскольку молибден расположен в шестой группе периодической системы, и не в главной подгруппе, а в побочной, то он относится к металлам. В химических реакциях он будет проявлять металлические свойства. Для металлов более приемлема отдача электронов. Поэтому молибден может отдавать максимум шесть электронов с ![]() — подуровня и с 4d-подуровня. Поэтому молибден будет проявлять степень окисления +2, +3, +4, +5, +6. соединения с этими степенями окисления обладают разной стойкостью, наиболее стойкими будут соединения с степенью окисления равной +6 [1].
— подуровня и с 4d-подуровня. Поэтому молибден будет проявлять степень окисления +2, +3, +4, +5, +6. соединения с этими степенями окисления обладают разной стойкостью, наиболее стойкими будут соединения с степенью окисления равной +6 [1].
2.5 Химические свойства молибдена, его оксидов и гидроксидов
Литой и плотно спеченный молибден при комнатной и слегка повышенной температуре стоек против действия воздуха и кислорода [1, 12]. При нагревании до темно-красного каления поверхность металла быстро тускнеет и около 600°С молибден загорается, выделяя белый дым – возгон МоО 3 . Налет окисла легко разрушается и при длительном нагревании происходит полное сгорание металла до МоО3 . Молибденовый порошок окисляется при еще более низкой температуре, а наиболее мелкий порошок способен самовозгораться на воздухе. При нагревании во влажной атмосфере, в среде восстановительного или инертного газа, не очищенных тщательно от кислорода и паров воды, наблюдается постепенное более или менее полное окисление металла по реакции:
![]()
При нагревании молибдена в токе SO 2 образуется смесь окислов и дисульфида молибдена, в токе НС1 – летучие хлориды (МоСІ3 ) и оксихлориды молибдена.
В растворах, содержащих окислитель (кислород, HNO 3 , НС1О3 и др.), молибден окисляется. Растворы при недостатке окислителя окрашиваются в синий цвет. Азотная кислота,одна и в смеси с соляной и серной – окисляет и растворяет металл:
![]()
При избытке кислоты из бесцветного раствора выпадает белый или слегка желтоватый осадок молибденовой кислоты Н 2 МоО4 . Концентрированная HNO3 задерживает растворение, создавая пассивирующую пленку окислов [22].
Разбавленная НС1 довольно хорошо растворяет компактный металл: за 18 ч потеря массы 20-30%. В концентрированной НС1 растворение более медленное: за 18 ч при 110°С потеря массы 0,34%:
![]()
Фтористый водород и плавиковая кислота быстро действуют на молибден, переводя его во фториды. Разбавленная H 2 SO4 (d=l,3 г/мл) слабо действует на молибден даже при 110°. Концентрированная H2 SO4 ( d= 1,82 г/мл) на холоду действует слабо: за 18 ч потеря массы 0,24%. При 200 – 250°С растворение идет быстрее. Фосфорная и органические кислоты воздействуют на металл слабо, но в присутствии окислителей (в том числе воздуха) растворимость заметно увеличивается.
Растворы щелочей и аммиака действуют на молибден медленно, но их действие усиливается окислителями с повышением температуры. При растворении молибдена в щелочах получаем молибдаты щелочных метал лов, реакция будет ускоряться при использовании расплавов щелочей:
![]()
Молибден стоек к действию влаги без аэрации, при аэрации молибден будет окисляться при условии, что он находится в контакте с другим менее активным металлом и есть гальванический элемент. В таком гальваническом элементе будет окисляться более активный металл.
Рассмотрим реакции взаимодействия молибдена с неметаллами. Молибден довольно активно реагирует с неметаллами (кремнием, бором, галогенами, серой и т. п.), учитывая то что молибден имеет несколько степеней окисления то получается в таких реакциях несколько продуктов.
2.5.1 С водородом
Молибден не реагирует с водородом с получением химических соединений. Имеет место только физическое растворение водорода в молибдене с образованием нестойких связей. Растворимость водорода в молибдене растет с повышением температуры до 0,5 см 3 в 100 граммах металла [20].
2.5.2 С галогенами
С молибденом фтор образует летучие фториды. Хлор и бром ре6агируют с ним при температуре красного каления. Йод реагирует с молибденом очень медленно. В присутствии влаги реакция с галогенами ускоряется и она становится возможной даже на холоду.
Молибден образует гексафторид MoF 6 , пентафторид MoF5 , тетрафторид MOF4 и трифторид MоF3 ; гексахлорид МоС16 , пентахлорид МоС15 , тетрахлорид МоС13 , трихлорид МоС13 и комплексный псевдодихлорид [Мо6 (С1)8 ]С14 ; тетрабромид МоВг4 , трибромид МоВг3 и комплексный псевдодибромид [Мо6 Вг8 ]Вг4 [20, 23]. С иодом достоверно известно лишь два соединения – дииодид МоІ2 и трииодид МоІ3 . Помимо этих соединений, известен ряд оксигалогенидов и несколько менее достоверных соединений.
5
2МоС1 5 + 12HF = 2MoF6 + 10НС1 + Н2
![]()
Гексафторид конденсируется при -70°С в виде белых кристаллов и отгоняется под вакуумом при 40°. Плавится при 17,5°С и кипит при 35°С. Молекула имеет октаэдрическую структуру с атомом металла в центре октаэдра и атомами фтора в вершинах его. Устойчив в сухом воздухе, хлоре, двуокиси серы. Гидролизуется:
MoF 6 + 4Н2 О = Н2 МоО4 + 6HF
Образует с фторидами щелочных металлов комплексные соли типа Me 2 (MоF8 ).
Трифторид молибдена получается нагреванием МоВг 3 в токе безводного HF. При нормальных условиях твердый. При нагревании во влажном воздухе диссоциирует:
4MoF 3 + 6Н2 О + 3O2 = 4МоО3 + 12HF
В сухом воздухе устойчив до 800°. При действии водорода восстанавливается до металла. Водой на холоду медленно разлагается.
У молибдена (VI) выделены два оксифторида -MoOF 4 и MоO2 F2 . Это твердые, белые, тяжелые кристаллические вещества, получающиеся фторированием молибдена в присутствии кислорода или обменными реакциями МоО3 с фторидами.
![]()
MoCl 6 термически очень неустойчив и чувствителен к малейшим следам влаги. Получен недавно длительным кипячением тионилхлорида с МоО3 .МоС15 получается хлорированием молибдена в отсутствие воды и воздуха при 600 – 750°С. Кристаллизуется в виде темно-зеленых тригональных бипирамид. Температура плавления 194°С, температура кипения 238°С. Плотность МоС15 2,9275. Он растворяется в безводном эфире,спиртах, углеводородах, кетонах, альдегидах, сероуглероде, аминах с образованием комплексов. При нагревании в отсутствии кислорода разлагается:
МоС1 5 = МоС13 + С12
Водород при 900°С восстанавливает его до металла:
2МоС1 5 + 5Н2 → 10НС1 + 2Мо
Восстанавливать можно над накаленной металлической нитью в токе его пара в смеси с водородом. В этом случае на нити осаждается плотный слой молибдена, но при 250° образуется трихлорид:
МоС1 5 + Н2 → МоСІ3 + 2НС1
При нагревании МоС1 5 в сухом воздухе образуется оксихлорид МоО2 С12 . При нагревании во влажном воздухе МоС15 полностью разлагается, образуя окси — и гидроксихлориды. В воде полностью гидролизируется с большим выделением тепла.
Тетрахлорид молибдена получается хлорированием МоО 3 смесью СІ2 и ССІ4 . При нагревании без доступа влаги и кислорода МоСІ4 диспропорционирует на MoCl5 и MoCl3 . При нагревании в присутствии влаги и кислорода образуются оксихлориды и гидроксихлориды. С рядом веществ, в том числе органических, тетрахлорид образует продукты присоединения.
Трихлорид МоС1 3 получается в виде твердого красного вещества частичным восстановлением MoCl5 водородом при 250°, а также пропусканием смеси паров МоС15 с инертным газом над молибденом.
![]()
Трихлорид разлагается, не плавясь. Сублимирует в токе инертного газа. Устойчив в сухом воздухе при нормальной температуре, а при нагревании переходит в оксихлориды. При нагревании в инертном газе разлагается наМоСІ 4 и комплексные нелетучие хлориды. Водой и водными растворами щелочей разлагается соответственно при нагревании и на холоду. С аммиаком образует комплексы. Окислителями окисляется до Н2 МоО4 . В соляной кислоте не растворяется. Растворяется в солянокислых растворах МоО3 , образуя комплексы.
Все бромиды получаются действием Вг 2 на Мо в среде СО. Так, черно-зеленые иглы тетрабромида получаются около 600°С при атмосферном давлении, тетрабромид – преимущественно при 350 – 500°С. При более низком давлении или несколько более высокой температуре получается смесь бромидов, в том числе комплексных. Известны также красно-оранжевые кристаллы диоксибромида МоО2 Вг2 и желтые игольчатые кристаллы бромомолибденовой кислоты H3 (MoO3 Br3 ).
![]()
Достоверно известен лишь диодид молибдена Mol 2 [23].
Получается он взаимодействием паров йода с металлом выше 1000°С:
![]()
Другие йодиды молибдена неизвестны.
2.5.3 С серой
Сера не реагирует с молибденом до температуры 400 – 450°С, при более высокой температуре образуется дисульфид молибдена MoS 2 :
![]()
Сероводород реагирует с молибденом при высокой температуре, образуя MoS 2 . В парах хлоридов серы образуются сульфохлориды молибдена.
Непрямыми методами были получены сульфиды молибдена MoS 3 , Mo2 S5 , Mo2 S3 . Первые два диссоциируют при температурах выше 400°С.
Помимо этих простых сульфидов известны также и полисульфид Mo(S 2 )2 ,тиомолибдаты Ме2 MoS4 . Высший сульфид MoS3 образуется при пропускании сероводорода через растворы молибдатов щелочных металлов:
![]()
Дисульфид молибдена ![]() – важнейший минерал молибдена. Он образуется в земной коре в высотемпературных условиях. Имеет сложную слоистую гексагональную кристаллическую решетку. Пары воды окисляют
– важнейший минерал молибдена. Он образуется в земной коре в высотемпературных условиях. Имеет сложную слоистую гексагональную кристаллическую решетку. Пары воды окисляют ![]() при красном калении. Кислоты-окислители разлагают
при красном калении. Кислоты-окислители разлагают ![]() , переводя его в
, переводя его в ![]() , неокисляющие кислоты не действуют на него. Сульфиды щелочных металлов и щелочи разлагают
, неокисляющие кислоты не действуют на него. Сульфиды щелочных металлов и щелочи разлагают ![]() при сплавлении.
при сплавлении.
2.5.4 С азотом
С азотом молибден не реагирует, азот незначительно растворяется в молибдене. Нитриды молибдена добыты другим путем.
При температуре 400 – 745°С порошок молибдена реагирует с аммиаком с получением нитридов молибдена: МоN, Mo 2 N, β-фаза, содержащая 28% азота. Во всех трех фазах были установлены определенные кристаллические структуры. В вакууме при нагревании они легко разлагаются.
Нитриды, как и карбид Мо 2 С и бориды, являются соединениями, в которых валентные соотношения не сохранены. Мо3 Nи Mo2 N относятся к так называемым фазам внедрения, в которых атом неметалла внедряется между атомами металла, при этом сохраняется кристаллическая структура последнего. МоNимеет более сложную структуру [8] и не может быть отнесен к фазам внедрения.
2.5.5 С углеродом
Молибден с углеродом образует два карбида: Мо 2 С и МоС [21, 23]. Это очень твердые, тяжелые, тугоплавкие металлоподобные соединения. Они близки по свойствам к фазам внедрения, имеющим металлический характер (проводимость, внешний вид и т. п.), обусловливаемый особенностями их атомно-кристаллической структуры. Мо2 С образуется при 2400°С. Это темно-серый порошок, получаемый обычно науглероживанием в твердой фазе смеси молибденового порошка и сажи при 1400- 1500°С. Может быть также получен науглероживанием накаленной молибденовой проволоки из газовой фазы или взаимодействием МоО3 с СО и углеводородами. МоС плавится при 2650°С. Карбиды молибдена, благодаря своей твердости и тугоплавкости, играют важную роль в инструментальной и других отраслях современной техники.
Молибден образует с окисью углерода под высоким давлением гексакарбонил Мо (СО) 6 . Он диссоциирует при 150°С. Это ромбоэдрические белые кристаллы, возгоняющиеся при пониженном давлении и комнатной температуре, растворимые в эфире и бензоле. С органическими основаниями образует комплексы. При разложении Мо(СО)6 в зависимости от условий образуется металлическое зеркало или порошок из мелких гранул молибдена.
2.5.6 С кислородом
Литой и плотно спеченный слиток молибдена при нормальной и несколько повышенной температуре стоек к действию кислорода и воздуха [20].
При нагревании до темно-красного каления поверхность металла быстро тускнеет и при 600°С молибден загорается выделяя дым – возгон МоО 3 . Налет окисла легко разрушается и при длительном нагревании происходит полное сгорание металла до МоО3 .
![]()
Молибденовый порошок окисляется при более низкой температуре, а мелкодисперсный порошок молибдена может самовозгораться на воздухе или в токе кислорода.
Рассмотрим ряд оксидов молибдена. Для молибдена были идентифицированы оксиды с химической формулой МоО 3 , и МоО2 . Ковалентность молибдена в оксидах равна 3 и 2. Кроме того, получены оксиды промежуточного между МоО3 и МоО2 состава: Мо8 О23 , Мо9 О26 ,Мо4 О11 , Мо17 О47 . характер связи в оксидах в основном ионный, частично ковалентный.
МоО и Мо 2 О3 не выделены в свободном состоянии, хотя ранее в литературе и упоминалось о их выделении [20, 23]. Рентгенографически идентифицирована фаза, содержащая кислород в количестве, соответствующему составу Мо3 О. оксид МоО2 более тугоплавок и термодинамически устойчив чем оксид МоО3 .
Поскольку молибден относится к металлам, то его оксиды должны проявлять основные свойства. Но оксиды МоО 3 , и МоО2 проявляют не основные свойства, а кислотные. Они дают ряд соединений общей формулой Н2 МоО4 и Н2 МоО3 . основные свойства проявляет оксид Мо2 О3 .
МоО 3 характерен гидрат состава Н2 МоО4 и Н2 МоО4 ×Н2 О. Н2 МоО4 — белые мелкие кристаллы гексагональной формы. Дигидрат Н2 МоО4 × Н2 О образуется при стоянии подкисленного раствора молибдатов в течении нескольких недель, а также при внесении затравки Н2 МоО4 × Н2 О в сильно подкисленный раствор парамолибдата аммония. Н2 МоО4 — молибденовая кислота, кислота средней силы, например, она более сильная чем угольная кислота и вытесняет ее из ее солей:
![]()
Гидраты окислов с валентностью металла между VI и IVполучены в виде соединений МоО(ОН) 3 и Мо(ОН)5 . сила этих электролитов очень слабая, они малорастворимы в воде.
МоО 2 характерен гидрат состава Н2 МоО3 , который в свободном состоянии не выделен, выделен только в растворах, также получены его соединения состава Ме2 МоО3 .слабый электролит.
Также при действии аммиака на растворы молибдатов получен Мо(ОН) 3 — аморфный порошок черного цвета, не растворим в воде и растворах щелочей, легко растворяется в минеральных кислотах и при отсутствии окислителей дает ионы Мо+3 .
Рассмотрим свойства Н 2 МоО4
Молибденовая кислота реагирует при повышенной температуре с оксидами, гидроксидами, карбонатами щелочных и щелочноземельных металлов давая соответствующие молибдаты.
![]()
![]()
![]()
![]()
![]()
![]()
Состояние молибденовой кислоты в растворах зависит от кислотности и разбавлености последних. При большом разбавлении (<10 -4 моль/л, РН>6,5) молибденовая кислота находится в растворе в виде простых молекул. В более концентрированных растворах и при РН меньше шести: РН<6 происходит полимеризация молекул. Степень сложности образованных комплексов также зависит от температуры.
Рассмотрим свойства Мо(ОН) 3
Сухой Мо(ОН) 3 — это аморфный порошок, не растворимый в воде и растворах щелочей. Он проявляет основные свойства. Легко растворяется в растворах минеральных кислот, при этом образуются соли Мо3+ .
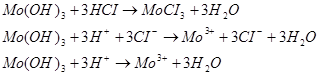
2.6 Биологическая роль молибдена
Молибден – один из основных микроэлементов в питании человека и животных. Он содержится во многих живых тканях и необходим для поддержания активности некоторых ферментов, участвующих в катаболизме пуринов и серосодержащих аминокислот [1].
Активной биологической формой элемента является молибденовый кофермент (molybdenum cofactor, Moco) – низкомолекулярный комплекс небелковой природы, действующий в составе ферментов и необходимый для осуществления специфических каталитических превращений. Moco является коферментом четырех важных ферментов: ксантиндегидрогеназы, ксантиноксидазы, сульфитоксидазы и альдегидоксидазы. Ксантиндегидрогеназа катализирует превращение гипоксантина в ксантин, а затем в мочевую кислоту. Этот фермент, наряду с ксантиноксидазой, участвует в метаболизме пурина (образование NADH из NAD+).
Сульфитоксидаза, находясь в митохондриях, участвует в метаболизме серосодержащих аминокислот – цистеина и метионина – и катализирует окисление сульфита в сульфат. Альдегидоксидаза принимает участие в реакциях катаболизма пиримидинов и биотрансформации ксенобиотиков – чужеродных для организма человека и животных веществ, порожденных в той или иной степени хозяйственной деятельностью человека и не входящих естественным образом в биотический круговорот. Именно со способностью альдегидоксидазы катализировать окисление в организме канцерогенных ксенобиотиков связывают предполагаемую антираковую активность молибдена.
| ДНЕВНЫЕ НОРМЫ ПОТРЕБЛЕНИЯ МОЛИБДЕНА | |
|
Возраст, лет |
(мкг/день) |
| Младенцы, 0–0,5………………………………………………………………………………………………………………………………………………….. | 15–30 |
| 0,5–1……………………………………………………………………………………………………………………………………………………………………… | 20–40 |
| Дети, 1–3………………………………………………………………………………………………………………………………………………………………. | 25–50 |
| 4–6…………………………………………………………………………………………………………………………………………………………………………. | 30–75 |
| 7–10………………………………………………………………………………………………………………………………………………………………………. | 50–150 |
| 11–18…………………………………………………………………………………………………………………………………………………………………….. | 75–250 |
| От 19 и старше | 75–250 |
Несмотря на то, что молибден является малораспространенным элементом, случаи его дефицита в организме человека редки.
В приведенной в тексте таблице указаны нормы потребления молибдена в зависимости от возраста человека, из данных таблицы можно сделать вывод, что в возрастанием возраста человека потребность в молибдена также возрастает. Недостаток молибдена вызывает тяжелые заболевания. Наиболее богатые элементом № 42 пищевые продукты: бобовые и злаковые растения, листовые овощи, молоко, фасоль, печень и почки.
2.7 Применение молибдена
Несколько столетий ученым в Европе не удавалось разгадать тайну остроты и прочности древних самурайских мечей и изготовить холодное оружие с подобными свойствами и только в 19 в. в мечах 14 в. была обнаружена примесь молибдена, обусловливающая их высокую прочность. Долгое время с момента открытия молибдена К. Шееле этот металл оставался лабораторной редкостью до того, как в конце 19 века был предложен промышленный способ извлечения молибденита. В 1891 французская фирма Schneider & Co впервые начала использовать молибден в качестве легирующей добавки, придающей стали одновременно высокую твердость и вязкость [20, 23]. Резкий скачок в объеме потребления молибдена произошел во время Первой мировой войны, так как темпы производства металлического вольфрама, использовавшегося в качестве легирующей добавки в производстве броневой стали, явно отставали от темпов его увеличивающегося потребления. К этому времени уже были известны замечательные свойства молибдена как легирующей добавки, но основные проблемы были связаны с нехваткой разведанных месторождений молибденита. Интересно, что 75-миллиметровая броня (сталь, легированная марганцем) появившихся на полях сражений в 1914 – 1918 годах танков англо-французских войск легко пробивалась 75-миллиметровыми снарядами немецкой артиллерии. Стоило только добавить молибден (в количестве всего 1,5–2%) к стали, как эти снаряды становились бессильны даже против 25-миллиметровых броневых листов.
Из всего количества молибдена, потребляемого промышленностью, до 80% используется в черной металлургии для производства жаропрочных, жаростойких антикоррозионных, инструментальных, быстрорежущих, магнитных, конструкционных сталей, жаропрочных и жаростойких чугунов. Молибден повышает прочность сталей на холоду и содействует ее сохранению при высокой температуре, повышает жаростойкость сталей и чугуна, улучшает способность принимать закалку, 1 вес. ч. Мо повышает прочность стали эквивалентно 2 — 2,5 вес. ч. вольфрама.
Молибден в стали входит в состав как свободных выделений карбидов, так и твердого раствора. Присадка его в сталь способствует созданию мелкозернистой структуры. Вследствие этих причин и повышается прочность стали на холоду, при повышенной температуре, кратковременной и длительной нагрузке. Молибден также повышает способность стали к цементации. В магнитных сталях и сплавах он увеличивает магнитную проницаемость. Придает жаропрочность и жаростойкость ряду сплавов на основе цветных металлов.
В жаропрочных сплавах с цветными металлами потребляется около 4 – 5% вырабатываемого молибдена. Также около 5 – 6,5 % Мо выпускают в виде проволоки, прутков, листа для электро — и радиотехнической промышленности и других назначений. Для реактивов, красок и других химикатов используется 4 – 5% Мо. Возрастает и его применение в сельском хозяйстве.
Молибден вводят в стали в виде сплава с железом — ферромолибдена [14].
Молибдена в ферросплавах не менее 50%.
Проволока и прутки из чистого молибдена применяются для холоднокатаной арматуры, вводов, анодов радио- и электроламп, элементов сопротивления высокотемпературных печей с защитной атмосферой, высокотемпературных термопар. Листовой молибден применяется в машиностроении как жаропрочный материал, а в радиоэлектронике – для анодов мощных радиоламп, защитных экранов высокотемпературных электропечей и для других целей. Из молибденового порошка получают «псевдосплавы» (сплавы-смеси) с серебром для электротехнических контактов, карбид молибдена применяется в твердых сплавах, силицид молибдена MoSi 2 – в жаростойких изделиях. Последний, как указывалось, применяется в элементах сопротивления электропечей, работающих до 1600°С без защитной атмосферы. Соединения молибдена применяются как катализаторы в органическом синтезе и как реактивы в аналитической химии (парамолибдат аммония и комплексные соединения молибдена), в производстве лаков и красок для шерсти и шелка. В сельском хозяйстве используются соединения молибдена в виде слабых растворов: он облегчает усвояемость растениями питательных веществ из почвы. Но в то же время большие дозы молибдена оказывают токсическое действие на растительные и животные организмы.
Из MoS 2 готовят сухую смазку для деталей механизмов, работающих при повышенной температуре. Его смазывающее действие эффективнее, чем графита.
Молибденовые рудные концентраты перерабатывают на ферромолибден, молибдат кальция, МоО 3 , парамолибдат аммония, MoS2 . Первые два – полуфабрикаты для производства молибденсодержащих сталей, парамолибдат аммония – полуфабрикат для производства чистых соединений молибдена и самого молибдена.
Первое место в мире по потреблению молибденовой продукции занимает Западная Европа (35%), за ней следуют США (25%) и Япония (17%).
На долю этих регионов приходится более 90% мирового использования молибдена [20].
В последние годы значительно увеличился выпуск молибденовых концентратов в Канаде и Чили, которые в мире вышли в этой области соответственно на второе и третье места. Значительные залежи молибденовых руд есть в России, которая также производит довольно большие количества его как для собственной металлургической промышленности так и на экспорт. Товарная продукция молибдена в США выпускается в виде трехокиси, порошка молибдена, молибдатов аммония и натрия, ферромолибдена, сульфида молибдена MoS 2 и др.
2.8 Экологическое влияние отходов молибденовой промышленности
При переработке молибденовых руд большое количество молибдена теряется на разных этапах переработки сырья. При этом возможно как отравление персонала работающего на предприятии так и негативное влияние на природу.
Токсичность молибдена проявляется при поступлении молибдена более 15 мг в сутки. При поступлении таких количеств молибдена наблюдаются следующие симптомы:
- истощение, токсикоз;
- подагра (при сопутствующем дефиците кальция);
- нарушение функций иммунитета;
- изменение функций костного мозга, тимуса, селезенки;
- хронический профессиональный молибденоз (повышение содержания мочевой кислоты и молибдена в сыворотке крови, артрозы, гипотония, анемия и лейкопения, желудочно-кишечные заболевания, атаксия, резкие нарушения обмена веществ).
«молибденовая подагра» (болезнь Ковальского), которая часто встречается в Армении.
При поступлении молибдена в больших количествах он усваивается растениями, растения содержат молибден в листьях и побегах. При этом они становятся токсичны. Растения имеют свойство извлекать и концентрировать молибден в зеленой массе, поэтому его содержание в ней будет выше, чем в почве. Это приведет к отравлению молибденом животных. Поэтому отвалы после переработки молибденовых руд следует покрывать слоем земли для упреждения разноса ветром породы. Также такие отвалы следует изолировать от грунтовых вод, поскольку молибден может просачиваться в грунтовые воды и отравлять их [1, 3].
3.1 Основы технологии переработки молибденовых руд
Основной метод обогащения молибденовых руд – флотация. Наиболее просто обогащаются руды жильных кварц молибденовых месторождений. В результате первоначальной коллективной флотации получают концентрат с 5 – 10% Мо [2, 8]. Селективную флотацию молибденита проводят затем при подавлении флотации других сульфидов. После переочисток получают стандартный концентрат с 80 – 90% MoS 2 при общем извлечении до 90 – 95 % и выше. Низкосортные молибденовые концентраты и промежуточные продукты подвергают «химическому» обогащению, иначе говоря, гидрометаллургической переработке с получением в итоге молибдата кальция для ферросплавной промышленности. Такая комбинация флотационного обогащения и гидрометаллургической обработки позволяет экономичнее достигать большего извлечения молибдена из руды, чем это можно было бы сделать флотационными методами. Концентраты, содержащие молибден в виде молибденита, обрабатывают, прежде всего, для окисления серы сульфидов. С этой целью в промышленности наиболее часто прибегают к окислительному обжигу. Вместо обжига может применяться малораспространенная в заводской практике обработка сильными окислителями в водной среде: азотной кислотой, гипохлоритом, кислородом или воздухом под давлением, либо хлорирование [8].
Огарки, получаемые после обжига богатых и чистых концентратов, используют в производстве ферромолибдена, для получения чистой трехокиси методом возгонки и для химической переработки на чистые соединения молибдена. Последние, в свою очередь, могут использоваться для получения металла высокой чистоты. Огарки от обжига более бедных, низкосортных концентратов и промпродуктов обогащения обязательно подвергают химической переработке. В процессе обжига до 30 – 40% Мо и основная масса Re переходят в пыль и газы.
Первичная обработка в окисляющих растворах может быть применена для любых концентратов. Растворы, полученные после окислительного выщелачивания концентратов, очищают от примесей, после чего из них выделяют необходимые соединения молибдена и рения. Из полученных растворов чистые молибденовые и рениевые соединения могут быть селективно выделены ионообменом или экстракцией.
3.2 Получение парамолибдата аммония ( NH 4 )6 Mo7 O24 × 4H2 O
Химическую переработку «огарков» после обжига богатых высококачественных концентратов производят с целью получения чистых соединений молибдена – парамолибдата аммония и молибденового ангидрида [20, 23]. Из этих последних в случае необходимости легко получить любые другие соединения, в том числе и соединения высокой чистоты. Молибденовый ангидрид, находящийся в огарке, растворяется в растворах аммиака, щелочей, соды, некоторых кислот. Но щелочные металлы – нежелательные примеси для соединений молибдена, применяемых в электротехнической и химической промышленности. В щелочах, соде и кислотах растворяется большое число и других примесей.
Раствор аммиака обладает тем преимуществом, что в нем не растворимо большинство примесей, сопутствующих молибдену в огарке. Поэтому аммиачный способ переработки богатых молибденовых огарков более распространен. Его преимуществами, помимо высокого извлечения МоО 3 в раствор и достаточно полного отделения примесей, являются простота дальнейшей очистки аммиачного раствора, легкость выделения молибдена в виде чистого парамолибдата аммония, простота подбора материала для аппаратуры. Схема аммиачного метода переработки огарков после обжига молибденита представлена на рис.3
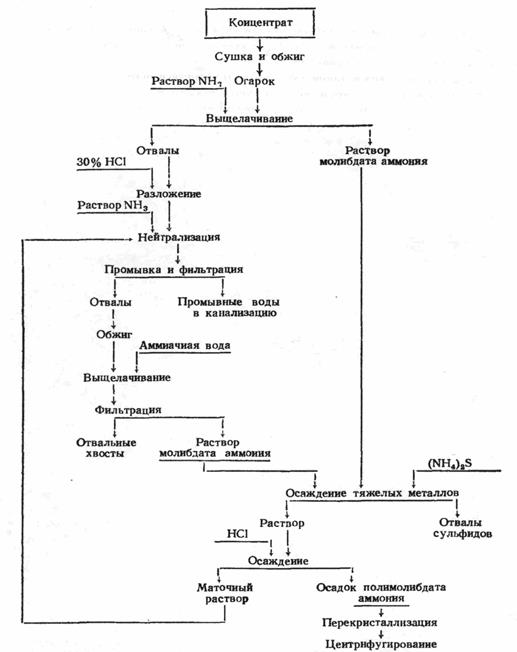
Рис. 3. Cхема переработки огарков с кислотным разложение хвостов выщелачивания
Перед обработкой раствором аммиака рекомендуется промывать огарок водой для удаления растворимых в воде сульфатов (CuSO 4 , части CaSO4 и др.) и солей щелочных металлов. Но так как при этом несколько теряется молибден, то промывают не всегда. Потеря молибдена при промывке достигает 4 – 5% [20].
При обработке огарка аммиаком происходят реакции:
MoO 2 + 2NH4 OH = (NH4 )2 МоО3 +H2 О
CuO + 4NH 4 OH = [Cu(NH3 )4 ](OH)2 + 3H2 O
CuMoO 4 + 6NH4 OH = [Cu (NH3 )4 ] (OH)2 + (NH4 )2 MoO4 + 4H2 О
ZnMoO 4 + 6NH4 OH = (NH4 )2 MoO4 + [Zn (NH3 )4 ] (OH)2 + 4H2 O NiMoO4 + 6NH4 OH = (NH4 )2 MoO4 + [Ni (NH3 )4 ] (0H)2 + 4H2 O
Аналогично молибдатам реагируют сульфаты меди, цинка, никеля и железа, если они образовались при обжиге. Железо (II) (в составе сульфата или окиси) частично реагирует по уравнению
FeSO 4 + 4NH4 OH → [Fe (NH3 )4 ] SO4 + 4H2 О
и переходит в раствор в составе комплекса. Железо (III), образующееся в результате окисления Fe 2+ кислородом воздуха при обжиге и выщелачивании, частично остается в составе химически стойкого Fe3 O4 , частично дает нерастворимую гидроокись Fe(OH)3 .
Остаются без изменения МоО 2 , СаМоО4 , кварц, неокислившиеся при обжиге сульфиды. В аммиачные растворы в зависимости от минералогического состава концентрата и условий обжига переходит 80 – 95% молибдена. Для более полного перевода молибдена в раствор добавляют 60 – 80 кг (NH4 )2 CO3 на 1 т огарка. Влияние карбоната аммония на извлечение молибдена связано со следующими реакциями:
CaSО 4 + (NH4 )2 MoO4 → CaMoO4 + (NH4 )2 SO4
CaSО 4 + (NH4 )2 CO3 → Ca CO3 + (NH4 )2 SO4
Растворимость CaSO 4 и СаМоО4 соответственно 2 и 0,028 г/л при 20°С. Поэтому реакция смещена в сторону образования СаМоО4 . Без добавки (NH4 )2 CO3 в процессе выщелачивания раствором аммиака сульфат кальция, образовавшийся в огарке в ходе обжига, превращается в СаМоО4 , устойчивый в аммиачных растворах. Добавка (NH4 )2 CO3 ведет к образованию СаСО3 из CaSO4 . Возможно и частичное растворение СаМоО4 :
СаМоО 4 + (NH4 )2 CO3 = (NH4 )2 МоО4 + СаСО3
Осаждение СаСО 3 на частицах CaSO4 затрудняет растворение последнего [20].
Осаждение его же на зернах СаМоO 4 прекращает растворение последнего. Кроме того, благодаря наличию ионов СО![]() в растворе в отвальные хвосты переходит не гидроокись железа, а карбонат, который меньше адсорбирует молибден. Это снижает переход молибдена в остатки от выщелачивания. Сухой остаток после выщелачивания и сушки составляет 10 – 30% от массы огарков. В нем 5 – 25% Мо. Поэтому на заводах дополнительно обрабатывают остаток по особой схеме.
в растворе в отвальные хвосты переходит не гидроокись железа, а карбонат, который меньше адсорбирует молибден. Это снижает переход молибдена в остатки от выщелачивания. Сухой остаток после выщелачивания и сушки составляет 10 – 30% от массы огарков. В нем 5 – 25% Мо. Поэтому на заводах дополнительно обрабатывают остаток по особой схеме.
В заводских условиях огарок выщелачивают 8 – 10%-ным раствором аммиака при 20 – 60° С [23].
Процесс проводят во вращающихся горизонтальных герметических стальных барабанах с шарами или в вертикальных реакторах с мешалками. Вращающиеся герметические барабаны более экономичный по извлечению молибдена, и по расходу аммиака процесс. Процесс в обоих случаях периодический и идет в несколько стадий, хотя в принципе возможна организация непрерывного или полунепрерывного выщелачивания в каскадах герметизированных реакторов. Раствор с первых стадий поступает на очистку и дальнейшее извлечение молибдена. Слабые растворы и промывные воды поступают на первую стадию. Общий расход аммиака на всех стадиях в зависимости от состава концентрата и аппаратуры колеблется в пределах 115 – 140% от теоретически необходимого количества. В крепких растворов плотность более 1,1 г/см 3 ,они содержат 140 – 190 г/л МоО3 . Остатки от выщелачивания отфильтровывают на фильтрах непрерывного или периодического действия [8].
В последнее время предложено выщелачивать огарки аммиаком в кипящем слое. Это интенсифицирует выщелачивание и может осуществляться в непрерывном процессе.
Концентрированные растворы после фильтрования очищают от тяжелых металлов, осаждая их в виде сульфидов:
Me 2+ +NH4 HS = MeS + NH4 + + H+
где Ме 2+ -Cu2+ , Pb2+ .
Fe 2+ частично осаждается в виде FeS, частично захватывается осадком других сульфидов. Благодаря очень малому произведению растворимости сульфидов, все тяжелые металлы осаждаются практически полностью. Это, в частности, можно наглядно наблюдать по исчезновению характерной интенсивной сине-фиолетовой окраски раствора…………………………………………….. характерной для медно-аммиачного комплекса..
Из очищенного аммиачного раствора молибден может быть выделен:
1) кристаллизацией парамолибдата аммония;
2) осаждением тетрамолибдата;
3) осаждением молибденовой кислоты;
4) осаждением СаМоО 4 :
7 (NH4 )2 МоО4 =3(NH4 )2 О
- 7МоО8 ∙ 4Н2 О + 8NH3
4 (NH 4 )2 MoO4 + 5H2 O = (NH4 )2 О ∙ 4MoO3 ∙ 2H2 O + 6NH4 OH (NH4 )2 МоO4 + 2HNO3 = Н2 МоО4 + 2NH4NO3
(NH 4 )2 MoO4 + СаС12 = CaMoO4 + 2NH4 C1
Кристаллизацию парамолибдата производят в несколько стадий. После первых стадий получается наиболее чистый продукт, но с небольшим выходом. Увеличения выхода достигают дальнейшей, более глубокой кристаллизацией, но при этом продукт получается более низкого качества. Молибденовая кислота частично растворима в кислотах и выделяется в виде трудно отстаивающихся и трудно промываемых осадков. Осаждение тетрамолибдата дает высокое извлечение молибдена и богатый молибденом продукт. Осадок его лучше отстаивается, но продукт требует переочистки. Осаждение СаМоО 4 из аммиачных растворов нерационально, так как он применяется лишь при выплавке ферромолибдена и может быть получен более простым путем. Для других же целей требовалась бы дальнейшая химическая переработка СаМоО4 . Введение иона Са2+ усложняло бы дальнейшую очистку соединений молибдена.
Для осаждения парамолибдата аммония аммиачный раствор упаривают до 400 г/л МоО 3 , что соответствует плотности раствора 1,40 г/см3 . В производственных условиях выпаривают сначала до плотности 1,20 – 1,23 г/см3 . После этого дают отстояться дополнительно выпавшему осадку сульфидов Cu(II), Fe(II), Pb(II) и гидроокиси железа. Осадок отделяют, раствор упаривают далее. Горячий раствор фильтруют и направляют в кристаллизаторы. Кристаллизовать рациональнее при перемешивании и искусственном охлаждении. При этом выделяются более мелкие кристаллы, но процесс протекает быстрее. После первых двух операции получают продукт наивысшей чистоты [9, 17]. Последующие кристаллы более грязны. Их либо направляют на перекристаллизацию, либо квалифицируют более низшим сортом. Выпаривают и кристаллизуют в аппаратуре, стойкой против действия раствора аммиака.
3.3 Получение молибденовой кислоты Н 2 МоО4 или молибдата кальция СаМоО4
Остатки (отвалы) от выщелачивания раствором NH 3 огарков, полученных после обжига богатых молибденовых концентратов, могут содержать до 20 – 25% Мо в составе соединений, не разлагаемых растворами аммиака, — СаМоО4 , MoO2 , MoS2 . Молибден из остатков от выщелачивания извлекают одним из трех методов: 1) спеканием остатков (отвалов) с содой и последующим выщелачиванием спеков водой; 2) выщелачиванием растворами соды в автоклавах; 3) обработкой отвалов кислотами. В первых двух способах молибден переходит в раствор в составе Na2 MoО4 :
СаМоО 4 + Na2 CO3 = Na2 MoO4 + СаСО3
2МоО 2 + О2 + 2NaСО3 = 2Na2 MoO4 + 2CO2
2MoS 2 +6Na2 CO3 + 9О2 = 2Na2 MoO4 + 4Na2 SO4 + 6 CO2
Из раствора Na 2 MoO4 молибден осаждается в составе молибдатов кальция или железа (после удаления избытка ионов СО![]() частичной нейтрализацией кислотой):
частичной нейтрализацией кислотой):
NaMoO 4 + СаС12 = СаМоО4 + 2NaCl
3Na 2 MoO4 + 2FeCl3 — Fe2 O3 ∙ ЗMоО3 + 6NaCl
Получаемые молибдаты кальция и железа (III) используются в промышленности ферросплавов. Кроме того, молибдат железа может быть разложен раствором аммиака:
Fe 2 O3 ∙ ЗMоО3 + 6NH4 OH = 3(NH4 )3 MoO4 + 2Fe (OH)3
Полученный аммиачный раствор после очистки перерабатывают на парамолибдат аммония. При кислотной обработке отвалов используется азотная или соляная кислота. Молибдаты разлагаются кислотами, выделяя молибденовую кислоту:
СаМоO 4 + 2HNO3 = Н2 МоО4 + Ca (NO3 )2
MOS 2 и МоО2 , оставшиеся в отвалах в результате неполного окисления концентрата при обжиге, окисляются при выщелачивании азотной кислотой, также образуя молибденовую кислоту:
MоS 2 + 14HNO3 = Н2 SО4 + 12NO2 + 2NO + 4H2 O
При обработке отвалов на холоду соляной кислотой образующаяся молибденовая кислота переходит в раствор. Это удобно при переработке отвалов, содержащих значительное количество соединений вольфрама. Вольфрамат кальция соляной кислотой на холоду не разлагается. Таким образом можно в принципе частично разделять соединения вольфрама и молибдена. Поэтому солянокислая обработка рациональна, если в отвалах от аммиачного выщелачивания есть соединения вольфрама.
Режим и схема спекания отвалов с содой следующие. Смесь отвалов с содой спекают 6 – 9 частями при 700 – 750°С на поду пламенной печи. Спек выщелачивают водой. Пульпу фильтруют и промывают. Из фильтрата осаждают молибдаты железа или кальция (молибдат железа осаждается при рН 3,5 – 5).
В осадке получается смесь молибдата и гидроокиси железа. Осадок выщелачивают раствором аммиака. Полученный раствор молибдата аммония перерабатывают на парамолибдат аммония обычным путем. Хвосты после выщелачивания осадка молибдата железа содержат 1 – 1,5% МоО 3 и являются отвальными. Выщелачивают отвалы растворами соды в автоклавах при 180 – 200°С, что соответствует давлению 12 – 15 атмосфер. Автоклавный процесс рационален при низком содержании MoS2 и МоО2 в отвале [20].
3.4 Возгонка из огарков МоО 3
Возгонка и испарение из расплава МоО 3 применяются для получения чистого окисла [20, 23]. Возгонка начинается заметно с 800°С, расплав кипит при 1150°С. Способы возгонки и испарения МоО3 из расплава дают возможность получить чистый МоО3 по очень короткой схеме. Количество МоО3 , испарившегося с поверхности расплава при 930°С за 1,5 ч (1,0 г/см2 )10-4 , за 4 ч (1,5 г/см2 )10-4 . Значительное влияние на возгонку МоО3 оказывают примеси. Это связано с образованием молибдатов, особенно Са и Mg, устойчивых при температуре испарения. Эти соединения растворяются в расплаве МоО3 , понижая упругость его пара. Упругость пара молибдатов повышается с температурой, и перенос примеси увеличивается. Так, давление пара РbМоО4 при 1016°С 0,08, при 1060°С 0,23 мм. рт. ст. В процессе возгонки к порошку МоО3 добавляют кварц, облегчающий разгрузку невозогнанного остатка. В противном случае остаток МоО3 налипает на под и пропитывает его.
В промышленности при малом масштабе производства МоО 3 при 1100 — 1200°С возгоняют в тигельных наклонных вращающихся электропечах, при большом масштабе – в карусельной электропечи с вращающимся подом и силитовыми нагревателями. На поду находится слой кварцевого песка. Воздух в тигли вдувают через трубку на поверхность испарения, а возгон выносится током воздуха из тигля через приемный зонт и трубопровод в приемные устройства. В карусельных печах воздух продувают над поверхностью пода; газы выносятся через отверстия в своде печи в общий приемный коллектор, далее в кулеры и мешочные фильтры. В печи есть две зоны: зона питания с загрузочными бункерами и зона возгонки с отверстиями для вывода возгона и пара. За один оборот пода возгоняется около 60% МоО3 , имеющегося в огарке. Подовый остаток поступает на химическую переработку растворением или на выплавку ферромолибдена. За сутки печь дает 3,75 т чистой МоО3 . Чистота зависит от температуры, состава исходного огарка и может быть достаточно высокой. Повышение температуры снижает чистоту возгона, которая колеблется от 99,5 до 99,75%.
Исходные для возгонки огарки получаются обжигом богаты и
чистых концентратов и содержат 80 – 90% МоО 3 . Для этого в концентратах должны быть не менее 60% молибдена, ~5% SiO2 и сотые доли процента примесей металлов.
3.5 Получение гетерополикислот
Тетрамолибдат аммония, или, точнее, полимолибдат, так как состав осадка может отклоняться от формулы (NН 4 )2 О∙4МоО3 ∙2Н2 О, осаждают, нейтрализуя аммиачный раствор кислотой, непрерывно перемешивая, до рН 2,5 – 3,5; температуру поддерживают около 55°С [23].
При начальной концентрации раствора 280 – 300 г МоО 3 на 1 л в осадок в составе полимолибдата выделяется 96 – 97% Мо, находившегося в растворе до нейтрализации. Необходимо быстро отделять осадок полимолибдата от маточного раствора, иначе может образовываться мелкокристаллическая труднофильтрующаяся безводная соль. Осадки достаточно чисты, так как примеси металлов, мышьяка, фосфора, серы остаются в основном в растворе.
В осадок полимолибдат увлекает большое количество ионов хлора и вольфрам. Перекристаллизацией полимолибдата в парасоль 3(NH 4 )2 О ∙ 7МоО3 ∙ 4Н2 О эти примеси удаляют. Для этого полисоль растворяют в 3 – 5 % -ном растворе аммиака при 70 – 80°С столько, чтобы плотность стала 1,41 – 1,42. Затем, охлаждая раствор до 15 – 20°С, кристаллизуют парамолибдат аммония:
7 [(NH 4 )2 О ∙ 4МоО3 ] + 10NH4 OH → 4 [3 (NH4 )2 О ∙ 7МоО3 ] + 5Н2 О
В кристаллы выделяется до 60% всего молибдена, бывшего в растворе. Оставшийся маточный раствор без очистки используют для перекристаллизации ряда порций осадков полимолибдата.
Описанный метод переработки дает конечный продукт более высокой чистоты, чем просто парамолибдатный. Содержание примесей в конечном продукте (%): Fe<0,005; S<0,003; Al<0,003; Zn, Ni, Са, Mg, As, P и других элементов <0,001 каждого. Примесь вольфрама осаждается вместе с молибденом. Для процесса применяются эмалированные чугунные выпарные аппараты и кристаллизаторы. Возможно применение и других аппаратов. В маточных растворах, подлежащих очистке, содержится до 10 г/л Мо. Подкислением до рН 3 – 2 из них можно выделить осадки полимолибдатов, которые направляют на очистку. Из маточных растворов, содержащих < 1г/л Мо, последний выделяют ионообменом.
3.6 Другие методы получения соединений молибдена
По одному из вариантов кислотной обработки отвалы, содержащие помимо соединений молибдена до 5% W, обрабатывают 20 – 30%-ной соляной кислотой при нагревании [8, 20]. Молибден в основном переходит в раствор. Кислотой не разлагаются МоО 2 , MoS2 минералы вольфрама. Кислую пульпу нейтрализуют раствором аммиака до рН 2,5 – 3. Молибден осаждают в составе молибдата железа или полимолибдатов. Осадок отфильтровывают. С раствором отделяются Са, Си, часть Fe. Осадок обжигают, чтобы окислить Мо и МоO2 . После обжига его выщелачивают аммиачным раствором. В полученный раствор извлекается до 85% Мо. Соединения вольфрама остаются в остатке от выщелачивания. Аммиачный раствор молибденовых соединений присоединяют к основному раствору от выщелачивания огарков. Общее извлечение молибдена из концентрата достигает 93 – 95%. Потери при обжиге ~ 1,5 %, при выщелачивании (с использованием хвостов) ~2,5%, на прочих операциях до 3%. Переработка отвалов повышает общее извлечение молибдена из концентратов в готовую продукцию.
Из анализа себестоимости парамолибдата с учетом использования хвостов первичного выщелачивания следует, что более 90% себестоимости составляет стоимость сырья.
Для получения молибдена можно использовать также и растворение в азотной кислоте, но этот процесс имеет несколько отличительных черт. Для рентабельности азотнокислотного вскрытия необходимо, чтобы избыток азотной кислоты и продукты ее разложения могли быть регенерированы и эффективно использованы. В противном случае метод нерентабелен, так как вместо прямого использования кислорода воздуха, как это происходит при окислительном обжиге в печах, окисление производится дорогой азотной кислотой, предварительно полученной тоже из азота и кислорода воздуха. Нельзя допускать и выброса в атмосферу окислов азота, получающихся при разложении кислоты в ходе реакции. Схема азотнокислотного метода показана на рис. 4. Основная реакция взаимодействия M0S 2 с HNO3 :
MoS 2 + 6HNO3 = Н2 МоО4 + 2H2 SO4 + 6N0
Реальный расход кислоты на окисление чистого MoS 2 близок к теоретическому по этой реакции. Но при разложении концентрата кислота расходуется еще и на разложение примесных минералов, испарение, термическое разложение. Поэтому общий расход кислоты значительно выше расчетного (расчетный расход 3,16 т, в пересчете на 60%-ную кислоту, на окисление молибденита в 1 т концентрата, содержащего 48 – 50% Мо).
Некоторые возможные реакции взаимодействия примесных минералов с азотной кислотой:……………………………………………………………………………………………….
CaCO 3 + 2HNO3 = Ca(NO3 )2 + H2 O + CO2
Са 3 (РО4 )2 + 6HNO3 = 3Са (NO3 )2 + 2Н3 РО4
As 2 S3 + 12HNO3 = 2H3 AsO4 + 3H2 SO4 + 8NO + 4NO.
Молибденовая кислота первоначально оказывается полностью в растворе, а затем в значительной степени выпадает в осадок. В растворе молибден находится в основном в составе комплексных анионов [MoO(MoO 4 ) (SO4 )2 ]2- . В газовой фазе, помимо NО, находятся другие окислы азота и пары кислот. К концу разложения молибденита азотной кислотой в растворе содержится 15—25 г/л Мо. Растворимость Н2 МоО4 в воде ~2 г/л при 20°.
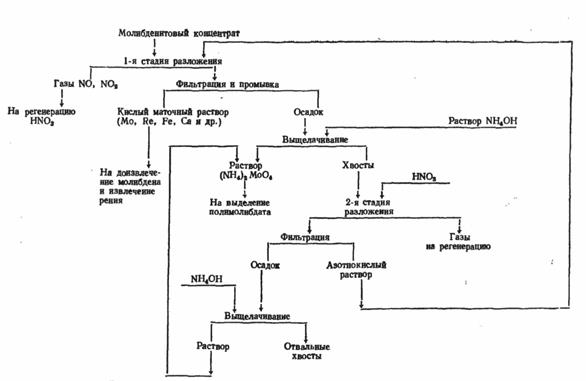
Рис. 4. Получение молибдена с использованием азотной кислоты
Из азотнокислых растворов молибден можно выделить в зависимости от избытка кислоты, содержания молибдена и примесей экстракцией или осаждением ферромолибдата.
Окисление MoS 2 гипохлоритом в растворах. Молибденит окисляется гипохлоритом кальция по реакции.
MoS 2 + 9СlО— + 6ОН— = МоО![]() + 2SO
+ 2SO![]() + 3Н2 О + 9Сl—
+ 3Н2 О + 9Сl—
Реакция протекает со значительным выделением свободной энергии: ΔZ 298 = — 343, 6 ккал. Преимущества процесса гипохлоритного окисления – это избирательность окисления молибдена и полнота извлечения его в раствор при низкой температуре. Практический расход в 1,5 – 2 раза выше теоретического. В заводской практике способ не применяется.
Oкисление молибденита кислородом в автоклавах [20].
Окисление может производиться в растворах КОН, NH 4 ОН, NaOH, Na2 CO3 . Принципиальная реакция окисления кислородом проходит по уравнению
2MoS 2 + 9O2 +2OH— = 2МоО![]() + 4SO
+ 4SO![]() + 6Н2 О
+ 6Н2 О
Окисление проходит через промежуточную стадию образования тиосульфата и гидроксокатиона молибдена (VI) [МоО 2 Н ]+ . На степень перехода молибдена в раствор влияют давление, температура, концентрация щелочи. Скорость реакции зависит от концентрации ионов ОН— , поэтому она возрастает в ряду растворов аммиака→соды→щелочи. Ионы меди действуют на окисление каталитически: при концентрациимеди 100 мг/л скорость его в два раза выше, чем в отсутствие меди. Добавка меди позволяет снизить давление, температуру и время обработки.
При автоклавном окислении молибдено – медных промпродуктов (5,8 – 6,3% Мо и 6 – 9% Сu) рекомендуется проводить процесс в растворе соды или аммиака при 200°С, а в растворе едкого натра при 130 – 140°С и давлении кислорода соответственно 9 – 10 и 1 – 2 атмосфер. Работая с едким натром, кислород можно заменить сжатым воздухом. В растворах аммиака вместе с молибденом растворяется много меди, что нежелательно. При работе с содой образуется гидрокарбонат:
Na 2 CO3 + СО2 + Н2 О → 2NaHCO3
Избыток соды поэтому должен быть выше, чем щелочи. В качестве аппаратуры можно использовать автоклавы с механическим перемешиванием из нержавеющей стали специальных сортов . Автоклавное выщелачивание связано с трудностями подбора аппаратуры из-за образования больших количеств CaSO 4 и в отношении техники безопасности.
Хлорирование молибденовых огарков, окисленных промежуточных продуктов и чистых соединений молибдена. Хлорирование – перспективный метод переработки низкосортных огарков, окисленных концентратов и промежуточных продуктов обогащения, окисленных руд, содержащих молибден. Хлорирование может также применяться для получения чистых хлоридов с целью выработки из них металлического молибдена методами диссоциации или металлотермии. Хлорировать можно хлором, летучими хлоридами (например, S 2 Cl2 , ССl4 ), твердыми хлоридами. Хлорирование низкосортных концентратов, содержащих сульфиды, целесообразно применять к обожженным «огаркам» таких концентратов. Ректификацией продуктов хлорирования могут быть получены соединения высокой чистоты.
Ионный обмен в технологии молибдена может применяться для:
- а) селективного извлечения Мо из основных растворов как относительно богатых им, так и бедных;
- б) извлечения очень малых количеств Мо из сбросных растворов и промывных вод;
в) извлечения Мо из рудничных молибденсодержащих вод,
г) разделения Мо и Re в кислых растворах;
- д) очистки молибденовых растворов от примесей тяжелых, щелочноземельных и щелочных металлов.
До настоящего времени наиболее широко распространено ионообменное извлечение молибдена из бедных маточных и сбросных растворов и промывных вод [20,11]. Остальные возможности применения ионитов в технологии молибдена весьма перспективны. Ионообменное извлечение из растворов после кислотной обработки бедных окисленных руд и концентратов – актуальная задача, так как эти руды и методы обработки приобретают большое промышленное значение.
Молибден сорбируется и катионитами, и анионитами. Большое практическое значение имеет сорбция молибдена на анионитах. Ион МоО 2 2+ существует лишь в сильнокислых растворах, в которых одновременно могут сорбироваться и многие другие металлические ионы и где велика концентрация конкурирующего иона Н+ . В этих условиях может вестись ионитная очистка молибденовых растворов от примесей тяжелых цветных, щелочных и других металлов. В сильнощелочной среде (рН = 8) молибден находится в форме неполимеризованного аниона МоО4 2- . Полная обменная емкость анионитов по молибдену в сильнощелочной среде ниже, чем при более низком рН, при котором молибден в растворе находится в виде полимеризованных, большого объема, ионов пара-, мета- и других полимолибдатов. Но большой объем этих ионов вносит пространственные затруднения в процесс сорбции: требуется, чтобы активные группы ионита были возможно менее экранированы другими элементами его структуры.
В слабокислой среде для сорбции молибдена из растворов эффективен сульфоуголь [20].
Захват им молибдена носит сорбционный характер, без обмена ионами. Активированный уголь также хорошо сорбирует молибден из бедных кислых растворов. Так, уголь марки КАУ (8, с. 415)для раствора, содержащего 0,144 г/л Мо и 0,1 моль/л H 2 SO4 , показал динамическую обменную емкость (емкость до проскока – ДОЕ) 14 мг Мо на 1 г сорбента и полную обменную емкость (ПОЕ) 145 мг/г.
В технологии извлечения молибдена из растворов и их очистки используются и испытываются аниониты с разными основностью, структурой, пористостью. В слабокислой среде (рН 2 – 5) эффективно применение как сильноосновных, так и слабоосновных смол. В нейтральных и слабощелочных растворах обладают достаточной емкостью лишь сильноосновные смолы.
При 1,6 г/л Мо и рН раствора равном 3, сильноосновная смола АВ-16 показала ПОЕ-394 мг/г и коэффициент распределения по молибдену Kр=20615, а слабоосновной анионит АН-1 показал ПОЕ 233 мг/г и Kр= -3598. Но так как сильноосновные смолы прочнее удерживают молибден и для десорбции (элюирования или вымывания) из них требуются растворы более сильных щелочей (NaOH, КОН), а для вымывания со среднеосновной и тем более со слабоосновной смолы вполне достаточны 5 – 10%-ные растворы аммиака, то в практических условиях чаще находят применение средне- и слабоосновные аниониты. Применение раствора аммиака как элюента не вносит загрязнений щелочами и дает возможность получать более технологичные аммиачные соединения молибдена – поли — и парамолибдаты.
Для очистки аммиачно-молибденовых растворов от тяжелых металлов в полупромышленном масштабе использовали амфолиты. Амфолит – амфотерный сложный анионит, синтезированный из более простых анионитов с введением в них дополнительных органических групп. В результате получаются конденсированные продукты с крупной внутриструктурной и межструктурной пористостью и не полностью насыщенными связями. Разным соотношением реагентов при синтезе могут быть получены различные модификации амфолита, отличающиеся соотношением кислотных и основных групп.
Степень извлечения молибдена из рудного сырья зависит не только от полноты химического вскрытия минерала и перевода молибдена в раствор, но и от полноты последующего извлечения его из растворов. В изложенных выше технологических схемах молибден извлекался из первичных растворов осаждением пара — и полимолибдата аммония, молибдата кальция, ферримолибдатов, а из бедных растворов и промывных вод – ионным обменом.
Сейчас наиболее экономичны и перспективны методы извлечения молибдена из растворов экстракцией и ионным обменом. Их достоинства:
1) полнота выделения полезного элемента из раствора;
2) селективность выделения элементов из комплексных растворов:
3) полнота отделения примесей;
4) простота аппаратурного оформления;
5) высокая производительность (причем производительность экстракции выше ионного обмена).
Извлечение молибдена из растворов и пульп экстракцией до настоящего времени находится на стадии укрупненных лабораторных и полупромышленных испытаний, показывающих в ряде случаев весьма перспективные результаты для промышленного использования [11, 13]. Этому способствует то, что молибден может находиться в растворах в разнообразных формах (катионы, анионы, полианионы, комплексные анионы).
Молибденсодержащие ионы способны сольватироваться и давать комплексы со многими органическими соединениями. Поэтому возможна экстракция молибдена экстрагентами различных типов, анионо- и катионообменными, нейтральными. К первому типу экстрагентов относятся амины и четвертичные аммониевые основания, ко второму – алкилфосфорные кислоты, к третьему – спирты, кетоны, эфиры, в том числе трибутилфосфат.
Как показала практика [20], из анионообменных экстрагентов молибден достаточно успешно экстрагируется триоктиламином (сокращенно ТОА) (C 8 H17 )3 N и аммониевым основанием – диалкилметилбензиламмонийхлоридом [СН3 —NR2 —СН2 С6 Н5 ]Cl (так называемый дамбас ).
Молибден экстрагируется катионообменным экстрагентом Д2ЭГФК – ди-2-этилгексилфосфорной кислотой (С8 Н17 )2HPO4 , экстрагентом нейтрального типа — трибутилфосфатом (C4 H9 )3 PO4 (ТБФ), метилизобутилкетоном C5 H12 CO (МИБК), циклогексаноном (СН2 )5 СО и метилфенилкетоном (ацетофеноном) СН3 СОС6 Н5 .
Указанные соединения отвечают требованиям, предъявляемым к экстрагентам: мало растворимы в воде, кипят при высоких температурах, большинство из них легче воды. Для понижения их вязкости, увеличения разности в плотности с водой и повышения температур воспламенения применяются они в виде растворов в керосине или других растворителях. Повышение температуры воспламенения особенно важно для применения циклогексанона и ацетофенона.
В табл. 2 дан предположительный состав экстрагируемых разными экстрагентами соединений
Таблица 2. Состав экстрагируемых веществ
| Кислотность исходного раствора | Экстрагент | Мольное отношение | Формула | |||
| pH | HCl, и. | [Mo] | экстрагент |
Cl свя занный |
||
| 3,0 | — | ТОА | 1 | 2,3 | — | (R 3 NH)2 MoO4 |
| 1,0 | — | » | 3 | 0,97 | — | (R 3 NH)2 [Mo6 O14 (OH)10 ] |
| — | 10 | » | 1 | 1,0 | 3,1 | (R 3 NH)[MoO2 Cl3 ] |
| 1,0 | — | Д2ЭГФК | 1 | 4,10 | — | MoO 2 (R2 PO4 )2 ∙ 2HR3PO4 |
| — | 4 | ТБФ | 1 | 2,05 | 2,0 | MoO 2 Cl2 ∙ 2ТБФ |
| — | 6 | » | 1 | 2,0 | 2,9 | [H 3 0 (H20) ∙ ТБФ [MoO2 Cl3 ∙ (H2 0)] |
| — | 6 | МИБК | 1 | 3,0 | 3,0 | [H 3 0 (H20) ∙ 3МИБК [MoO2 Cl3 ∙ (H2 0)] |
С помощью экстракции можно решать ряд задач технологии молибдена:
- а) повышение извлечения из бедных и сбросных растворов;
- б) извлечение из растворов, получаемых при выщелачивании бедных руд и некондиционных концентратов;
- в) отделение молибдена от вольфрама, что особенно важно в тех случаях, когда молибден находится в малом количестве по сравнению с близким ему по свойствам вольфрама.
В результате выполнения данной работы можно сделать следующие выводы, которые позволят повысить выход молибдена из отработанных молибденовых руд и отходов производства, а также позволят использовать отходы молибденовой промышленности в народном хозяйстве:
Для получения особо чистого МоО 3 необходимо использовать метод возгонки при высоких температурах, что позволит получить особо чистый МоО3 , необходимый в металлургии и других отраслях промышленности
Для повышения выхода молибдена из отходов молибденовой промышленности можно использовать получение молибдена при помощи ионного обмена или экстракции органическими растворителями. Учитывая большой объем отходов можно предложить использовать ионный обмен, поскольку этот метод позволяет повторно использовать катиониты и аниониты и не требует сложной аппаратуры для улавливания паров органических растворителей.
Производительность метода экстракции для получения молибдена является большей, но требует строительства установок по поглощению паров органических растворителей и герметизации установок. Метод ионного обмена является технологически более простым, что будет предпочтительнее.
Отходы производства после выделения молибдена можно использовать в виде комплексных молибден содержащих удобрений в сельском хозяйстве, что позволит повысить урожайность зерновых.
1. Ахметов Н.С. «Общая и неорганическая химия» М.: Высшая школа, 2001.
2. Берт Р.О. «Технология гравитационного обогащения» М.: Недра, 1990.
3. Бусев А. И. Аналитическая химия молибдена. М.: Издательство АН СССР, 1962, — 300с.
4. Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технологическим специальностям – 2-е изд., перераб. и доп. — М.: Дрофа, 2002. — 384 с.
5. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
6. Гороновский И. Т., Назаренко Ю. П., Некряч Е. Ф. Краткий справочник по химии К.: Издательство АН СССР, 1962, 658 с.
7. Жарский И. М., Новиков И. Г. Физические методы исследования в неорганической химии. М.: Высшая школа, 1988, 271 с.
8. Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов М.:Металлургия, 1991.
9. Карякин Ю.В., Ангелов И.И. «Чистые химические вещества» М. 1974.
10. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
11. Меркин Э.Н. «Экстракция металлов некоторыми органическими катионообменными реагентами» М., 1968.
12. Некрасов Б. В. «Основы общей химии» т.1 М.: Химия 1973.
13. Ритчи Г. М., Эшбрук А. В. Экстракция: принципы и применение в металлургии.Пер. с англ. М.: Металлургия, 1983.
14. Рысс М.А. «Производство ферросплавов» М.: Металлургия, 1985.
15. Скуг Д., Уэст Д. Основы аналитической химии. В 2 т. Пер с англ. М.: Мир, 1979, — 438 с.
16. Справочник химика. В 3-х т. М.: Химия, 1966, 1070 с.
17. Степин Б.Д., Горштейн И.Г., Блюм Г.З., Курдюмов Г.М., Оглоблина И.П. «Методы получения особо чистых неорганических веществ» Л.: Химия, 1969.
18. Фигуровский Н.А. «История химии» М.: Просвещение 1979.
19. Физическая химия. Практическое и теоретическое руководство. Под ред. Б. П. Никольского, Л.: Химия, 1987. – 875 с.
20. Химия и технология редких и рассеянных элементов. Под ред. Большакова К. А. Ч. ІІІ. М.: Высшая школа, 1976, 320 с.
21. Химия: Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. – М.: Химия, 1989.– 648 с.
22. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
23. Ягодин Г.А., Синегрибова О.А., Чекмарев А.М. «Технология редких металлов в атомной технике» М.: Атомиздат, 1974.
