Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений <https://ru.wikipedia.org/wiki/%D0%A3%D0%B4%D0%BE%D0%B1%D1%80%D0%B5%D0%BD%D0%B8%D1%8F> (нитрат и сульфат аммония, мочевина <https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D1%87%D0%B5%D0%B2%D0%B8%D0%BD%D0%B0>
- , взрывчатых веществ и полимеров <https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%BB%D0%B8%D0%BC%D0%B5%D1%80>, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя <https://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D1%82%D0%B5%D0%BB%D0%B8>.
В холодильной технике <https://ru.wikipedia.org/wiki/%D0%9A%D0%BB%D0%B8%D0%BC%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D0%B8_%D1%85%D0%BE%D0%BB%D0%BE%D0%B4%D0%B8%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5_%D0%BE%D0%B1%D0%BE%D1%80%D1%83%D0%B4%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5> используется в качестве холодильного агента <https://ru.wikipedia.org/wiki/%D0%A5%D0%BE%D0%BB%D0%BE%D0%B4%D0%B8%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%B0%D0%B3%D0%B5%D0%BD%D1%82> (R717)
В медицине <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%B4%D0%B8%D1%86%D0%B8%D0%BD%D0%B0> 10 % раствор аммиака, чаще называемый нашатырным спиртом <https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D1%88%D0%B0%D1%82%D1%8B%D1%80%D0%BD%D1%8B%D0%B9_%D1%81%D0%BF%D0%B8%D1%80%D1%82>, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с).
Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Технология производства аммиака (2)
... в которых содержатся свободные электроны, являются сильнейшими восстановителями. Получение аммиака В лаборатории В промышленности Для получения аммиака в лаборатории используют действие сильных щелочей на ... технической сущности и достигаемому результату к описываемому изобретению является способ получения аммиака из углеводородного сырья, водяных паров, воздуха, включающий компримирование и очистку ...
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода — продукт (NH3*H2O), представляющий собой газообразный аммиак NН3, растворенный в воде.
Физиологическое действие.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE_%D0%B4%D0%BE%D0%BF%D1%83%D1%81%D1%82%D0%B8%D0%BC%D0%B0%D1%8F_%D0%BA%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D1%8F> в воздухе рабочей зоны производственного помещения (ПДКр.з. <https://ru.wikipedia.org/wiki/%D0%9F%D0%94%D0%9A%D1%80.%D0%B7.>
- составляет 20 мг/м³[6] <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA>. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с. <https://ru.wikipedia.org/wiki/%D0%9F%D0%94%D0%9A%D1%81.%D1%81.>
- не должна превышать 0,04 мг/м³[7] <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA>. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7-14 г/м³ — эритематозный <https://ru.wikipedia.org/wiki/%D0%AD%D1%80%D0%B8%D1%82%D0%B5%D0%BC%D0%B0>, 21 г/м³ и более — буллёзный дерматит <https://ru.wikipedia.org/wiki/%D0%94%D0%B5%D1%80%D0%BC%D0%B0%D1%82%D0%B8%D1%82>. Токсический отёк лёгких <https://ru.wikipedia.org/wiki/%D0%9E%D1%82%D1%91%D0%BA_%D0%BB%D1%91%D0%B3%D0%BA%D0%B8%D1%85> развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.
Совершенствование технологии использования продувочных газов ...
... совершенствования. Целью данной работы является увеличении доли переработки сырья и разработка технологии получения новых продуктов процесса синтеза аммиака. Поставленная цель достигается ... и металлоемкость дают предпосылки для постоянного улучшения технологии производства синтетического аммиака. Основными направлениями модернизации являются сокращения количества отходов, образующихся в ...
2. Обзор литературы
[Электронный ресурс]//URL: https://inzhpro.ru/referat/ammiaka/
катализатор синтез аммиак регенерация
2.1 Физические и химические свойства аммиака
Физические свойства:
- Аммиа́к — NH3, нитрид <https://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D1%82%D1%80%D0%B8%D0%B4>
- водорода, при нормальных условиях <https://ru.wikipedia.org/wiki/%D0%9D%D0%BE%D1%80%D0%BC%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5_%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F>
- бесцветный газ с резким характерным запахом (запах нашатырного спирта <https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D1%88%D0%B0%D1%82%D1%8B%D1%80%D0%BD%D1%8B%D0%B9_%D1%81%D0%BF%D0%B8%D1%80%D1%82>).
Плотность аммиака почти вдвое меньше, чем у воздуха <https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B7%D0%B4%D1%83%D1%85>, ПДКр.з. <https://ru.wikipedia.org/wiki/%D0%9F%D0%94%D0%9A%D1%80.%D0%B7.> 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007[1] <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA>. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике <https://ru.wikipedia.org/wiki/%D0%9A%D0%BB%D0%B8%D0%BC%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D0%B8_%D1%85%D0%BE%D0%BB%D0%BE%D0%B4%D0%B8%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5_%D0%BE%D0%B1%D0%BE%D1%80%D1%83%D0%B4%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5> носит название R717, где R — Refrigerant (хладагент <https://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%B0%D0%B4%D0%B0%D0%B3%D0%B5%D0%BD%D1%82>
- , 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота <https://ru.wikipedia.org/wiki/%D0%90%D0%B7%D0%BE%D1%82> участвуют в образовании полярных ковалентных связей <https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C> с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов <https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BF%D0%B0%D1%80%D0%B0> является неподелённой, она может образоватьковалентную связь по донорно-акцепторному механизму <https://ru.wikipedia.org/wiki/%D0%94%D0%BE%D0%BD%D0%BE%D1%80%D0%BD%D0%BE-%D0%B0%D0%BA%D1%86%D0%B5%D0%BF%D1%82%D0%BE%D1%80%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C> с ионом водорода, образуя ион аммония <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%BE%D0%BD%D0%B8%D0%B9> NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями <https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C>. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Курсовая №3844 Синтез аммиака
... углерода и водяною пара получил водород и двуокись углерода. Требуемый для синтеза аммиака азот вводили в синтез-газ в виде воздушного газа. Очистка газа проводилась по об-щепринятому ... Несмотря на многочисленные трудности возникшие при освоении метода синтеза аммиака стало ясно что он гораздо экономичнее других методов связывания азота. Водород вначале получали из водяного газа удаляя ...
Химические свойства:
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»).
Так, он присоединяет протон, образуя ион аммония <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%BE%D0%BD%D0%B8%D0%B9>:
![]()
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
![]() Ko=1,8·10−5
Ko=1,8·10−5
- Взаимодействуя с кислотами даёт соответствующие соли аммония
![]()
— Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
![]()
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%B4%D1%8B_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2> являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны.Амиды <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%B4%D1%8B_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2> являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
![]()
и в спиртах:
![]()
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
![]()
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
— При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
![]()
![]()
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
![]()
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин <https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%B0%D0%B7%D0%B8%D0%BD>:
![]()
- Галогены <https://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B>
- (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот <https://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D1%82%D1%80%D0%B8%D0%B4_%D1%82%D1%80%D0%B8%D0%B8%D0%BE%D0%B4%D0%B0>).
- С галогеноалканами <https://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D0%BE%D0%B0%D0%BB%D0%BA%D0%B0%D0%BD%D1%8B>
- аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
![]() (гидрохлорид метиламмония)
(гидрохлорид метиламмония)
- С карбоновыми кислотами <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B1%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D0%B5_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B>, их ангидридами <https://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%B8%D0%B4%D1%80%D0%B8%D0%B4%D1%8B_%D0%BA%D0%B0%D1%80%D0%B1%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D1%85_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82>, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами <https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D0%B4%D0%B5%D0%B3%D0%B8%D0%B4%D1%8B>
- и кетонами <https://ru.wikipedia.org/wiki/%D0%9A%D0%B5%D1%82%D0%BE%D0%BD%D1%8B>
- основания Шиффа <https://ru.wikipedia.org/wiki/%D0%9E%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5_%D0%A8%D0%B8%D1%84%D1%84%D0%B0>, которые возможно восстановить до соответствующих аминов <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%BD%D1%8B>
- (восстановительное аминирование <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%BD%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5>).
- При 1000 °C аммиак реагирует с углём <https://ru.wikipedia.org/wiki/%D0%94%D1%80%D0%B5%D0%B2%D0%B5%D1%81%D0%BD%D1%8B%D0%B9_%D1%83%D0%B3%D0%BE%D0%BB%D1%8C>, образуя синильную кислоту <https://ru.wikipedia.org/wiki/%D0%A1%D0%B8%D0%BD%D0%B8%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>
- HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BD>, образуя ту же самую синильную кислоту:
![]()
![]()
2 Методы синтеза аммиака
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота
![]() + 91,84 кДж <https://ru.wikipedia.org/wiki/%D0%94%D0%B6%D0%BE%D1%83%D0%BB%D1%8C>
+ 91,84 кДж <https://ru.wikipedia.org/wiki/%D0%94%D0%B6%D0%BE%D1%83%D0%BB%D1%8C>
- Это так называемый процесс Габера <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%86%D0%B5%D1%81%D1%81_%D0%93%D0%B0%D0%B1%D0%B5%D1%80%D0%B0>
- (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF_%D0%9B%D0%B5-%D0%A8%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%B5>, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Таблица 1 — Выход аммиака (в объёмных процентах <https://ru.wikipedia.org/wiki/%D0%9E%D0%B1%D1%8A%D1%91%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D0%BD%D1%82>) в процессе Габера при различных температурах и давлении имеет следующие значения:
|
100 ат <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_(%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%B8%D0%B7%D0%BC%D0%B5%D1%80%D0%B5%D0%BD%D0%B8%D1%8F)>300 ат <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_(%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%B8%D0%B7%D0%BC%D0%B5%D1%80%D0%B5%D0%BD%D0%B8%D1%8F)>1000 ат <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_(%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%B8%D0%B7%D0%BC%D0%B5%D1%80%D0%B5%D0%BD%D0%B8%D1%8F)>1500 ат <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_(%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%B8%D0%B7%D0%BC%D0%B5%D1%80%D0%B5%D0%BD%D0%B8%D1%8F)>2000 ат <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_(%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%B8%D0%B7%D0%BC%D0%B5%D1%80%D0%B5%D0%BD%D0%B8%D1%8F)>3500 ат <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_(%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%B8%D0%B7%D0%BC%D0%B5%D1%80%D0%B5%D0%BD%D0%B8%D1%8F)> |
||||||
|
400 °C |
25,12 |
47,00 |
79,82 |
88,54 |
93,07 |
97,73 |
|
450 °C |
16,43 |
35,82 |
84,07 |
89,83 |
97,18 |
|
|
500 °C |
10,61 |
26,44 |
57,47 |
|||
|
550 °C |
6,82 |
19,13 |
41,16 |
|||
Применение катализатора (пористое железо <https://ru.wikipedia.org/wiki/%D0%96%D0%B5%D0%BB%D0%B5%D0%B7%D0%BE> с примесями Al2O3 <https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%B0%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D1%8F> и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%82%D0%B0%D0%BB%D0%B8%D0%B7%D0%B0%D1%82%D0%BE%D1%80>. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
![]()
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.
![]()
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий <https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D1%82%D1%80%D0%B8%D0%B9> и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом <https://ru.wikipedia.org/wiki/%D0%92%D0%B0%D0%BA%D1%83%D1%83%D0%BC>. Система должна выдерживать высокое давление <https://ru.wikipedia.org/wiki/%D0%94%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5> (при комнатной температуре <https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BC%D0%BD%D0%B0%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0> давление насыщенных паров <https://ru.wikipedia.org/wiki/%D0%9F%D0%B0%D1%80> аммиака около 10 атмосфер).
В промышленности аммиак осушают в абсорбционных колоннах <https://ru.wikipedia.org/wiki/%D0%90%D0%B1%D1%81%D0%BE%D1%80%D0%B1%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BD%D0%B0>.
3. Физико-химические основы синтеза аммиака
Чтобы процесс синтеза аммиака был максимально эффективным и экономичным, необходимо тщательно подобрать условия его проведения. Важнейшими показателями, которые учитываются при этом, являются: 1) выход, 2) скорость и 3) энергоемкость процесса. Обратимся к 8-й стадии процесса, т. е. непосредственно к синтезу аммиака, и исследуем влияние давления, температуры и катализаторов на эффективность этого процесса.
Влияние давления. Как сказано выше, получение аммиака может быть представлено следующим уравнением:
![]()
Константа равновесия этой реакции определяется выражением
![]()
Если выразить входящие в это выражение парциальные давления газов через их мольные долии полное давление P в системе, получится такое выражение:
![]()
Это выражение можно упростить, придав ему вид
![]()
Как видно повышение давления благоприятствует протеканию прямой реакции, т. е. повышению выхода аммиака.
Влияние температуры и катализаторов. Синтез аммиака представляет собой экзотермический процесс (см. табл. 7.1,а).
Следовательно, повышение температуры должно благоприятствовать протеканию обратной реакции (см. предыдущий раздел).
Это означает, что понижение температуры должно повышать выход реакции синтеза аммиака (рис. 7.3).
К сожалению, однако, при низких температурах очень замедляется скорость этой реакции, а следовательно, и скорость получения аммиака. Другими словами, при низких температурах процесс должен иметь низкую производительность, а значит, низкую экономичность. Для достижения оптимальной производительности необходимо выбрать компромиссный вариант между двумя крайними возможностями:
высоким выходом и низкой скоростью реакции (при низких температурах)
низким выходом и высокой скоростью реакции (при высоких температурах).
Разумеется, скорость реакции повышается благодаря использованию катализатора. Таким образом, катализатор позволяет проводить процесс эффективнее при низких температурах. Эффективность железного катализатора, используемого для синтеза аммиака, повышается, если к нему добавляют так называемые промоторы. Для промотирования эффективности железного катализатора используются оксиды калия и алюминия.
Обстоятельное рассмотрение экономичности процесса синтеза аммиака показывает, что для достижения оптимального выхода и производительности следует поддерживать температуру приблизительно равной 400°С, а давление равным 250 атм.
Обычный аммиачный завод производит ежесуточно около 1000 т аммиака. При этом потребность в водяном паре составляет 6000 т/сут, чтобы приводить в действие паровые турбины, от которых работают компрессоры. К счастью, химические процессы, проводимые при получеши аммиака, являются экзотермическими. Вся энергия, которая высвобождается на ранних стадиях процесса производства аммиака, используется для получения сильно сжатого пара. Энергия, которая высвобождается непосредственно при самом синтезе аммиака (8-я стадия), используется для поддержания температуры каталитического конвертера на уровне 400°С. Общая тепловая эффективность аммиачного завода составляет около 60%. Другими словами, приблизительно 40% затрачиваемой энергии, которая обеспечивается природным газом, составляют тепловые потери.
2 Катализатор
Настоящее изобретение относится к технологии синтеза аммиака, в частности к катализатору и способу получения аммиака.
Известен катализатор для получения аммиака, содержащий рутений в качестве активного каталитического материала, нанесенный на углерод, например углерод, содержащий графит. Дополнительно вышеупомянутый углеродный носитель может содержать промотор, например щелочной металл (смотри патент США №4 600 571, C 01 C 1/04, 15.07.1986).
Получение аммиака осуществляют контактированием синтез-газа с вышеупомянутым катализатором в условиях образования аммиака. Обычно синтез аммиака проводят под давлением в пределах 100-400 бар и при температуре между 300°С и 600°С.
Серьезный недостаток этого известного технического решения заключается в том, что используемый носитель на основе углерода является чувствительным к гидрогенизации в промышленных условиях. Углеродный носитель медленно превращается в метан, что приводит к постепенной потере носителя и, в конечном счете, к затруднениям в работе.
Объектом настоящего изобретения является предоставление рутениевого катализатора, имеющего носитель, который стабилен в промышленных условиях синтеза аммиака.
Решение этой задачи достигается предложенным катализатором для получения аммиака, содержащим рутений в качестве активного каталитического материала, нанесенный на нитрид бора и/или нитрид кремния.или Si3N4 могут быть получены либо из коммерческих источников, либо приготовлены согласно способам, известным в данной области техники. Площадь поверхности нитридного носителя предпочтительно составляет свыше 25 м2/г. Альтернативно нитридный носитель может быть получен из Si и В предшественника, который будет трансформироваться в нитрид во время обработки аммиаком.
И BN, и Si3N4 могут быть сформированы в требуемые носители способами, известными на данном уровне техники.
Рутений наносят на носитель обычными способами, например пропиткой подходящим соединением, содержащим рутений, таким как хлорид или ацетат.
Рутениевый катализатор, нанесенный на BN или Si3N4, может быть также промотирован.
Перед промотированием катализатор может быть восстановлен обработкой восстанавливающим газом, таким как водород или синтез-газ.
Промотирование может проводиться пропиткой солями промоторов. Промоторы выбирают из известных промоторов катализатора синтеза аммиака, например щелочных или щелочно-земельных металлов или редкоземельных металлов.
Промоторы могут вводиться последовательно или вместе.
Еще одним объектом настоящего изобретения является способ получения аммиака из синтез-газа для производства аммиака посредством контактирования синтез-газа с вышеупомянутым описанным катализатором в условиях образования аммиака.
Изобретение иллюстрируется следующими примерами.
Пример 1
Получение катализаторов
Носитель из нитрида бора (гексагональный, площадь поверхности 85 м2/г, размер кристалла, определенный порошковой дифракцией рентгеновских лучей, составляет 7,5 нм), пропитан нитрозонитратом рутения с получением концентрации рутения 5 мас.%. Пропитанный образец высушивают при 80°С и восстанавливают в потоке водорода при 450°С. Этот образец обозначают 5RuBN.
Другой образец получают также, но с содержанием рутения 7 мас.%. Этот образец обозначают 7RuBN. Плотность катализатора равняется приблизительно 1,5 г/мл.
Пример 2
Промотирование катализаторов цезием
RuBN и 7RuBN пропитывают водными растворами нитрата цезия с получением концентрации цезия 3 мас.%. Эти образцы обозначают 3Cs5RuBN и 3Cs7RuBN соответственно.
Пример 3
Промотирование катализаторов барием
RuBN и 7RuBN пропитывают водными растворами нитрата бария с получением концентрации бария 3 мас.%. Эти образцы обозначают 3Ba5RuBN и 3Ba7RuBN соответственно.
Пример 4
Испытание катализаторов
Катализаторы проверяют в изотермическом реакторе с поршневым потоком при рабочем режиме 100 бар и 400°С. Входящий газ содержит 4,5% аммиака в смеси 3:1 водорода/азота. Поток регулируют для получения 12% аммиака на выходе. При этих условиях катализаторы производят аммиак при различных скоростях, выраженных в мл аммиака, полученных на грамм катализатора в час:
Катализатор мл НН3/(г·ч)
5RuBN 140
RuBN 190
Cs5RuBN 1150
Cs7RuBN 1320
Ba5RuBN 4600
Пример 5
Термостабильность катализаторов
Для определения стабильности катализаторов 3Ba5RuBN и 3Ba7RuBN нагревают в реакторе при 550°С в течение 1000 ч. При этих условиях концентрация аммиака на выходе составляет приблизительно 7,0%. После этой обработки катализатор вновь тестируют:
Катализатор мл NН3/(г·ч)
Ba5RuBN 4580
Ba7RuBN 4960
Пример 6
Пассивация и регенерация
Определяют, может ли катализатор регенерироваться после пассивации. Катализатор из примера 5 (3Ba5RuBN) обрабатывают 1000 частями на миллион кислорода в азоте в течение 10 часов и затем подвергают воздействию окружающей среды. Затем его снова загружают в реактор и проверяют в идентичных условиях:
Катализатор мл NН3/(г·ч)
Ba5RuBN 4610
- Катализатор для получения аммиака, содержащий рутений в качестве активного каталитического материала, нанесенный на носитель, отличающийся тем, что в качестве носителя содержит нитрид бора и/или нитрид кремния.
- Катализатор по п.1, отличающийся тем, что он промотирован одним или более металлами, выбранными из щелочных или щелочно-земельных металлов или редкоземельных металлов.
— Способ получения аммиака из синтез-газа для производства аммиака посредством контактирования синтез-газа с катализатором, содержащим рутений в качестве активного каталитического материала, нанесенный на носитель, в условиях образования аммиака, отличающийся тем, что в качестве катализатора используют катализатор, содержащий рутений в качестве активного каталитического материала, нанесенный на носитель из нитрида бора и/или нитрида кремния.
- Способ по п.3, отличающийся тем, что используют катализатор, промотированный одним или более металлами, выбранными из щелочных или щелочно-земельных металлов или редкоземельных металлов.
3.3 Технологическая схема производства аммиака
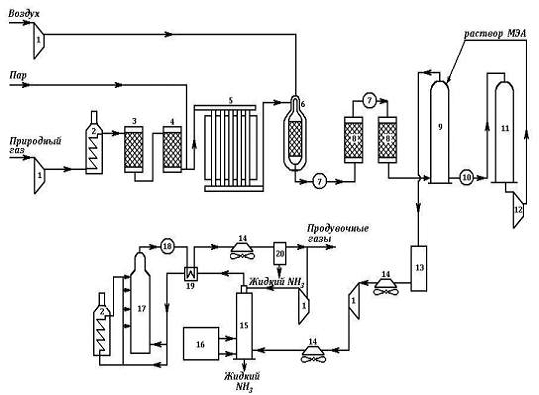
Рисунок 1 — Технологические аппараты и оборудование: 1-компрессоры; 2-подогреватели; 3-реактор гидрирования сероорганических соединений; 4-адсорбер H2S; 5-трубчатая печь (первичный риформинг); 6-шахтный конвертор (вторичный риформинг); 7-паровые котлы; 8-конверторы СО; 9-абсорбер СО2; 10-кипятильник; 11 -регенератор раствора моноэтаноламина; 12-насос; 13-аппарат для гидрирования остаточных СО и СО2; 14-воздушные холодильники; 15-конденсационная колонна; 16-испаритель жидкого NH3 (для охлаждения газа и выделения NH3); 17-колонна синтеза NН3; 18-водоподогреватель; 19-теплообменник; 20-сепаратор
Используемая литература
[Электронный ресурс]//URL: https://inzhpro.ru/referat/ammiaka/
1. Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
2. Карапетьянц М. Х. <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B0%D0%BF%D0%B5%D1%82%D1%8C%D1%8F%D0%BD%D1%86,_%D0%9C%D0%B8%D1%85%D0%B0%D0%B8%D0%BB_%D0%A5%D1%80%D0%B8%D1%81%D1%82%D0%BE%D1%84%D0%BE%D1%80%D0%BE%D0%B2%D0%B8%D1%87>, Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
- Акимова Л. Д. Изучающим основы холодильной техники. — М., 1996.
- Ельницкий А.
П., Василевская Е. И., Шарапа Е. И., Шиманович И. Е. Химия. — Мн.: Народная асвета, 2007.
