<img src=»/cache/referats/21821/image001.gif» v:shapes=»_x0000_i1025″>
ученицы 9 «В» класса
гимназии № 44
Богдановой Инги
Сернаякислота
Свойства.
Сернаякислота представляет собой бесцветную вязкую жидкость, плотность 1,83 г/мл(20º).
Температура плавления серной кислоты составляет 10,3ºС,температура кипения 269,2ºС.
Химические свойства серной кислоты во многом зависят от ее концентрации. В лабораториях ипромышленности применяют разбавленную и концентрированную серную кислоту, хотяэто деление условно (четкую границу между ними провести нельзя).
1. Взаимодействие с металлами.
Разбавленная серная кислота взаимодействует с некоторыми металлами,например с железом, цинком, магнием, с выделением водорода:
Fe+h3SO4=FeSO4+h3
Некоторые малоактивные металлы, такиекак медь, серебро, золото, с разбавленной серной кислотой не реагируют.
Концентрированная серная кислотаявляется сильным окислителем. Она окисляет многие металлы. Продуктами восстановлениякислоты обычно являются оксиды серы (IV), сероводород и сера (Н2S и Sобразуются в реакциях кислоты сактивными металлами – магнием, кальцием, натрием, калием и др.).
Примерыреакций:
Cu+2h3SO4=CuSO4+SO2+2h3O
Mg+2h3SO4=MgSO4+SO2+2h3O или
4Mg+5h3SO4=4MgSO4+h3S+4h3O
Серная кислота высокой концентрации(практически безводная) не взаимодействует с железом в результате пассивации металла. Явление пассивациисвязано с образованием на поверхности металла прочной сплошной пленки,состоящей из оксидов или других соединений, которые препятствуют контактуметалла с кислотой. Благодоря пассивации можно хранить и перевозитьконцентрированную серную кислоту в стальной таре. Концентрированная сернаякислота пассивирует также аллюминий, никель, хром, титан.
2. Взаимодействие с неметаллами.
Концентрированная серная кислотаможет окислять неметаллы, например:
S+2h3SO4=3SO2+2h3O
Окислительные свойства концентрированной серной кислоты могутпроявляться в реакциях с некоторыми сложными веществами – востановителями,например:
2KBr+2h3SO4=Br2+SO2+K2SO4+2h3O
3. Взаимодействия сосновными оксидами и основаниями.
Серная кислота проявляет все типичныесвойства кислот. Так, она реагирует с основными амфотерными оксидами игидроксидами с образованием солей. Как двухосновная кислота h3SO4образует два типа солей: средниесоли – сульфаты и кислые соли – гидросульфаты. Примеры реакций:
Оксиды серы. Серная кислота
... SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой. Химические свойства Кислотно-основные свойства Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует: а) с : ... 2SO3 SO 2 + Cl2 + 2H2 O = H2 SO3 + 2HCl Получение 1) Сернистый газ образуется при горении серы: S + O 2 = SO2 2) В промышленности его ...
Al2O3+3h3SO4=Al2(SO4)3+3Н2О
сульфат алюминия
2КОН+Н2SO4=K2SO4+2h3O
сульфат калия
КОН+Н2SO+=KHSO4+h3O
гидросульфат калия
Гидросульфаты образуются, когдакислота берется в избытке.
Многие соли серной кислоты выделяютсяиз растворов в виде кристаллогидратов, например
Al2(SO4)3 18Н2О Na2SО4 10Н2О
4. Взаимодействие с солями.
С некоторыми солями серная кислотавступает в реакции обмена, например:
СаСО3+Н2SO4=CaSO4+СО2↑+Н2О
ВаСl2+h3SO4=BaSO4↓+2HCl
Последняя реакция являетсякачественной на серную кислоту и ее соли: об их присутствии в растворе судят пообразованию белого осадка ВаSO4, которыйпрактически не растворяется в концентрированой азотной кислоте.
5. Взаимодействие с водой.
При растворении в воде сернаякислота активно взаимодействует с ней, образуя гидраты:
nh3O+h3SO4=h3SO4·nh3O
Благодоря способности связывать воду,серная кислота является хорошим осушителем.
Многие органические вещества,содержащие водород и кислород (бумага, древесина, ткани, сахара), при дествиисерной кислоты обугливаются в результате связывания кислотой воды. Например: процессобугливания сахара С12Н22О11можно описать следующим уравнением:
nC12h32O11+h3SO4=12nC
6. Диссоциация кислоты.
В водных растворах серная кислотадиссоциирует на ионы
В водном растворе серная кислота является оченьсильной- она диссоциирована практически полностью по юбоим ступеням. Безводнаясерная кислота диссоциирует в незначительной степени, т.е. является слабой.
Производство серной кислоты.
Весь процесс можно разбить на три последовательные стадии:получение диоксида серы, окисление его до триоксида и поглощение триоксидасеры.
1.<span Times New Roman»»>
- Получение диоксида серы.
Наиболее распространенным сырьемдля получения SO2 является пирит FeS2, который подвергается обжигу:
4FeS2+11O2=2FeO2+8SO2
Обжиг производят в специальнойпечи.В печь снизу под давлением подается воздух с такой скоростью, чтобы слойраздробленного пирита разрыхлялся, но частицы твердого вещества не уносилисьпотоком воздуха и обжиговых газов. Такой способ обжига называется обжигом в кипящем слое, так как слойтвердого вещества похож на кипящую жидкость.
В результате обжига пиритаполучается обжиговый газ, который, кроме диоксида серы, содержит кислород, азот,пары воды и другие примеси. Некотрые из этих примесей вредны для последующихпроцессов производства серной кислоты, поэтому обжиговый газ подвергается тщательной очистке от твердыхчастиц (пыли) и влаги. Осушение газа проводится концентрированной сернойкислотой.
Иногда в качестве сырья дляполучения серной кислоты используют диоксид серы, содержащийся в отходящихгазах других производств или полученный сжиганием серы.
2.Получение триоксида серы.
Вторая стадия производства сернойкислоты – окисление диоксида серы кислородом воздуха до триоксида. В настоящеевремя этот процесс осуществляется контактныи способом: окисление производитсяпри температуре 400- 600°С в присутствии катализаторов (платина, оксид ванадия(V)V2O5илиоксид железа(III) Fe2O3).Этот процесс экзотермический. Выделяющаяся теплота используется для подогреваобжигового газа.
Производство серной кислоты
... источники получения серной кислоты Сырьем в производстве серной кислоты могут быть элементарная сера и ... Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за ... серной кислоты - бесцветная маслянистая жидкость с температурой кристаллизации 10,37 о С, температурой кипения 296,2 о С и плотностью 1,85 т/м3 . С водой и оксидом серы ...
3.Прглощение триоксида серы.
Полученный оксид серы (VI) поступает впоглотительную башню, стенки которой орошаются концентрированной сернойкислотой(массовая доля h3SO498%).Поглощение триоксида серы водой неэффективно: образуется «туман» из мелкихкапелек серной кислоты, который долго концентрируется.
Конечный продукт производства –раствор SO3в серной кислоте, называемый олеумом. Он может быть разбавлен водой до серной кислоты нужной концентрации.
Применение.
Серная кислота – важнейший продуктхимической промышленности. Она находит примерение в производстве минеральныхудобрений, волокон, пластмасс, красителей, взрывчатых веществ, в металлургиипри получении меди, никеля, урана и других металлов. Используется ка осушител ьгазов.
Большое практическоеприменение из солей серной кислоты имеют различные сульфаты. Медный и железныйкупоросы CuSO4·5h3O и FeSO4 ·7h3O используются всельском хозяйстве для борьбы с вредителями растений, в производстве красок,для пропитки древесины в качествеантисептического средства. Купоросами называюткристаллогидраты сульфатов некоторых металлов (меди, железа, цинка, никеля).
Гипс CaSO4·2h3O и сульфаткальция СаSO4 используют в строительстве, медицинеи других облостях. Из гипса при прокаливании получают алебастр СаSO4·0,5h3O:
CaSО4·2h3O=CaSO4·0,5h3O+1,5h3O
Алебастр, смешааный с водой, быстрозатвердевает, превращаясь в гипс:
СаSO4·0,5h3O+1,5h3O=CaSO4·2h3O
Сульфат натрия N2SO4 используется в производстве стекла.Сульфат натрия входит в состав природного минерала Na2SO4·10h3O – глауберовой соли, или мирабилита. Сульфаты калия или аммонияприменяют как удобрения. Алюмокалиевыкквасцы КАI(SO4)2·11h3O проявляют дубящие своцства, и их используют в производствекожи, а также как протраву при крашении тканей. Сульфат бария ВаSО4применяется в производстве бумаги, резины и белыхминеральных красок.
www.ronl.ru
«Серная кислота и её применение»
Доклад по химии на тему:
«Серная кислота и её применение»
Серная кислота и её применение
 химической промышленности. серная кислота хлеб химической промышленности 1">
химической промышленности. серная кислота хлеб химической промышленности 1">
Серная кислота (h3SO4) — прозрачная, бесцветная или коричневая маслянистая жидкость, обладающая высокой коррозивной активностью. Это очень важный химический продукт, используемый по всему миру. Например, Великобритания в год производит более одного миллиона тонн серной кислоты.
Серную кислоту получают путем сжигания сульфатов, чтобы выделить диоксид серы, а в последствии под воздействием катализаторов и высокой температуры получают триоксид серы. В зависимости от дальнейшего использования кислоту оставляют в концентрированном виде, либо разбавляют водой — это контактный способ.
Серная кислота в жизнедеятельности человека применяется во многих сферах: при производстве каучука, удобрений, моющих средств, красителей, некоторых лекарств и при нефтепереработке. С недавних времен серную кислоту стали использовать в развитых странах при сборе урожая картофеля: кислота высушивает побеги, останавливает нежелательный дальнейший рост, расщепляет большую часть почвы, тем самым упрощается процесс извлечения картофеля из земли машинным способом.
Производство серной кислоты контактным способом
... применяется тонкая очистка газа мокрым способом. Принципиальная технологическая схема производства серной кислоты контактным способом Лучшим сырьем для производства сернистого газа служит сера, которая выплавляется из природных пород, содержащих серу, а также получается как ...
Дома основными источниками кислоты являются автомобильные свинцово-кислотные батареи (аккумуляторы), которые мы приносим в квартиру для подзарядки. Также кислота часто содержится в бытовых чистящих веществах, используемых для чистки канализации и удаления засоров в трубах. В небольших количествах серная кислота содержится в клее, зубной пасте (силикатах), в продуктах в виде лимонной и молочной кислоты, в некоторых лекарствах.
Стоит упомянуть тот факт, что серная кислота не сохраняется в окружающей среде, быстро нейтрализуется. Однако, высококонцентрированный раствор серной кислоты опасен для человека: при контакте с кожей вызывает сильные ожоги, а при попадании в полость рта, горло, желудок может вызвать летальный исход. Контакт глаз с серной кислотой может привести к слепоте. Чем быстрее пострадавший промоет рану большим количеством воды или слабым содовым раствором, тем больше шансов сохранить пораженный кожный покров. При разлитии серной кислоты нельзя дышать её парами — можно повредить легкие, горло и даже зубы. Особенно страдают от паров кислоты астматики.
Так как серная кислота воздействует точечно, то есть в месте соприкосновения с объектом, то беременные женщины могут не переживать за плод, если, скажем, получили небольшой ожог руки.
Серная кислота (h3SO4) — прозрачная, бесцветная или коричневая маслянистая жидкость, обладающая высокой коррозивной активностью. Это очень важный химический продукт, используемый по всему миру. Например, Великобритания в год производит более одного миллиона тонн серной кислоты.
Серную кислоту получают путем сжигания сульфатов, чтобы выделить диоксид серы, а в последствии под воздействием катализаторов и высокой температуры получают триоксид серы. В зависимости от дальнейшего использования кислоту оставляют в концентрированном виде, либо разбавляют водой — это контактный способ.
Серная кислота в жизнедеятельности человека применяется во многих сферах: при производстве каучука, удобрений, моющих средств, красителей, некоторых лекарств и при нефтепереработке. С недавних времен серную кислоту стали использовать в развитых странах при сборе урожая картофеля: кислота высушивает побеги, останавливает нежелательный дальнейший рост, расщепляет большую часть ботвы, тем самым упрощается процесс извлечения картофеля из земли машинным способом.
Дома основными источниками кислоты являются автомобильные свинцово-кислотные батареи (аккумуляторы), которые мы приносим в квартиру для подзарядки. Также кислота часто содержится в бытовых чистящих веществах, используемых для чистки канализации и удаления засоров в трубах. В небольших количествах серная кислота содержится в клее, зубной пасте (силикатах), в продуктах в виде лимонной и молочной кислоты, в некоторых лекарствах.
Стоит упомянуть тот факт, что серная кислота не сохраняется в окружающей среде, быстро нейтрализуется. Однако, высококонцентрированный раствор серной кислоты опасен для человека: при контакте с кожей вызывает сильные ожоги, а при попадании в полость рта, горло, желудок может вызвать летальный исход. Контакт глаз с серной кислотой может привести к слепоте. Чем быстрее пострадавший промоет рану большим количеством воды или слабым содовым раствором, тем больше шансов сохранить пораженный кожный покров. При разлитии серной кислоты нельзя дышать её парами — можно повредить легкие, горло и даже зубы. Особенно страдают от паров кислоты астматики.
Так как серная кислота воздействует точечно, то есть в месте соприкосновения с объектом, то беременные женщины могут не переживать за плод, если, скажем, получили небольшой ожог руки.
infourok.ru
Реферат на тему Серная кислота
Физические свойства.
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % h3SO4. Затвердевает она лишь ниже -20 °С.
Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С).
Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно по двум направлениям: [Н3SO4+]·[НSO4-] = 2·10-4 и [Н3О+]·[НS2О7-] = 4·10-5. Его молекулярно-ионный состав может быть приближенно охарактеризован следующими данными (в %):
h3SO4 HSO4- h4SO4+ h4O+ HS2O7- h3S2O7
99,5 0,18 0,14 0,09 0,05 0,04
При добавлении даже малых количеств воды преобладающей становится диссоциация по схеме:Н2О + Н2SО4 Н3О+ + НSO4-
Химические свойства.
h3SO4 — сильная двухосновная кислота.
h3SO4 H+ + HSO4- 2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+]
- [SO42-]) / [HSO4-] = 1,2
- 10-2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
- Zn0 + h3+1SO4(разб) —> Zn+2SO4 + h3O
b) концентрированная h3+6SO4 — сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или h3S-2 (без нагревания не реагируют также Fe, Al, Cr — пассивируются):
2Ag0 + 2h3+6SO4 —> Ag2+1SO4 + S+4O2 + 2h3O
8Na0 + 5h3+6SO4 —> 4Na2+1SO4 + h3S-2 + 4h3O
2) концентрированная h3S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
- С0 + 2h3S+6O4(конц) —> C+4O2 + 2S+4O2 + 2h3O
S0 + 2h3S+6O4(конц) —> 3S+4O2 + 2h3O
2P0 + 5h3S+6O4(конц) —> 5S+4O2 + 2h4P+5O4 + 2h3O
3) с основными оксидами:
- CuO + h3SO4 —> CuSO4 + h3O
CuO + 2H+ —> Cu2+ + h3O
4) с гидроксидами:
- h3SO4 + 2NaOH —> Na2SO4 + 2h3O
H+ + OH- —> h3O
h3SO4 + Cu(OH)2 —> CuSO4 + 2h3O
2H+ + Cu(OH)2 —> Cu2+ + 2h3O
5) обменные реакции с солями:
- BaCl2 + h3SO4 —> BaSO4 + 2HCl
Ba2+ + SO42- —> BaSO4
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
MgCO3 + h3SO4 —> MgSO4 + h3O + CO2 h3CO3
Моногидрат (чистая, 100%-ая серная кислота) является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в бисульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза (с переводом в бисульфаты).
Азотная кислота ведет себя в моногидрате как слабое основаниеHNO3 + 2 h3SO4 h4O+ + NO2+ + 2 HSO4-хлорная — как очень слабая кислотаh3SO4 + HClO4 = h4SO4+ + ClO4- Фторсульфоновая и хлорсульфоновая оказываются кислотами несколько более сильными (HSO3F > HSO3Cl > HClO4).
Моногидрат хорошо растворяет многие органические вещества, имеющие в своём составе атомы с неподелёнными электронными парами (способными к присоединению протона).
Некоторые из них могут быть затем выделены обратно в неизменённом состоянии путем простого разбавления раствора водой. Моногидрат обладает высоким значением криоскопической константы (6,12°) и им иногда пользуются как средой для определения молекулярных весов.
Концентрированная h3SO4 является довольно сильным окислителем, особенно при нагревании (восстанавливается обычно до SO2).
Например, она окисляет HI и частично HВr (но не HСl) до свободных галогенов. Окисляются ею и многие металлы — Cu, Hg и др. (тогда как золото и платина по отношению к h3SO4 устойчивы).
Так взаимодействие с медью идёт по уравнению:
Cu + 2 h3SO4 = CuSO4 + SO2 + h3O
Действуя в качестве окислителя, серная кислота обычно восстанавливается до SO2. Однако наиболее сильными восстановителями она может быть восстановлена до S и даже h3S. С сероводородом концентрированная серная кислота реагирует по уравнению:
h3SO4 + h3S = 2h3O + SO2 + S
Следует отметить, что она частично восстанавливается также газообразным водородом и поэтому не может применяться для его осушки.
Рис. 13. Электропроводность растворов серной кислоты.
Растворение концентрированной серной кислоты в воде сопровождается значительным выделением тепла (и некоторым уменьшением общего объёма системы).
Моногидрат почти не проводит электрического тока. Напротив, водные растворы серной кислоты являются хорошими проводниками. Как видно на рис. 13, максимальной электропроводностью обладает приблизительно 30 %-ная кислота. Минимум кривой соответствует гидрату состава h3SO4·h3O.
Выделение тепла при растворении моногидрата в воде составляет (в зависимости от конечной концентрации раствора) до 84 кДж/моль h3SO4. Напротив, смешиванием 66 %-ной серной кислоты, предварительно охлажденной до 0 °С, со снегом (1:1 по массе) может быть достигнуто понижение температуры, до -37 °С.
Изменение плотности водных растворов h3SO4 с её концентрацией (вес. %) дано ниже:
| 5 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 15 °С | 1,033 | 1,068 | 1,142 | 1,222 | 1,307 | 1,399 | 1,502 |
| 25 °С | 1,030 | 1,064 | 1,137 | 1,215 | 1,299 | 1,391 | 1,494 |
| 70 | 80 | 90 | 95 | 97 | 100 | ||
| 15 °С | 1,615 | 1,732 | 1,820 | 1,839 | 1,841 | 1,836 | |
| 25 °С | 1,606 | 1,722 | 1,809 | 1,829 | 1,831 | 1,827 |
Как видно из этих данных, определение по плотности концентрации серной кислоты выше 90 вес. % становится весьма неточным. Давление водяного пара над растворами h3SO4 различной концентрации при разных температурах показано на рис. 15. В качестве осушителя серная кислота может действовать лишь до тех пор, пока давление водяного пара над её раствором меньше, чем его парциальное давление в осушаемом газе.
Рис. 15. Давление водяного пара.
Рис. 16. Температуры кипения над растворами h3SO4. растворов h3SO4.
При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 °С, когда начинает перегоняться 98,3 % h3SO4(рис. 16).
Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 °С серной кислоты частично диссоциирован на h3O и SO3, которые вновь соединяются при охлаждении. Высокая температура кипения серной кислоты позволяет использовать её для выделения при нагревании легколетучих кислот из их солей (например, HCl из NaCl).
Получение.
Моногидрат может быть получен кристаллизацией концентрированной серной кислоты при -10 °С.
Производство серной кислоты.
1-я стадия. Печь для обжига колчедана.
4FeS2 + 11O2 —> 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита)
2) метод «кипящего слоя»
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С — 500°С; катализатор V2O5):
2SO2 + O2 2SO3
3-я стадия. Поглотительная башня:
- nSO3 + h3SO4(конц) —> (h3SO4
- nSO3)(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Применение.
Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги.
Серная кислота — один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др.
Практически важно то обстоятельство, что очень крепкая (выше 75 %) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная h3SO4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны.
Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой h3SO4) связано её разрушающее действие на растительные и животные ткани. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой.
Молекулы чистой серной кислоты.
Рис.1. Схема водородных связей в кристалле h3SO4.
Молекулы, образующие кристалл моногидрата, (НО)2SO2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО)2SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, РНО-S-ОН = 104°, d(S=O) = 143 пм, РOSO = 119°. В ионе HOSO3-, d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO42- тетраэдр приобретает правильную форму и параметры выравниваются [d(SO) = 148 пм].Кристаллогидраты серной кислоты.
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: h4O+HSO4-. Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
Рис. 14. Температуры плавления в системе h3O·h3SO4.
bukvasha.ru
Реферат Серная кислота
Формат:
Дата создания: 10.10.2016
Размер: 10.55 KB
Скачать реферат Подобные документы:
Реферат Охрана окружающей среды, связанная с производством серной кислоты Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете. Производство серной кислоты происходит в три стадии на первой стадии получают SO2, путем обжига FeS2, затем SO3, после чего на третьей стадии получают серную кислоту.
Реферат Химическое загрязнение окружающей среды На всех стадиях своего развития человек был тесно связан с окружающим миром. Но с тех пор как появилось высокоиндустриальное общество, опасное вмешательство человека в природу резко усилилось, расширился объём этого вмешательства, оно стало многообразнее и сейчас грозит стать глобальной опасностью для человечества.
Конкурсная: Озоновые дыры. Экологические проблемы человечества “Можно, пожалуй, сказать, что назначение человека как бы заключается в том, чтобы уничтожить свой род, предварительно сделав земной шар непригодным для обитания”. С возникновением человеческой цивилизации появился новый фактор, влияющий на судьбу живой природы. Он достиг огромной силы в текущем столетии и особенно в последнее время. 5 млрд.
Реферат Серная кислота и экология биосферы Весь процесс можно разбить на три последовательных стадии: получение диоксида серы, окисление его до триоксида и поглощение триоксида серы. Наиболее распространенным сырьем для получения SO2 является пирит FeS2, который подвергают обжигу: Обжиг проводят в специальной печи.
Курсовая: Нитрование ароматических углеводородов. Производство нитробензола Тема работы: “Нитрование ароматических углеводородов. Производство нитро-бензола” Нитрования – один из важнейших процессов в химической промышленности. Продукты, получаемые за счёт нитрования, являются полуфабрикатами для производства многих товаров различных назначений от взрывчатых веществ до продукции фармацептической промышленности.
Реферат Производство серной кислоты нитрозным способом Технологическая схема производства серной кислоты контактным путём хорошо известна из школьных учебников. В нашей стране используется и другой, так называемый нитрозный, способ её получения. На первой стадии, одинаковой для обоих методов, получают сернист
Реферат Получение серной кислоты путем гидратации оксида серы Сначала в печь для обжига подается пирит (серный колчедан), где он обжигается, и из него выделяется оксид серы. Потом оксид серы поступает в аппарат, именуемый циклоном. Там из оксида серы отфильтровывают наиболее крупные пылинки примесей, но самые мелкие
Реферат Азотная кислота 3. Нитраты стр. 6 1. Азотная кислота. Чистая азотная кислота HNO—бесцветная жидкость плотностью 1,51 г/см при — 42 °С застывающая в прозрачную кристаллическую массу.
Самостоятельная: Производство серной кислоты контактным способом Выполнил студент I курса ФБД: Клименок М. А. Проверил преподаватель: Тарасевич В.
Реферат Сера Сера — одно из немногих веществ, которыми уже несколько тысяч дет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под № 16. Об одном из самых древних (хотя и гипотетических!) примен
Творческая: Исследование свойств хрома и его соединений Руководитель Г.И. Астахова Содержание TOC \o «1-3» \f Содержание………………………………………………………………………………………………………………
Реферат Производство серной кислоты Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ. После измельчения пирита, его оч
Курсовая: Колебательные химические реакции Болюбаш Ирина Преподаватель: Снидченко М.А. а) Исследования концентрационных колебаний до открытия Химия — наука экспериментальная.
nreferat.ru
Хлеб химической промышленности — реферат
Департамент образования
Администрация Кировской области
Оричевское районное управление образование
Оричевская средняя общеобразовательная школа №2
Проект
«Хлеб химической промышленности»
Выполнили:
Бехтерев Константин
и Сандаков Александр
ученики 9 класса
Консультант проекта
Володина Т. В.
Учитель химии
первая категория
Оричи 2009
Оглавление.
|
№ п/п |
Содержание |
Страницы |
|
1 |
Цель проекта. |
3 |
|
2 |
Задачи проекта. |
3 |
|
3 |
Срок реализации проекта. |
3 |
|
4 |
Этапы реализации проекта. |
3 |
|
5 |
Обоснование актуальности. |
4 |
|
6 |
Подготовительный этап. |
5 |
|
7 |
Информационные ресурсы. |
20 |
|
8 |
Приложение №1 |
21 |
|
9 |
Приложение №2. |
22 |
Цель проекта: изучить и исследовать свойства серной кислоты, узнать её значение в химической промышленности и жизни человека.
Задачи проекта:
- найти и проанализировать информационные ресурсы по теме: «Серная кислота».
- изучить строение, свойства и способы получение серной кислоты
- собрать информацию о её применении в химической промышленности
- составить презентацию.
Срок реализации проекта: сентябрь-март 2008-2009 учебного года.
Этапы реализации проекта
Этап |
Сроки |
Результат |
Подготовительный |
Сентябрь-декабрь2008года |
Анализ информационныхресурсов |
Практический |
Январь-апрель2009года |
Исследование по теме,Написание проектаСоздание презентации. |
Контрольно-оценочный |
Апрель-июнь2009года |
Оценка проекта. |
Обоснование актуальности проекта.
Как известно издавна серную кислоту считали «матерью» всех кислот.
Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
Позже, в 9 веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7h3O и CuSO4•5h3O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в 13 веке.
В 15 веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянных лабораторий перешли к большим свинцовым камерам.
В настоящее время серная кислота является «хлебом химической промышленности».
На уроках химии мы изучили тему: «Сера и её соединения», и решили узнать больше информации о производстве серной кислоты, её свойствах и применении.
Продуктом нашего проекта является компьютерная презентация созданная с учётом требований к презентациям, которые мы изучили в ходе работе над проектом.
На подготовительном этапе мы проанализировали информационные ресурсы по теме: «Серная кислота».
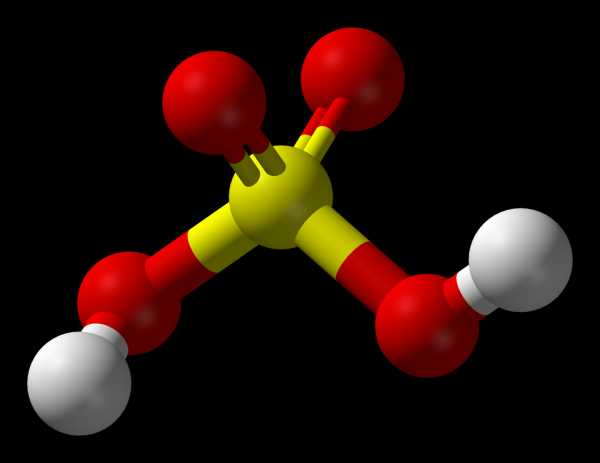
Серная кислота́ h3SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом.
Физические свойства:
Кислота серная — прозрачная, тяжелая, маслянистая жидкость с резким запахом. На воздухе медленно испаряется. Чистая серная кислота бесцветна, наличие примесей придает технической серной кислоте желтовато-бурый оттенок. Концентрацию серной кислоты определяют по содержанию в кислоте моногидрата или по плотности. С водой смешивается во всех отношениях, очень гигроскопична. Смешение серной кислоты с водой сопровождается высоким тепловым эффектом, выделением паров и газов.
Правила разбавления
Растворение серной кислоты в воде – физико-химическое явление, которое сопровождается выделением большого количества энергии (экзотермическая реакция. Каждому нужно знать правило:
Кислоту льём в воду, а не наоборот!!!
Иначе не избежать ожогов.
Правила обращения с кислотами
- Наливать кислоту осторожно, держа пробирку над ящиком.
- В случае попадания кислоты на кожу или слизистые оболочки, тщательно промыть под краном пораженное место.
- Нейтрализовать раствором соды.
Разрушающе действует на органические вещества, вызывает сильное раздражение глаз, вплоть до слепоты, разъедает кожу, вызывает ее изъязвление, ожоги, оказывает коррозионное действие на многие металлы. Серная кислота — негорючая пожароопасная жидкость. Разбавленная серная кислота растворяет металлы с выделением водорода, концентрированная вызывает самовоспламенение горючих веществ.
Химические свойства:
Серная кислота — довольно сильный окислитель.
I. Серная кислота в растворе обладает общими для класса кислот химическими свойствами.
1. Серная кислота ступенчато диссоциирует в растворе с образованием иона водорода.
h3SO4 = H++HSO4-
HSO4- = H++SO42-
серная кислота изменяет окраску индикаторов:
Лакмус — краснеет
Метиловый оранжевый — розовеет
2.Окислительно-востановительные реакции характерны для взаимодействия растворов серной кислоты с металлами.
Zn+h3SO4=ZnSO4+h3O
Zn+2H+=Zn2++h3
3.Реакции обмена разбавленной серной кислоты с основными и амфотерными оксидами:
MgO+h3SO4=MgSO4+h3OMgO+2H+=Mg2++h3O
4.Реакции с основаниями
h3SO4+2KOH=K2SO4+2h3O
2H++2OH=2h3O
5.Реакции с растворами солей:
h3SO4+Na2CO3=Na2SO4+CO2+ h3O
2H++ CO3-2= CO2+ h3O
Качественная реакция на серную кислоту и ее соли, с помощью которой можно распознать их среди других веществ, реакция с растворимыми солями бария:
h3SO4+BaCl2=BaSO4+2h3Cl
K2SO4+Ba(NO3)2= BaSO4+2KNO3
Суть процесса: выпадает белый осадок сульфата бария, не растворимый ни в воде, ни в кислотах:
Ba2++SO42+= BaSO4
Катион бария является реагентом на сульфат-ион.
II. Химические свойства концентрированной серной кислоты.
- концентрированная серная кислота активно взаимодействует с водой, образуя гидраты.
h3SO4+n h3O= h3SO4* n h3O+Q
- Окисление неметаллов
C+2h3SO4=CO2+ 3SO2+2h3O
S+2h3SO4=3SO2+2h3O
- окисление сложных веществ:
h3SO4+2h3Br= Br2+SO2+2h3O
- взаимодействие концентрированной серной кислоты с металлами.
8 Na+5 h3SO4= 4Na2 SO4+ h3S+4h3O
Концентрированная серная кислота реагирует и с металлами, стоящими в ряду активности после водорода, с такими, как медь, серебро, ртуть. Реакции идут при нагревании.
Cu+2h3SO4= Cu SO4+SO2+2h3O
Производство серной кислоты
Исходное сырье
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты в СССР получали из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу. В атмосферу с отходящими газами тепловых электростанций и металлургических заводов выбрасывается диоксида серы значительно больше, чем употребляется для производства серной кислоты. Из-за низкой концентрации SO2 в таких отходящих газах их переработка пока еще не всегда осуществима.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
В кратере вулкана Иджен на острове Ява, расположено большое горячее озеро серной кислоты, по берегам которого местные жители в нечеловеческих условиях добывают серу. В чаше из базальтовых серых стен расположено яблочно-зеленое озеро, над поверхностью которого тянутся сернистые шлейфы. Озеро находится на высоте 2 386 метров над уровнем моря. Глубина его не велика — 212 метров. По берегам вокруг черных отверстий, напоминающих раскрытые зевы чудовищ, отливают золотом валики серы. Такие же отверстия существуют в дне озера, поэтому его температура на поверхности составляет 60 градусов, а в глубине — свыше 200 градусов по Цельсию. Озеро хранит в своей чаше 40 миллионов тонн смеси концентрированных соляной и серной кислот. Но, самое удивительное, — в каждом литре этой смеси содержится ещё и 5 граммов растворенного алюминия. Ученые подсчитали, что всего в озере растворено свыше 200 тысяч тонн этого металла. «Дуновение» газов с высоким содержанием сероводорода, сернистого ангидрида и соляной кислоты не позволяет подолгу находиться в этом месте. Пары вызывают острые приступы кашля, если не одевать на лицо маску. Тем не менее, в кратере вулкана вручную добывается сера для промышленных нужд. Носильщики серы набивают по 70 — 80 кг сырья в специальные корзины, неся их в одну ходку. Дневная зарплата работника — около 5 долларов. Средняя продолжительность жизни индонезийского добытчика серы составляет 30 лет
Способы производства
Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4 , поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный).
Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2, высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2. Кроме олеума, концентрированной серной кислоты и аккумуляторной кислоты, отечественные заводы выпускают также более чистую контактную кислоту улучшенного качества (для производства искусственного волокна, титановых белил и др.), чистый олеум, химически чистую и реактивную серную кислоту.
referat911.ru
Реферат: Серная кислота
Серная кислота
Химическое производство представляет собой сложную химико-технологическую систему (ХТС), сложность которой определяется как наличием большого количества связей, элементов и подсистем, так и разнообразием решаемых задач. Основной целью химического производства является получение химического (целевого) продукта заданного качества при минимальных затратах и возможно меньшим количестве отходов. Для анализа ХТС и возможности их оптимизации необходима модель процесса, отражающая, в первую очередь, связи между элементами и их взаимное влияние друг на друга. Основой такой модели служит баланс масс в системе.
Расчет материального баланса является основным этапом в проектной работе инженеров химиков-технологов. На основе материальных балансов определяется целый ряд важнейших техно-экономических показателей и характеристик основных аппаратов. Из данных материальных балансов определяют: расход сырья и вспомогательных материалов для обеспечения заданной производительности; тепловой баланс и, соответственно, расход энергии и теплообменную аппаратуру; экономический баланс производства, себестоимость продукции и, следовательно, рентабельность производства. Материальный баланс позволяет оценить степень совершенства производства (комплексность использования сырья, номенклатуру и количество отходов), а также проанализировать причины потерь. При расчете баланса задаются величиной механических потерь, которая, как правило, не должна превышать 5%. Эти потери определяются не столько несовершенством технологии или дефектами оборудования, сколько культурой производства в целом.
Технология серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это и тем, что она самая дешевая из всех кислот, а также ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260-336,5 ºС) находится в жидком состоянии.
Области применения серной кислоты чрезвычайно обширны. Существенная ее часть используется как полупродукт в различных отраслях химической промышленности, прежде всего для получения минеральных удобрений, а также солей, кислот, взрывчатых веществ. Серная кислота применяется и при производстве красителей, химических волокон, в металлургической, текстильной, пищевой промышленности и т. д.
Серная кислота может существовать как самостоятельное химическое соединение h3SO4, а также в виде соединений с водой
h3SO4*2h3O, h3SO4*h3O, h3SO4 *4h3O и с триоксидом серы h3SO4 *SO3 , h3SO4*2SO3.
В технике серной кислотой называют и безводную h3SO4 и ее водные растворы (по сути дела, это смесь h3O, h3SO4 и соединений h3SO4*nh3O), и растворы триоксида серы в безводной h3SO4 – олеум (смесь h3SO4 и соединений h3SO4*nSO3)
Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации 10,7ºC. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты (башенная кислота, контактная кислота и олеум).
Рассмотренные свойства серной кислоты необходимо учитывать как при выборе технологического режима процесса, так и при проектировании отдельных аппаратов, трубопроводов и т. д. Например, при размещении цеха на открытой площадке необходимо предусмотреть теплоизоляцию трубопроводов, по которым циркулируют растворы серной кислоты, имеющие достаточно высокие температуры кристаллизации. Учет диаграммы фазового равновесия паров и жидкости позволяет правильно выбрать условия проведения стадии абсорбции триоксида серы, обеспечивающие высокую степень абсорбции и предупреждающие побочные явления, такие, например, как образование сернокислотного тумана.
Сырье для серной кислоты и методы ее получения.
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является серы. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья (необходимость в этой стадии отпадает при использовании в качестве сырья отходящих газов, так как в этом случае обжиг сульфидов является одной из стадий других технологических процессов).
Следующий этап – превращение оксида серы (IV) в оксид серы (VI).
Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + h3Oà h3SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + h3O à h3SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
При подготовке данной работы были использованы материалы с сайта http://www.studentu.ru
www.neuch.ru
