Обширную группу химических соединений составляют комплексы, в молекулах которых всегда можно выделить центральный атом или ион, вокруг которого сгруппированы другие ионы или молекулярные группы.
Комплексы имеют исключительно большое значение в живой и неживой природе. Гемоглобин, благодаря которому осуществляется перенос кислорода из легких к клеткам ткани, является комплексом железа, а хлорофилл, ответственный за фотосинтез в растениях, – комплексом магния. Значительную часть природных минералов, в том числе многие силикаты и полиметаллические руды, также составляют комплексы. Химические методы извлечения металлов из руд связаны с образованием легкорастворимых, легкоплавких и высоколетучих комплексов. Современная химическая промышленность широко использует комплексы как катализаторы.
С использованием комплексов связана возможность получения многообразных лаков и красок, прочных электрохимических покрытий, фотоматериалов, надежных средств переработки и консервирование пищи.
Огромное значение имеют комплексные соединения в аналитической химии. Они используются как в качественном, так и в количественном анализах. Такое разнообразие применений заключается в особенностях строения, структуре химических связей.
При изучении литературы я перед собой ставил следующие цели:
- иметь представление о следующих понятиях и величинах: комплексообразователь, лиганд, координационное число, дентатность лиганда, внутренняя и внешняя сферы комплексного соединения, хелатные и полиядерные комплексные соединения;
- знать особенности химической связи во внутренней сфере комплексных соединений;
- условия образования, разрушения и трансформации комплексных соединений;
- особенности строения и функции в организме миоглобина, гемоглобина, метгемоглобина, цитохромов, ионофоров;
- понимать сущность металлолигандного гомеостаза и возможностей его нарушения и восстановления; комплексонометрии и ее применения в санитарно-клиническом анализе.
Многие процессы жизнедеятельности протекают с участием комплексных соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ. Характерной особенностью комплексных соединений является наличие в них химической связи, возникшей по донорно-акцепторному механизму.
Поэтому сущность реакции комплексообразования заключается во взаимодействии двух противоположностей: акцептора электронной пары и донора электронной пары.
Химизм токсичности металлов
... сделали заключение о периодических изменениях токсичности металлов, связанных с положением последних в этой системе: Токсичность комплексных соединений металлов. Не обнаружено сколько-нибудь значительной корреляции ... периодически, то и в токсичности металлов должна отмечаться такая же периодичность. Соли металлов в растворах могут образовывать ионы, гидраты, комплексы. В свою очередь последние ...
Комплексные соединения — устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцепторному механизму.
Комплексные соединения состоят из комплексообразователя и лигандов, образующих внутреннюю сферу, и внешней сферы, состоящей из ионов, которые компенсируют заряд внутренней сферы.
Комплексообразователь (центральный атом) — атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении.
Роль комплексообразователя в основном выполняют атомы или ионы d- и f-металлов, так как они имеют много свободных атомных орбиталей на валентном уровне и достаточно большой положительный заряд ядра, за счет которого способны притягивать электронные пары доноров. Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Значение координационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя. Наиболее характерными координационными числами являются 2, 4 и 6.
В комплексных соединениях комплексообразователь связан с лигандами.
Лиганды — молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем.
Обычно лигандами являются ионы или молекулы, содержащие неподеленные (свободные) электронные пары или достаточно подвижные π-электронные пары.
Лиганды-анионы: F — , Cl— , Br— , I— , OH— , NO2 — , CN— , CNS— , RCOO—
фторид хлорид бромид иодид гидроксид нитрит цианид роданид карбоксилат
Лиганды-молекулы: H 2 O, ROH, R—O—R, CO, NH3
вода спирты эфиры монооксид углерода аммиак
По числу связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, би- и полидентатные. Все вышеуказанные лиганды являются монодентатными, так как они выступают донорами только одной электронной пары.
К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы и способные выступать донорами двух электронных пар:
H 2 NCH2 CH2 NH2 — OOC—COO— ,H2 NCH2 COOмолекула этилендиамина дианион щавелевой кислоты анион аминоуксусной кислоты
Примерами полидентатных лигандов являются:
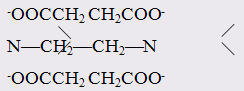
тетраанион этилендиаминтетрауксусной кислоты (EDTA)
6-дентатный лиганд
В соответствии со своей дентатностью лиганд может образовывать соответствующее число связей с комплексообразователем.
Лиганды координируются вокруг комплексообразователя, образуя внутреннюю сферу комплексного соединения.
Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов.
Комплексные соединения
... или электронейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком ... названия комплексообразователя). Название комплексного аниона составляют аналогично названию катиона, но степень окисленности комплексообразователя указывают перед его названием. Название комплексного аниона ...
Во внутренней сфере связь комплексообразователя с лигандами имеет донорно-акцепторное происхождение и является ковалентной. При записи формулы комплексного соединения его внутреннюю сферу выделяют квадратными скобками, например [NН 4 ]С1; К3 [Fе(СN)6 ]. Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов. Внутренняя сфера может быть:
а) заряжена положительно — катион:
[Сu 2+ (NН3 )4 0 ]z z = +2 + 4 -0 = +2
б) заряжена отрицательно — анион:
[Fe 3+ (CN— )6 ]z z = +3 + 6*(-1) = -3
в) электронейтральна:
[Fе 0 (СО)0 ]z z = 0 + 5*0 = 0
В соответствии с зарядом внутренней сферы комплексные соединения подразделяются на анионные, катионные и нейтральные комплексы.
Заряд внутренней сферы компенсируется ионами внешней сферы комплексного соединения.
Внешняя сфера комплексного соединения — это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона и связанные с ним ионной связью.
Суммарный заряд ионов внешней сферы всегда равен по значению и противоположен по знаку заряду внутренней сферы, чтобы молекула комплексного соединения была электронейтральна
[Сu(NH 3 )4 ]S04
внутренняя внешняя
сфера сфера
В образовании химической связи во внутренней сфере комплексного соединения важнейшую роль играет донорно-акцепторное взаимодействие лигандов и комплексообразователя. При этом между ними возникает ковалентная и не сильно полярная связь. Именно этим объясняются главные особенности свойств внутренней сферы комплекса: строго определенное пространственное расположение лигандов вокруг комплексообразователя и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем. Вначале рассмотрим структуру внутренней сферы комплексного соединения. Комплексообразователь предоставляет свободные орбитали, которые формируются из незанятых s-, p- и d-атомных орбиталей внешних электронных слоев. При этом комплексообразователь предоставляет не чистые s-, р- и d- орбитали, а энергетически равноценные гибридные орбитали, оси которых определенным образом располагаются в пространстве. Это и создает структуру внутренней сферы комплекса, которая определяется типом гибридизации исходных свободных атомных орбиталей комплексообразователя.
2.1Тип гибридизации атомных орбиталей комплексообразователя и структура внутренней сферы комплексного соединения
Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, наблюдаемая в тех случаях, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по-разному относительно друг друга. Если два одинаковых лиганда расположены рядом, то такое соединение называется цис-изомером, если эти лиганды расположены по разные стороны от комплексообразователя, то это трансизомер. Например, комплекс [Pt(NН 3 )2 Сl2 ]. Геометрические изомеры комплексных соединений различаются не только по физическим и химическим свойствам, но и по биологической активности. Так, цис-изомер комплекса [Pt(NН3 )2 Сl2 ] проявляет ярко выраженную противоопухолевую активность, а трансизомер — нет. Следовательно, не только состав, но и геометрия внутренней. Эффективность донорно-акцепторного взаимодействия лиганда и комплексообразователя, а следовательно, и прочность связи между ними определяются их поляризуемостью, т. е. способностью трансформировать свои электронные оболочки под внешним воздействием. По этому признаку реагенты подразделяются на «жесткие», или малополяризуемые, и «мягкие» — легкополяризуемые. Поляризуемость атома, молекулы или иона прежде всего зависит от размера молекулы и числа электронных слоев. Чем меньше радиус и число электронов у частицы, тем менее она поляризуема. Частицы с большим радиусом и большим числом электронов, наоборот, легко поляризуются. По этим признакам можно расположить в ряд комплексообразователи и лиганды, участвующие в процессах метаболизма:
Комплексообразователи:
Увеличение мягкости комплексообразователя:
Na + , K+ , Mg2+ , Ca2+ , Mn2+ , Fe2+ , Со2+ , Ni2+ , Сu2+ , Zn2+ , Сd2+ ,Pb2+ , Hg2+ .
Увеличение мягкости лиганда:
F — , ОН— , Н2 О, Сl— , Вr— , I— , RСОO— , NR3 , RSН, СN—
В соответствии с общим принципом «подобное в подобном» и спецификой донорно-акцепторного взаимодействия наиболее прочная и устойчивая к диссоциации ковалентная связь возникает между мягкими комплексообразователями и мягкими лигандами. С учетом того что белки, включая ферменты, содержат мягкие легкополяризуемые группы —СОO — , —NН2 и —SН, становится понятным, почему все «металлы жизни», относящиеся к (d-элементам, в организме встречаются практически только в виде комплексов с биосубстратами. С другой стороны, ясно, почему катионы тяжелых металлов Сd2+ , Рb2+ , Нg2+ сильно токсичны. Эти катионы очень «мягкие», особенно катион Нg2+ , и поэтому они активно образуют прочные комплексы с жизненно важными белоксодержащими субстратами, нарушая их метаболизм. Особенно легко в реакцию комплексообразования вступают белки, содержащие группу —SН:
2RSН + 2Нg 2+ — [R—S—Не—S—R] + 2Н+
Склонностью к комплексообразованию объясняется также токсичность цианидов, так как анион СN — — очень мягкий лиганд — активно взаимодействует с катионами d-металлов в комплексах, замещая в них биосубстраты и тем самым инактивируя эти биокомплексы. Катионы Na+ и К+ вследствие своей жесткости практически не образуют устойчивых комплексов с биосубстратами и в физиологических средах находятся в основном в виде гидратированных ионов. Катионы Мg2+ и Са2+ способны образовывать достаточно устойчивые комплексы с белками, и поэтому в физиологических средах они встречаются как в ионизованном, так и в связанном состоянии (в виде комплексов с белками, а также нерастворимых солей — фосфатов, оксалатов и уратов).
Таким образом, прочность и устойчивость к диссоциации ковалентной связи между комплексообразователем и лигандами зависит от их природы, и прежде всего от способности вызывать и проявлять поляризуемость.
3.1 Диссоциация в растворах
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения — это распад комплексного соединения в растворе на комплексный ион внутренней сферы и ионы внешней сферы.
В водных растворах первичная диссоциация комплексных соединений связана с разрывом в них ионной связи, и поэтому она практически необратима и ее уравнение следует записывать так:
[Ag(NН 3 )2 ]Сl — [Ag(NН3 )2 ]+ + Сl—
К 4 [Fе(СN)6 ] — 4К+ + [Fе(СN)]4-
Возникающий в результате первичной диссоциации подвижный комплексный ион ведет себя в растворе как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. Так, в водных растворах [Аg(NН 3 )2 ]Сl не удается обнаружить присутствие катионов Аg+ и молекул NН3 , в растворах К4 [Fе(СN)6 ] — катионов Fе2+ и анионов СN— ,
Вторичная диссоциация комплексного соединения -это распад внутренней сферы комплекса на составляющие ее компоненты.
Вторичная диссоциация связана с разрывом ковалентной связи, поэтому она сильно затруднена и имеет ярко выраженный равновесный характер подобно диссоциации слабых электролитов. Отрыв лигандов из внутренней сферы комплексного иона происходит ступенчато:
1-я ступень: [Ag(NН 3 )2 ]+ — [Ag(NН3 )]+ + NH3
2-я ступень: [Ag(NН 3 )]+ — Ag+ + NH3
Вторичная диссоциация, как всякий равновесный процесс, характеризуется константой равновесия, причем каждая стадия имеет свою константу. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса K нест . Для комплексного иона [Аg(NН3 )2 ]+ выражение константы нестойкости имеет вид: Чем меньше Кнест , тем стабильнее внутренняя сфера комплекса, т. е. тем меньше она диссоциирует в водном растворе. Значения Кнест комплексных соединений, приведенные в табл. 2, свидетельствуют о том, что в результате процесса комплексообразования происходит очень прочное связывание ионов в водных распорах, особенно ионов комплексообразователей. Следовательно, для связывания ионов из раствора можно чрезвычайно эффективно использовать реакцию комплексообразования. Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными («многозубыми») лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать несколько связей с ионами металлов, формируя устойчивую циклическую структуру. Образно говоря, ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака. В связи с этим такие комплексные соединения получили названия хелатов.
Таблица 2 Константы нестойкости комплексных ионов
| Комплексный ион | Кнест |
| [NH 4 ]+ /NH3 +H+ | 5,4*10 -10 |
| [Ag(NН 3 )2 ]+ /Ag+ +2NH3 | 9,3*10 -8 |
| [Cu(NH 3 )4 ]2+ /Cu2+ +4NH3 | 2,1*10 -13 |
| [Zn(OH) 4 ]2- /Zn2+ +4OH— | 3,6*10 -16 |
| [Fe(CN) 6 ]3- /Fe3+ +6CN— | 1*10 -31 |
| [Fe(CN) 6 ]4- /Fe2+ +6CN— | 1*10 -36 |
Хелаты — устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры.
Одними из наиболее эффективных хелатообразующих лигандов являются этилендиаминтетрауксусная кислота (ЕDТА) или ее динатриевая соль, называемая трилон Б:
 НООССН2 СН2 СООН
НООССН2 СН2 СООН
N—СН 2 —СН2 —N
НООССН 2 СН2 СООН
ЕDТА
НООССН 2 СН2 СООН
N—СН 2 —СН2 —N
НООССН 2 СН2 СОOH
трилон Б (Nа 2 Н2 Т)
ЕDТА образует устойчивые комплексы практически с катионами всех металлов, за исключением щелочных, поэтому ЕDТА широко используется в аналитической практике для определения содержания ионов различных металлов, а в медицине — в качестве детоксиканта для выведения из организма ионов тяжелых металлов в виде растворимых комплексов.
Среди природных лигандов следует выделить макроциклические полидентатные лиганды, внутри которых размещается комплексообразователь. Макроциклическими лигандами являются порфирины, близкие им по структуре коррины, а также белки. В этом случае лиганд называется «хозяин», а комплексообразователь – «гость». В таких комплексах комплексообразователь изолирован от окружающей среды и может удерживаться прочно, например в гемоглобине, цитохромах, витамине В 12 , хлорофилле, или слабо, например в ионофорах, используемых для транспорта катионов металлов через мембраны.
В природе встречаются полиядерные комплексные соединения. Для них характерно наличие во внутренней сфере нескольких комплексообразователей как одного вида (например, железо в железосеропротеинах [Fe x Sx Ргоt]), так и разных (например, в цитохромоксидазе содержатся одновременно катионы железа и меди).
Таким образом, состав, структура и прочность внутренней сферы природных комплексных соединений чрезвычайно разнообразны, и поэтому они могут выполнять различные функции в живых системах.
![]() 3.2 Образование комплексных соединений
3.2 Образование комплексных соединений
Как известно, реакции в растворах всегда протекают в направлении наиболее полного связывания ионов, в том числе за счет образования комплексных соединений, в которых в результате донорно-акцепторного взаимодействия возникает устойчивая внутренняя сфера.
FеCl 3 + 6КСNS — К3 [Fе(СNS)6 ] + ЗКСl
(Fе 3+ + 6СНS— — [Fе(СNS)6 ]3- )
Вследствие образования устойчивых комплексов возможно даже растворение тех осадков, которые посылают в раствор за счет диссоциации растворившейся части вещества крайне небольшое количество ионов, способных с добавленным реагентом образовывать устойчивую внутреннюю сферу комплекса:
Zn(ОН) 2 + 2NаОН — Nа2 [Zn(ОН)4 ]
(Zn(ОН) 2 + OH— — [Zn(ОН)4 ]2- )
Благодаря образованию комплекса происходит связывание молекулы аммиака (газообразного лиганда):
NН 3 + НС1 — [NН4 ]С1 (NН3 + Н+ — [NН4 ]+ )
NН 3 + Н2 0 — NН3
- Н2 0
В кислой среде происходит прочное связывание NН 3 вследствие образования комплексного иона [NН4 ]+ , а в нейтральной и щелочной среде имеет место конкуренция за прочное связывание Катиона водорода между анионом ОН— (Ка = КH2O = 1,8*10-16 ) и молекулой аммиака (Ка = Кнест (NH4 + ) = 5,4*10-10 ).
Из сравнения констант соответствующих равновесий видно, что молекула воды удерживает катион Н+ значительно сильнее, чем комплексный ион [NН4 ]+ . Поэтому использовать формулу гидроксида аммония NН4 ОН некорректно, а следует изображать результат взаимодействия между молекулами воды и аммиака в виде NН2
— Н2 О – комплекса-ассоциата (гидрата аммиака).
Водный раствор аммиака, называемый в быту нашатырным спиртом», используется в медицинской практике как источник аммиака и средство скорой помощи для возбуждения дыхания и выведения из обморочного состояния. Таким образом, комплексное соединение возникает в тех случаях, когда донорно-акцепторное взаимодействие комплексообразователя с лигандами приводит к их прочному связыванию с формированием устойчивой внутренней сферы.
3.3 Трансформация или разрушение комплексных соединений
Трансформация или разрушение комплексного соединения происходит в тех случаях, когда компоненты его внутренней сферы, вступая во взаимодействие с добавленным реагентом, связываются или трансформируются вследствие образования: а) более устойчивого комплекса; б) малодиссоциирующего соединения; в) малорастворимого соединения; г) окислительно-восстановительных превращений. Проиллюстрируем эти положения на примерах.
А. Трансформация комплекса с образованием более устойчивого комплекса в результате:
- более прочного связывания лигандов с новым комплексообразователем, т. е. реакции обмена комплексообразователя:
[Сu(NН 3 )4 ]S04 + 2Н2 SО4 — СиSО4 + 2[NН4 ]2 SО4
([Сu(NН 3 )4 ]2+ 4Н+ — Сu2+ + [NН4 ]+ )
- более прочного связывания комплексообразователя с новым лигандом, т. е. реакции обмена лигандами во внутренней сфере:
[Pt(NH 3 )4 Cl2 ] + 4КСN — К2 [Рt(СN)4 ] + 4NН3 + 2КСl
([Pt(NH 3 )4 Cl2 ]+ 4СN— — [Рt(СN)4 ]2- + 4NH3 )
Замена лигандов во внутренней сфере комплексного соединения протекает ступенчато, причем при наличии различных лигандов вначале замещается тот лиганд, связь которого с комплексообразователем лабильна:
[Рt(NН 3 )2 С12 ] + КI — [Рt(NН3 )2 ClI] + КС1
([Рt(NН 3 )2 С12 ] + I— — [Рt(NН3 )2 СlI] + Сl— )
Рассмотренные реакции трансформации комплексных соединений всегда протекают в сторону образования более устойчивых комплексных соединений, у которых константа нестойкости внутренней сферы меньше, чем у исходных соединений.
Б. Разрушение гидроксокомплексов в кислой среде из-за образования малодиссоциированного соединения
Nа 2 [Zn(ОН)4 ] + 4НС1 — 2NaCl + ZnCl2 + 4Н2 O
([Zn(ОН) 4 ]— + 4Н+ — Zn2+ + 4Н2 0)
В. Разрушение комплексного соединения с образованием малорастворимого соединения, в котором комплексообразователь или лиганд связан прочнее, чем в комплексе:
[Ag(NH 3 )2 ]Cl + KI -AgI + 2КСl + 2NН3
([Ag(NH 3 )2 ]+ + I— — AgI + 2NH3 )
Г. Разрушение или трансформация комплексного соединения в результате окислительно-восстановительных превращений:
- лиганда:
K 2 [CdI4 ] + Cl2 — 2КСl + СdС12 + 2I2
([CdI 4 ]2- + Cl2 — Сd2+ + 2I2 + 4Сl— )
- комплексообразователя:
2К 4 [Fе(СN)6 ] + С12 — 2К3 [Fе(СN)6 ] + 2КС1
(2[Fе (СN) 6 ]4- + С12 — 2[Fе(СN)6 ] + 2Сl— )
Процесс комплексообразования сильно влияет на величины восстановительных потенциалов катионов d-металлов. Если восстановленная форма катиона металла образует с данным лигандом более устойчивый комплекс, чем его окисленная форма, то потенциал возрастает. Снижение потенциала происходит, когда более устойчивый комплекс образует окисленная форма. Иллюстрацией сказанному являются следующие данные.
Fe 3+ + e— — Fe2+
φ 0 ’ = 0,35 B
Эти особенности окислительно-восстановительных свойств ионов «металлов жизни» в биокомплексах очень важны для понимания биохимических процессов, протекающих при их участии.
3.4 Кислотно-основные свойства комплексных соединений
Комплексные соединения могут проявлять кислотно-основные свойства за счет ионов Н + и ОН~ внешней сферы:
кислоты: H 2 [SiF6 ] — 2Н+ + [SiF6 ]2-
основания: [Аg(NН 3 )2 ]ОН — [Аg(NН3 )2 ]+ + ОН—
и, кроме того, за счет диссоциации их лигандов. Последнее особенно характерно для природных комплексов, содержащих белки, которые, как известно, являются амфолитами. Например, гемоглобин (ННb) или оксигемоглобин (ННbО2) проявляют кислотные свойства за счет кислотных групп белка глобина, являющегося лигандом:
ННb — Н + + Hb— ННЬО2 — Н+ + HbO2
В то же время анион гемоглобина за счет аминогрупп белка глобина проявляет основные свойства и поэтому связывает кислотный оксид С0 2 с образованием аниона карбаминогемоглобина (НbСО2 )— :
СО 2 + Hb— — (НbCО2 )—
С помощью этого соединения СО 2 транспортируется из тканей в легкие, где, вступая в реакцию с более сильной кислотой оксигемоглобином, превращается в слабую нестойкую кислоту ННbСО2 , распадающуюся на гемоглобин с выделением СО2 .
(НbСО 2 )— + ННbО2 — НbО2 — + ННb + СО2
Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов.
4.1 К ачественный анализ катионов
В первую аналитическую группу катионов входят ионов калия K + , натрия Na+ , аммония NH4 + и магния Mg2+ . В отличии от катионов других групп большинство солей калия, натрия, аммония, легко растворимы в воде. Ион Mg2+ свойствам несколько отличается от других катионов этой группы. Он образует труднорастворимые в воде гидрат окиси, фосфорнокислую и углекислую соли. Поскольку нерастворимость в воде углекислых солей – важнейший аналитический признак катионов второй группы, то Mg2+ иногда относят к ней. Но углекислый магний хорошо растворим в аммонийных солях. А так как отделение катионов второй группы от катионов первой группы растворим (NH4 )2 CO3 проводят присутствии NH4 Cl, то в ходе анализа Mg2+ оказывается не в осадке со второй группой, а в растворе с первой группой.
Реакция с кобальтинитритом натрия Na 3 [Co(NO2 )6 ].
Кобальтинитрит натрия в нейтральном или уксусном растворе дает с ионами калия желтый кристаллический осадок кобальтинитрита калия-натрия:
2KCl + Na 3 [Co(NO2 )6 ] = K2 Na[Co(NO2 )6 ] + 2NaCl
или в ионном виде:
гибридизация атомный кислотный диссоциация титрование
2K + +Na+ + [Co(NO2 )6 ]3- = K2 Na[Co(NO2 )6 ]
Ион NH 4 + дает аналогичный осадок.
Выполнение.
Реакция можно выполнить не капельной пластинке и в пробирке. К 3—4 каплям раствора KCl или KNO 3 прибавили 2—3 капли раствора реактива. В щелочной среде реакция проводить нельзя, так как от щелочи реактив разлагается, образуя гидрат окиси кобальта:
Na 3 [Co(NO2 )6 ] + 3NaOH = Co(OH)3 + 6NaNO2
Рассматриваемая реакция на ион K + более чувствительна, чем с гидротартратом натрия. Поэтому именно ею и пользуются для осаждения иона K+ из сыворотки при перманганатометрическом определении калия в крови.
Реакция с реактивом Несслера
(щелочной раствор ртутноиодистого калия K 2 [HgI4 ]).
Этот реактив дает с аммонийными солями красновато-коричневый осадок состава [NH 2 Hg2 O]I (его структурная формула HO – Hg –NH – I ):
NH4 Cl + 2 K2 [HgI4 ] + 4KOH = [NH2 Hg2 O]I + 7KI + KCl + 3H2 O
или в ионном виде:
NH4 + + 2[HgI4 ]— + 4OH— = [NH2 Hg2 O]I + 7I— + 3H2 O
При очень малых количествах солей аммония вместо осадка получает желтый раствор. Реакция очень чувствительна. Она применяется в биохимическом анализе для определения общего азота в крови, мочевины, в санитарно-гигиенических лабораториях – при анализе воды, воздуха, пищевых продуктов (в частности мяса) и т.д.
Выполнение.
А. К 1—2 каплям разбавленного раствора аммонийной соли на капельной пластинке прибавить 3—4 капли реактив Несслера выпадение красновато-коричневого осадка. Реактив Несслера прибавлять в избытке, так как осадок растворим в большом количестве аммонийных солей.
Ко второй аналитической группе катионов относятся ионы Ba 2+ , Ca2+ , Sr2+ .
Кальций, стронций, барий называются щелочноземельными металлами. По своей активности они лишь немного уступают щелочным металлам. Образуемые ими гидраты окислов являются сильнымиоснованиями; их растворимость растёт с увеличением порядкового номера металла.
Щелочноземельные металлы образуют большое количество солей; из них растворимы галоидные, азотнокислые, уксуснокислые и кислые углекислые. Групповой реактив этой группы катионов – углекислый аммоний (NH 4 )2 CO3 , образующий с ионами Ba2+ и Ca2+ не растворимые в воде средние соли BaCO3 и CaCO3 .
Реакция с ферроцианидом калия K 4 [Fe(CN)6 ].
Этот реактив с солями кальция в присутствии солей аммония образует белый кристаллический осадок ферроцианида кальция и аммония Ca(NH 4 )2 [Fe(CN)6 ]:
CaCl 2 + 2NH4 Cl + K4 [Fe(CN)6 ] = Ca(NH4 )2 [Fe(CN)6 ] + 4KCl
или в ионном виде:
Ca 2+ + 2 NH4 + + [Fe(CN)6 ]4- = Ca(NH4 )2 [Fe(CN)6 ]
Выполнение.
К 3—5 каплям раствора CaCl 2 прибавить по 3—5 капель NH4 Cl и NH4 OH и 5—6 капель раствора K4 [Fe(CN)6 ]. Смесь нагреть 2—3 минуты на водяной бане.
Наблюдать выпадения осадка. В уксусной кислоте этот осадок не растворяется.
К третьей аналитической группе катионов относятся ионы Al 3+ , Cr3+ , Fe2+ , Fe3+ , Mn2+ , Zn2+ .
Сернистые соединения катионов этой группы не растворимы в воде (в отличие от первой и второй групп), но растворимы в разбавленных в минеральных кислотах (в отличие от четвёртой и пятой групп).
Вследствие этого сероводород не осаждает катионы третьей группы из кислых растворов. Из нейтральной растворов сероводород тоже либо вовсе не осаждает катионы третьей группы, так как либо осаждение их оказывается неполное (Zn 2+ ), так как образуются свободные кислоты. Поэтому для полного осаждения катионов третьей группы в виде сернистых соединений вместо сероводорода применяется его хорошо диссоциированные соли.
Групповой реактив на катионы третьей группы – сернистый аммоний (NH 4 )S.
Хлористые, сернокислые, и азотнокислые соли этих элементов растворимы в воде. Растворы их вследствие гидролиза имеют слабокислую реакцию.
Реакция с гексацианоферратом (II) калия K 4 [Fe(CN)6 ]3 .
K 4 [Fe(CN)6 ] даёт с солями Fe3+ в кислой среде синий осадок называемой берлинской лазури:
4FeCl 3 + 3 K4 [Fe(CN)6 ] = Fe4 [Fe(CN)6 ]3 + 12KCl
или в ионном виде:
4Fe 3+ + 3[Fe(CN)6 ] = Fe4 [Fe(CN)6 ]3
Выполнение.
К 4—5 каплям раствора FeCl 3 добавить 2—3 капли соляной кислоты и 4—5 капель раствора реактива. Наблюдать выпадение осадка железистосинеродистого железа. Реакция очень чувствительна и применяется для открытия ионов Fe3+ в анализируемом растворе. Щелочи разлагают берлинскую лазурь с образованием Fe(OH)3 . К осадку Fe4 [Fe(CN)6 ]3 прилить 8—10 капель раствора едкого натра и сильно встряхнуть. Реакция можно выполнять капельным методом на фильтровальной бумаге или на капельной пластинке.
Реакция с гексацианоферратом (III) калия K 3 [Fe(CN)6 ].
K 3 [Fe(CN)6 ], называемый красной кровяной солью, дает с солями Fe2+ в кислой среде темно-синий осадок железосинеродистой закиси железа (турнбулева синь) Fe3 [Fe(CN)6 ]2 :
3FeSO 4 + K3 [Fe(CN)6 ] = Fe3 [Fe(CN)6 ]2 + K2 SO4
или в ионном виде:
3Fe 2+ + [Fe(CN)6 ]3- = Fe3 [Fe(CN)6 ]2
Выполнение.
К 5—6 каплям раствора соли Fe 2+ прибавить 2—3 капли соляной или серной кислоты (для подавления гидролиза соли) и 2—3 капли раствора реактива. Тотчас же выпадает темно-синий осадок турнбулевой сини. Это наиболее чувствительная реакция на ион Fe2+ .
Осадок Fe 3 [Fe(CN)6 ]2 разлагается щелочами с образованием Fe(OH)2 :
Fe 3 [Fe(CN)6 ]2 + 6 NaOH = 3Fe(OH)2 + 2 Na3 [Fe(CN)6 ]
или в ионном виде:
Fe 3 [Fe(CN)6 ]2 + 6OH— = 3 Fe(OH)2 + [Fe(CN)6 ]3-
К осадку турнбулевой сини прилить несколько капель раствора едкого натра.
Реакция с железосинеродистым калием удобно проводить капельным методом на фильтровальной бумаге или на капельной пластинке.
Реакция с гексацианоферратом (II) калия K 4 [Fe(CN)6 ]3 .
K 4 [Fe(CN)6 ] образует с ионами цинка белый осадок железистосинеродистого калия и цинка:
3ZnCl 2 + 2K4 [Fe(CN)6 ] = Zn3 K2 [Fe(CN)6 ]2 + 6KCl
или в ионном виде:
3Zn 2+ + 2 K+ 2[Fe(CN)6 ] = Zn3 K2 [Fe(CN)6 ]2
Выполнение.
К 4—5 каплям раствора соли цинка прибавить 4—5 капель раствора реактива. Нагреть смесь до кипения. Наблюдать образование осадка.
В кислотах не растворяется, но растворяется в едких щелочах с образованием цинката.
Относятся катионы Hg 2+ , Cu2+ , Bi3+ , Ag+ , Pb2+ .
Сернистые соединения этих металлов не растворимы в разбавленных кислотах. Осаждаются они сероводородом в кислой среде и таким образом могут быть отделены от катионов 1, 2, 3-й групп. На этом основании сероводород в кислой среде считается их групповым реактивом.
Многие катионы 4-й группы склоны к образованию прочных комплексов с аммиаком, цианистыми соединениями и другими веществами, что с успехом используется в аналитической химии.
Реакция с гексацианоферратом (II) калия K 4 [Fe(CN)6 ]3 .
K 4 [Fe(CN)6 ] выделяет из раствора солей двухвалентной меди красно-бурой осадок железистосинеродистой меди Cu2 [Fe(CN)6 ]:
2CuSO 4 + K4 [Fe(CN)6 ] = Cu2 [Fe(CN)6 ] + 2K2 SO4
или в ионном виде:
2Cu 2+ + [Fe(CN)6 ]4- = Cu2 [Fe(CN)6 ]
Осадок не растворим в разбавленных кислотах, но растворяется в NH 4 OH, образуя аммиакат меди:
Cu 2 [Fe(CN)6 ] + 12NH4 OH = 2[Cu(NH4 )3 ](OH)2 + (NH4 )4 [Fe(CN)6 ] + 8H2 O
или в ионном виде:
Cu 2 [Fe(CN)6 ] + 8NH3 = 2[Cu(NH4 )3 ]2+ + [Fe(CN)6 ]4-
Пятая группа катионов
К пятой аналитической группе относятся катионы мышьяка, сурьмы, олова.
Сернистые соединения этих элементов не растворимы в разбавленных кислотах. От сернистых соединений катионов 4-й группы сернистые соединения катионов 5-й группы отличает растворимостью в многосернистом аммонии с образованием так называемых сульфосолей. Это позволяет отделить сернистые соединения мышьяка, сурьмы, олова от не растворимых в многосернистом аммонии сернистые соединения 4-й группы.
Групповой реактив на ионы 5-й группы – многосернистый аммоний, который представляет собой смесь (NH 4 )2 S с (NH4 )2 S2 , (NH4 )2 S3 и другими подобными соединениями вплоть до (NH4 )2 S9 . Многосернистый аммоний готовят, растворяя серу в сернистом аммонии. Он является окислителем.
5.1 Понятие
В санитарно-клиническом анализе для количественного определения ионов металлов широко используется комплексонометрия.
Комплексонометрия — метод количественного анализа, основанный на реакции комплексообразования с получением прочных хелатных соединений металлов с комплексонами.
Комплексонами называются полидентатные лиганды, способные образовывать устойчивые хелатные комплексные соединения. В аналитической практике в качестве комплексона чаще всего используют трилон Б, обозначаемый для краткости Na 2 H2 T. Этот 6-дентатный лиганд образует очень устойчивые комплексы с большинством катионов металлов. Метод комплексонометрии на основе трилона Б называется трилонометрией. Наиболее ценным свойством трилона Б является его способность образовывать очень устойчивые бесцветные комплексы с катионами большинства металлов, при этом реакция всегда протекает в соотношении 1 : 1 и с вытеснением двух протонов, независимо от заряда катиона металла:
М + + (Н2 Т)2- — [МТ]3- + 2Н+
М 2+ + (Н2 Т)2- — [МТ]2- + 2Н+
М 3+ + (Н2 Т)2- — [МТ]— + 2Н+
М 4+ + (Н2 Т)2- — [МТ]° + 2Н+
Учитывая обратимость этого взаимодействия, необходимо поддерживать определенное значение pH для обеспечения полного протекания аналитической реакции. Оптимальное значение рH определяется устойчивостью комплекса и растворимостью гидроксида определяемого металла.
Для установления точки эквивалентности в комплексонометрии применяют металлоиндикаторы. Особенностями этих индикаторов, точнее их анионов, является способность образовывать с катионом определяемого металла комплекс, окраска которого отличается от окраски свободного аниона индикатора:
M 2+ Ind2- —[MInd]0
Катион определяемого металла в присутствии и аниона индикатора Ind 2- , и аниона трилона Б (Н2 Т)2- взаимодействует с обоими веществами, но больше с тем, которое образует более устойчивый комплекс:
(H 2 T)2- Ind2-
[MT] 2- + 2H+ — M2+ — [Mind]
Условие К нест (MT2- ) < Кнест (Mind)
Смешение равновесия при трилонометрии
Поэтому, чтобы равновесие было смещено в сторону комплекса с трилоном Б [МТ] 2- , его устойчивость должна быть больше, т. е. Кнест (MT2- ) < Кнест (Mind)
При добавлении к анализируемому раствору индикатор образует вначале комплекс [МInd] и раствор принимает окраску II, характерную для этого комплекса. При добавлении к окрашенному раствору раствора трилона Б он сначала реагирует со свободными ионами анализируемого металла с образованием бесцветного комплекса [МТ] 2- и только вблизи состояния эквивалентности происходит разрушение комплекса с индикатором [МInd] в соответствии с реакцией:
[МInd] 0 + (Н2 Т)2- — [МТ]2- + Ind2- + 2Н+
В точке эквивалентности окраска раствора резко изменяется (окраска II — окраска I), так как комплекс с индикатором окончательно исчезает, а в растворе содержатся только свободный индикатор и бесцветный комплекс [МТ] 2- . Таким образом, процесс, протекающий при трилонометрическом определении, например, двухзарядного катиона металла, отражают следующие реакции:
I стадия: М 2+ + Ind2- — [МInd]0
окраска I окраска II
II стадия: аМ 2+ + а(Н2 Т)2- + 2aOH— — а[MT]2 — + 2аН2 О
III стадия: МInd + (Н 2 Т)2- — МТ2- + Ind2- + 2Н+
аМ 2+ + [МInd] + (а + 1)(Н2 Т)2- + 2аОН— — (а + 1) [MT]2- + Ind2- + 2aH2 O + 2Н+
Трилонометрия широко используется в санитарно-клиническом анализе для определения содержания ионов кальция, цинка, магния, железа в фармацевтических препаратах, общего кальция (ионизованного, связанного, диффундирующего и недиффундирующего) в сыворотке крови, костях и хрящах, а также при анализе жесткости воды, обусловленной наличием в ней ионов Са 2+ и Мg2+ .
Суммируя все сказанное о химических превращениях, обеспечивающих метаболизм нашего организма: кислотно-основном (обмен протонами); окислительно-восстановительном (обмен электронами); комплексообразовании (взаимодействие свободных атомных орбиталей комплексообразователя и электронных пар лиганда ),следует выделить для них общее. В основе всех этих процессов находится принцип единства и борьбы противоположностей «акцептора — донора», и все они в организме носят в основном обратимый характер, что обеспечивает большинству из них самопроизвольное протекание и способствует поддержанию гомеостаза в организме.
Другая особенность всех рассмотренных реакций заключается в том, что они в условиях организма обычно являются электрофильно-нуклеофильными.
В кислотно-основных реакциях кислота как донор Н + выступает электрофилом, а основание — нуклеофилом.
В реакциях комплексообразования комплексообразователь как акцептор электронных пар является электрофилом, а лиганды -нуклеофилами.
В окислительно-восстановительных реакциях окислитель — акцептор электронов — выступает электрофилом, а восстановитель -нуклеофилом. Особенность окислительно-восстановительных реакций заключается в том, что они могут протекать и по свободно-радикальному механизму. В этом случае реагирующая частица с неспаренным электроном — свободный радикал — может быть и акцептором и донором электрона в зависимости от свойств партнера, с которым она взаимодействует. Сравнивая степени окисления атомов в исходных и конечных веществах (а не в радикалах), можно и в этом случае четко определить, что окислитель, а что восстановитель.
5.2 Комплексонометрическое титрование — комплексонометрия
Комплексонометрия основана на образовании внутрикомплексных соединений ионов металлов со специальными органическими реагентами группы аминополикарбоновых кислот — комплексонами. В настоящее время разработано много комплексонов. В практике химического и фармацевтического анализа наиболее часто применяют комплексен III (торгов звание трилон Б) —-. кислую двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА).
Для простоты в уравнениях реакций формулу ЭДТА изображаютNa 2 Н2 Т. При взаимодействии с металлами ЭДТА образует внутрикомплексные соединения постоянного состава 1:1, имеющие строение:
![]() НООССН2 СН2 СООН
НООССН2 СН2 СООН
N— СН 2 — СН 2 —N
НООССН 2 СН2 СОOH
Выделяющиеся при реакции ионы водорода сдвигают равновесие реакции образования комплекса влево, поэтому для полноты протекания реакции титрование проводят в буферной смеси при постоянной кислотности раствора (рH).
Комплексы большинства ионов металлов с ЭДТА образуются легко, растворимы в воде и обладают достаточной прочностью. Константы их устойчивости р, как правило, больше 1*1О 8 , что обеспечивает высокую точность определения (99,99% или 1*1О-4 ).
— Образуют с металл-ионами окрашенные комплексные соединения, обладающие небольшой константой устойчивости. Причем цвет комплекса отличается от цвета свободной формы индикатора. Наиболее часто применяют индикаторы кислотный хромовый черный специальный (эриохром черный Т), кислотный хромовый темно-синий, мурексид, реже пирокатехиновый фиолетовый, ксиленоловый оранжевый:
Кислотный хромовый черный специальный (эриохром черный Т).
Органический азокраситель, способный в нейтральной или щелочной среде (рН 7—11) образовывать комплексные соединения с ионами металлов (Сu 2+ , Мg2+ , Zn2+ , Мn2+ А13+ и др.).
Индикатор окрашен в синий цвет, комплексные соединения индикатора —в красный. При добавлении индикатора к анализируемому раствору соли металла образуется комплекс [МInd], и раствор окрашивается в красный цвет. При титровании раствором ЭДТА в точке эквивалентности появляется избыток ЭДТА, разрушающий [МInd]. Окраска раствора в точке эквивалентности из красной превращается в синюю:
MInd + H 2 T2- — MT2- + H2 Ind
Мурексид. В нейтральной среде окрашен в красно-фиолетовый цвет, в слабощелочной — в фиолетовый; образует с металл-ионами желтые (Ni 2+ ), желто-оранжевые (Сu2+ ) или красные (Са2+ ) комплексы.
Растворы индикаторов нестойки, готовят их в концентрации 0,1—0,5% в день употребления или применяют сухими в виде смеси с NаС1 (1:200—1:500).
На титрование берут ≈0,3 г смеси, добавляют к титруемому раствору и перемешивают до растворения порошка. ,
Применяют 0,01 М, 0,05 М, 0,1 М растворы ЭДТА, 0,1 и 0,01 н. растворы магний сульфата и 0,1; 0,01 н. растворы цинк сульфата. Раствор ЭДТА готовят, исходя из точной навески х. ч. «Трилона Б» на дистиллированной воде, свободной от примесей Са 2+ и Мg2+ -ионов. Перед приготовлением растворов ЭДТА. устанавливают пригодность воды для этой цели, добавляя 0,1 г. смеси индикатора кислотного хромового черного специального с НаС1 (1 :500) и аммиачный буферный раствор. Окраска раствора должна быть фиолетовой, переходить в синюю при добавлении 1—2 кап.. 0,05 М раствора ЭДТА и переходить обратно в фиолетовую при добавлении 1—2 капель 0,1 н. ZnSO4 .: Если вода не выдерживает пробу, ее очищают пропускание через колонку с катионитом КУ-2.
Титр раствора ЭДТА устанавливают либо по в чине навески х. ч. «Трилона Б», из которого готовился раствор, Либо по стандартам — металлическому Цинку или кальций карбонату, точные навески которых растворяют в разведенной Н 2 SО4 и доводят раствор водой до 1000 см3 . Часть раствора стандарта (20-25 см3 ) титруют раствором ЭДТА в присутствии кислотного хромового черного специального и рассчитывают титр. Растворы ЭДТА устойчивы в течение 3 мес.
Раствор ZnSO 4 готовят, исходя из точной навески металлического цинка, либо из цинк сульфата. В последнем случае титр раствора устанавливают по раствору ЭДТА. Растворы магний сульфата готовят из фиксанала соли или из кристаллического магний сульфата, в последнем случае титр раствора устанавливают по раствору ЭДТА.
Титрование растворами ЗДТА проводят в присутствии буферных растворов (чаще всего аммиачного), с помощью которых поддерживают в процессе титрования необходимый рН (щелочная среда).
В фармацевтическом анализе метод применяют для количественного определения солей кальция (хлорида, глюконата, лактата), препаратов цинка (оксида и сульфата), магний сульфата и висмута субнитрата. При анализе солей кальция применяют индикатор кислотный хромовый темно-синий, солей цинка и магния —: эриохром черный Т, солей висмута — смесь пирокатехинового фиолетового и ксиленолового оранжевого. Комплексонометрическое титрование нашло также широкое применение при анализе металлов, сплавов, определении жесткости воды.
Если для соли металла неизвестен индикатор, применяют обратное титрование — к раствору соли металла добавляют избыток 0,05 М раствора ЭДТА, 0,1 г индикаторной смеси и титруют 0,1 н. раствором MgSO 4 или ZnSО4 до перехода окраски раствора из синей в красную.
Комплексные соединения действительно имеют самое разнообразное применение. Ни один физиологический процесс не происходит без их участия. Комплексы находят самое широкое применение в качественном и количественном анализах веществ. В практике химического и фармацевтического анализа наиболее часто применяют комплексен III (торгов звание трилон Б) — кислую двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА).
Для простоты в уравнениях реакций формулу ЭДТА изображаютNa 2 Н2 Т.
Для широкого применения комплексных соединений очень важно знать особенности химической связи во внутренней сфере комплексных соединений; условия образования, разрушения и трансформации комплексных соединений; особенности строения и функции в организме миоглобина, гемоглобина, метгемоглобина, цитохромов, ионофоров; иметь представление о следующих понятиях и величинах: комплексообразователь, лиганд, координационное число, дентатность лиганда, внутренняя и внешняя сферы комплексного соединения, хелатные и полиядерные комплексные соединения.
Теория комплексных соединений очень интересна своей особенностью и сложностью.
1. Гликина Ф.Б., Ключников Н.Г. Химия комплексных соединений: Учеб. Пособие для студентов пед. ин-тов. – 3-е изд. – М.: Просвещение, 1986.—160с.
2. Лидин Р.А. Задачи по общей и неорганической химии: учеб. Пособие для студентов высш. учеб. заведений/ Р.А. Лидин, В.А. Молочко, Л.Л.Андреева; под ред. Р.А. Лидина. – М.: Гуманитар. изд. центр ВЛАДОС, 2004. – 383с.
3. Пономарев В.Д. Аналитическая химия. – М.: Медицина, 1982, 302с., ил.
4. Слесарев В. И. Основы химии живого: Учебник для вузов.- 2-е изд., испр. и доп.- СПб: Химиздат, 2001.-784 с.: ил.
5. Соколовская Е.М. Общая химия. Под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузея. М., Изд-во Моск. ун-та, 1980г. 726с., с ил.
