На сегодняшний день, после выхода Послания от 2012 года, президента Н.А.Назарбаева большой вклад основывается на улучшения и развитие химической, нефтяной, аграрной индустрии. Это означает, что Казахстан выходит с каждым разом к своей цели, на укрепление, улучшению экономики Казахстана!
Вакуум — кристаллизаторы служат для передачи теплоты от горячего теплоносителя к холодному (нагреваемому).
Теплоносителями могут быть газы, пары, жидкости. В зависимости от назначения теплообменные аппараты используют как нагреватели и как охладители. Применяется в технологических процессах нефтеперерабатывающей, нефтехимической, химической, газовой и других отраслях промышленности, в энергетике и коммунальном хозяйстве.
Кристаллизация переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое, а также из одного кристаллического состояния в другое (рекристаллизация, или вторичная К.); фазовый переход первого рода. К. из жидкой или газовой фазы экзотермический процесс, при котором выделяется теплота фазового перехода, или теплота.
Одним из многочисленного выбора теплообменных аппаратов являются вакуум- кристаллизаторы. Циркуляционные вакуум- кристаллизаторы находят, в химической промышленности все более широкое распространение.
Вакуум-кристаллизаторы бывают:
Вакуум- кристаллизатор с пропеллерной мешалкой.
Вакуум- кристаллизатор с циркуляционным насосом.
Очевидные преимущества циркуляционных вакуум — кристаллизаторов позволяют считать их наиболее перспективными для химической технологии. Это подтверждается тем фактом, что, несмотря на сравнительно небольшой срок их промышленной эксплуатации, в настоящее время предложено много различных вариантов этих аппаратов.
Отличительной особенностью этих кристаллизаторов является наличие циркуляционной трубы по всей высоте аппарата. Эти недостатки устранены в циркуляционных вакуум — кристаллизаторах, что обеспечило их широкое распространение. За последние годы в химической промышленности все более широкое распространение получают циркуляционные вакуум- кристаллизаторы. В данном курсовом проекте поставлена цель: Спроектировать и рассчитать вакуум- кристаллизатор для раствора MgSO , если G=17000 кг/ч, а =0,15, t =60 С, t =20 C .
1.
ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
1.1 Назначение и характеристика процесса
вакуум кристаллизатор сульфат магний
Сульфат магния (MgSO)- бесцветные призматические кристаллы, выветривающиеся на воздухе, легко растворимы в воде, практически не растворимы в спирте. Водные растворы имеют горько-соленый вкус.
Химическая промышленность мира (2)
... данной курсовой работы является исследование химической промышленности мира. 1 ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ МИРА Химическая промышленность, ... В последнее время на размещение многих химических производств, относящихся к особенно «грязным», все большее ... где бы химические продукты не находили широкого применения. Наиболее высокими темпами мировая химическая промышленность развивалась ...
Сульфат магния оказывает многогранное влияние на организм. При приеме внутрь он плохо всасывается, действует как слабительное средство, подобно натрия сульфату желчегонное действие, что связано с рефлексами, возникающими при раздражении нервных окончаний слизистой оболочки двенадцатиперстной кишки.
Получение
Получают в промышленности: растворением Mg и медных отходов в разб. H2SO при продувании воздуха; растворением MgO и H2SO ; сульфатизирующим обжигом сульфидов Mg; как побочный продукт электролитич.рафинирования Mg.
Fe+2HCl=FeCl2 +H2+ 2NaOH = Fe(OH)2 + 2NaCl
В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
4Fe(OH)2 +2H2O+O2 =4Fe(OH)3
Сульфат магния наиболее важная соль меди, часто служит исходным сырьем для получения других соединений.
Безводный сульфат магния можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого MgSO расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком — от грибковых заболеваний и виноградной тли.
В строительстве водный раствор сульфата магния применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.
Барабанные аппараты широко используются в промышленности в качестве сушилок, кристаллизаторов, печей и др. Механические расчеты вращающихся барабанов включают определение толщины стенки барабана, обеспечивающей прочность и жесткость конструкции, расчет на прочность бандажей, а также опорных и упорных роликов.
Барабанные аппараты могут быть использованы для выпаривания раствора древесноуксусного порошка, поступающего из трехкорпусного аппарата с получением пасты и сухого древесноуксусного порошка.
Барабанные аппараты работают обычно на жидком топливе (на мазуте), иногда на газовом топливе. Если бы после барабана имелся побудитель тяги в барабане создавалось бы разрежение и это способствовало бы процессу упарки. Для таких условий трудно подобрать материал, способный противостоять коррозии. Поэтому вопрос решен иначе: газовый поток преодолевает все сопротивление концентратора за счет напора, создаваемого в топке. Для этого топку герметизируют- заключают в стальной кожух, а воздух, необходимый для горения топлива, нагнетают в топку высоконапорной воздуходувкой. Мазут подается в топку через форсунку; парафинистый мазут предварительно подогревается.
Обычно барабанные аппараты имеют две опоры, но барабаны большой длины делают многоопорными. Для восприятия осевых нагрузок устанавливают упорные ролики. Их располагают так, чтобы они касались боковой поверхности одного из бандажей.
Использование барабанных аппаратов без ударного воздействия для растворения мелких фракций менее эффективно, чем шнековых.
Проектирование аппаратов для дробильно-сортировочной установки
... /ч; масса дробилки 5,6 тс. Производительность дробилки зависит от степени дробления и измельчения в широких пределах. По условиям обеспечения эффективности использования аппарата и безопасности работы степень дробления должна ... различного гранулометрического состава, которые в соответствии с ГОСТом расформировываются по крупности: 0-5 и 5-10 мм — песок ; 10- 20мм — мелкий щебень; 20-40 мм — средний ...
При работе барабанных аппаратов, опирающихся на ролики, в материале бандажей и роликов возникают контактные напряжения. Если принять, что между снимаемыми, цилиндрами отсутствует трение, то можно считать, что в точках контакта будут действовать лишь нормальные давления.
Имеются конструкции барабанных аппаратов, например кюль- вальцы.
Такие конструкции применимы лишь в тех случаях, когда объем среды, подаваемой в аппарат и удаляемой из него, невелик и скорость в сечении цапр допустима. Установка бандажей не сужает сечения аппарата. Кроме того, цапфа, являющаяся низшей кинематической парой, выдерживает большие динамические нагрузки, чем высшая кинематическая пара бандаж- ролик. Поэтому аппараты, испытывающие ударную нагрузку, предпочтительно устанавливать на цапках.
Учитывая широкое применение барабанных аппаратов в качестве сушилок, кристаллизаторов и печей, рассмотрим расчет на прочность их главных узлов и деталей.
От этих недостатков свободны барабанные аппараты.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т.п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки Е519(консервант).
В природе изредка встречается минерал Халькантит, состав которого близок к MgSO4 *5H2O(1,195)
1.2 Описание схемы процесса
Кристаллизаторы с водяным охлаждением
В таких аппаратах охлаждение раствора производится при помощи змеевика (рисунок 1а), рубашки (рисунок 1б) или выносного холодильника.
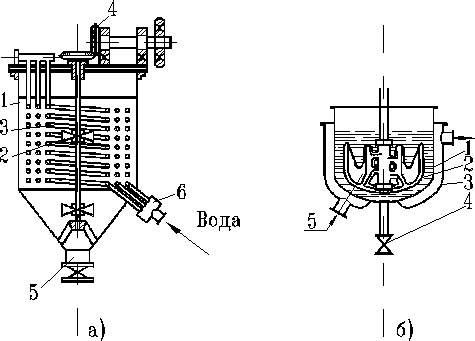
Рисунок 1 — Кристаллизаторы с водяным охлаждением.
а) со встроенным змеевиком: 1 — корпус; 2 — змеевик; 3 — мешалка; 4 — привод; 5 — разгрузочное устройство; 6 — штуцера для ввода и вывода охлаждающей воды; б) с охлаждающей рубашкой: 1 — корпус; 2 — мешалка; 3 — охлаждающая рубашка; 4 — разгрузочное устройство; 5 — штуцер для подачи охлаждающей воды.
В таких аппаратах может проходить как периодический, так и непрерывный процесс кристаллизации.
В непрерывно действующем аппарате отвод маточного раствора осуществляется сверху. Верхняя часть аппарата выполняется кони ческой, чтобы уменьшить скорость движения раствора, циркулирующим под действием мешалки, и, следовательно, уменьшить опасность уноса мелких кристаллов с маточным раствором. Кристаллы выводятся через нижний штуцер.
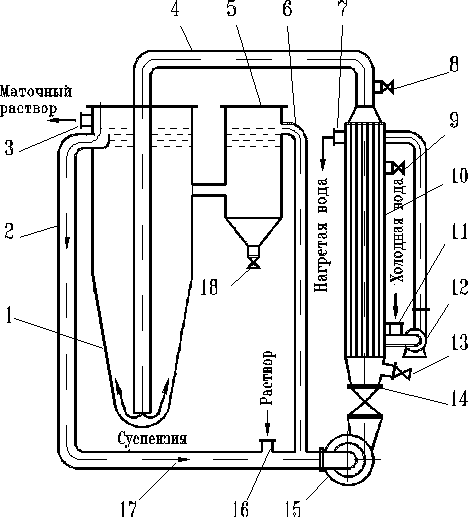
Рисунок 2 — Изогидрический кристаллизатор с взвешенным слоем.
- корпус;
- 2, 4 — трубы;
- 3 — штуцер для отвода маточника;
- 5 — отстойник мелкой соли;
- 6 — трубопровод;
- 7 — штуцер для отвода нагретой воды;
- 8, 9, 13 — краны;
- 10 — теплообменник;
- 11 — штуцер для ввода охлаждающей воды;
- 12 — насос;
- 14 — вентиль;
- 15 — циркуляционный насос;
- 16 — штуцер для подачи горячего концентрированного раствора;
- 17, 18 — штуцеры.
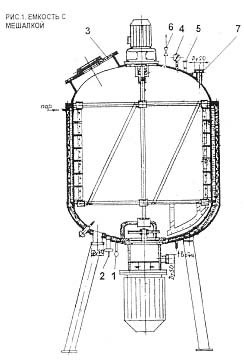
Рисунок 3. Вакуумный кристаллизатор
Вакуумный кристаллизатор представлен аппаратом с мешалкой.
Горизонтальный кристаллизатор (3) отличается наличием нескольких последовательных ступеней в общем кожухе. По сравнению с одноступенчатым вертикальным кристаллизатором с мешалкой горизонтальный кристаллизатор данного типа имеет несколько преимуществ, главное из которых — меньшие инвестиционные расходы. Кристаллизатор с циркуляционной трубой (2) использует вместо мешалки циркуляционный насос, что позволяет непосредственно регулировать пресыщение, т.е. более эффективно предотвратить первичное образование зародышей. Такие аппараты применяются для производства продуктов, кристаллизующихся медленнее и имеющих меньший диапазон метастабильности. Кристаллизатор с принудительной циркуляцией (4) работает аналогично кристаллизатору с циркуляционной трубой. Регулируемый поток суспензии прокачивается осевым насосом через внешний теплообменник. Этот тип кристаллизатора может также применяться для вакуумной кристаллизации (5).
В суспензионных кристаллизаторах постоянная плотность суспензии поддерживается регулированием массового расхода. Единственный способ повысить плотность (например, для быстрейшего снятия пересыщения)- удалять осветленный раствор из кристаллизатора. Такую возможность открывает батарея кристаллизаторов с циркуляционной трубой и перегородкой. Осторожное перекачивание суспензии, раздельное удаление мелочи и осветленного раствора и классификация позволяют получать более крупные кристаллы. В кристаллизаторах этого типа производятся такие продукты как сульфат аммония, хлорид калия или мочевина, со средним размером частиц выше 1,5 мм.
Еще более крупные кристаллы можно получить только на кристаллизаторах с псевдоожиженным слоем. «Oslo» — наиболее известный тип таких аппаратов. В настоящее время существует два варианта этого типа кристаллизаторов. Первый из них, известный как «Krystal» , имеет определенный функциональный недостаток. Инкрустация может вызывать быструю закупорку кольцевой щели, ведущей в псевдоожиженный слой. Такой кристаллизатор необходимо останавливать для промывки. Более современный тип «MESSO» разработан специально для кристаллизации веществ, склонных к инкрустации, и в нем такая проблема не возникает. Направление потока в выпарной секции изменено: перегретый раствор из теплообменника проходит через коническую часть испарителя, прежде чем достигает поверхности, где испаряется и пересыщается. Это устраняет инкрустацию стенок выпарной секции, и аппарат может работать безостановочно в течение многих недель.[2,512-522]
1.3 Xарактеристика сырья
Таблица 1- Общие сведения
|
Общие |
|
|
Систематическое наименование |
Магния сульфат |
|
Традиционные названия |
Гептагидрат |
|
Химическая формула |
MgSO |
|
Молярная масса |
56г/моль |
|
Физические свойства |
|
|
Плотность |
2,66г/см3 |
|
Химические свойства |
|
|
pKa |
|
|
Растворимость в воде |
33,7г/100 мл |
|
Структура |
|
|
Координационная геометрия |
Октаэдрическая |
|
Кристаллическая |
Гексагональная |
|
Классификация |
|
|
Рег.номер CAS |
7487-88-9 |
|
RTECS |
ОМ4500000 |
МАГНИЯ СУЛЬФАТ (Magnesii sulfas).
Синонимы: Горькая соль, Magnesium sulfuricum, Sal amarum.
Бесцветные призматические кристаллы, выветривающиеся на воздухе, легко растворимы в воде (1:1 в холодной и З, З:1 в кипящей); практически нерастворимы в спирте. Водные растворы имеют горько-соленый вкус.
Растворы для инъекций (рН 6, 2 — 8, 0) стерилизуют при +100 ‘С в течение 30 мин, при +120 ‘С в течение 8 мин.
Магния сульфат оказывает многогранное влияние на организм. При приеме внутрь он плохо всасывается, действует как слабительное средство, подобно натрия сульфату, и оказывает также желчегонное действие, что связано с рефлексами, возникающими при раздражении нервных окончаний слизистой оболочки двенадцатиперстной кишки.
Одной из особенностей магния сульфата является его угнетающее влияние на нервно-мышечную передачу. При парентеральном введении, особенно в больших дозах, он может оказать курареподобное действие.
Антагонистами иона магния являются ионы кальция. Уменьшение содержания кальция в крови сопровождается усилением действия магния. Соли кальция используют как антидоты при отравлении магния сульфатом.
Используют магния сульфат в качестве слабительного и желчегонного средства, а иногда — успокаивающего, спазмолитического и противосудорожного. Как наркотическое средство не применяется вследствие малой широты действия (наркотические дозы легко вызывают паралич дыхательного центра), однако может применяться для усиления действия наркотиков и аналгетиков.
Магния сульфат применяют также в качестве антидота. При отравлении растворимыми солями бария промывают желудок 1 % раствором магния сульфата или дают внутрь 20 — 25 г в стакане воды (для образования неядовитого бария сульфата).
При отравлениях ртутью, мышьяком, тетраэтилсвинцом вводят внутривенно (5 — 10 мл 5 — 10 % раствора).
Парентерально магния сульфат применяют с осторожностью, учитывая возможность угнетения дыхания. В вену растворы вводят медленно. При угнетении дыхания вводят в вену кальция хлорид (5 — 10 мл 10 % раствора), дают вдыхать кислород или карбоген, проводят искусственную вентиляцию легких.
Формы выпуска: порошок; 20 % или 25 % раствор в ампулах по 5; 10 и 20 мл.
4 Конструкция аппарата
Кристаллизация — один из распространенных и наиболее эффективных методов получения веществ в чистом виде. Допустим, величина примесей определяется назначением продукта. Степень его чистоты зависит как от условий самой кристаллизации, так и от дальнейших технологических операций (фильтрование, промывка и др.).
Основные загрязнения кристаллов обусловлены наличием в исходном растворе нежелательных примесей. Они могут попасть внутрь кристалла с маточным раствором в виде включений (в трещинах, дефектных полостях и др.) или адсорбироваться гранями кристалла. Изоморфные примеси могут образовывать смешанные кристаллы.
Борьбу с загрязнениями кристаллов ведут механической (отстаивание, фильтрование) и химической обработкой исходного раствора, например, осаждают растворенные соли железа, сернистые соединения, хлориды и пр.
Пресыщение раствора иногда приводит к снижению растворимости примесей и их выпадению из раствора. Чем меньше размеры кристалла, тем относительно больше на его поверхности остается маточного раствора, менее чистого, чем сам кристалл. Степень чистоты кристаллов повышается при промывке. Для получения особо чистых кристаллов их подвергают перекристаллизации. Остатки влаги обычно удаляют из кристаллов путем сушки, доводя их влажность до состояния, близкого к равновесному.
Устройство кристаллизаторов. По принципу действия различают следующие типы промышленных кристаллизаторов. Кристаллизаторы с охлаждением раствора. Простейшие кристаллизаторы периодического действия с охлаждением раствора представляют собой цилиндрические вертикальные аппараты с охлаждающими змеевиками (рубашками) и механическими мешалками для перемешивания раствора. С целью увеличения времени пребывания раствора в установке эти аппараты часто соединяют последовательно, располагая каскадом.[2, 512- 522]
Продукт, получаемый в результате кристаллизации, представляет собой сыпучую массу кристаллов различного размера. Внешняя геометрическая форма кристаллов специфична для каждого вещества. Характерной особенностью кристаллического строения вещества является строго определенное, периодически повторяющееся в трех измерениях расположение ионов, атомов или молекул, образующих кристаллическую решетку. Следствием внутренней упорядоченности структуры кристаллов является анизотропность различных физических свойств: механических, оптических, электрических, магнитных и других.
В основу классификации кристаллов положена их симметрия, известно 32 вида симметрии кристаллов. Для удобства они сгруппированы в 7 кристаллографических форм, или сингонии(кубическая, тригональная, тетрагональная, гексагональная, ромбическая, моноклинная, ттриклинная), и 3 категории — высокую (к которой относится первая форма), среднюю (три следующих формы) и низкую (три последующих формы).
Ряд веществ, чаще всего химически однотипных, имеющих подобную кристаллическую решетку и при кристаллизации из растворов выделяющихся совместно, образуют смешанные кристаллы. Такие вещества называют изоморфными.
В зависимости от условий кристаллизации (температуры, давления и др.), одно и то же вещество может образовывать разные по симметрии и форме кристаллы, называемые полиморфными разновидностями или модификация. Кристаллизацию можно осуществить различными способами:
- путем охлаждения растворов, расплавов и паров (при кристаллизации из водных растворов этот способ называют изогидрической кристаллизацией);
- путем удаления из растворов части растворителя;
- высаливанием;
- в результате химической реакции.
В промышленности применяют в основном первые два способа. Процессы, кристаллизации, осуществляемые этими двумя способами, изображены на диаграмме растворимости.
Исходный раствор определяется точкой А. Линия АВС изображает процесс изогидрической кристаллизации охлаждением, а линия АНI- методом удаления части растворителя. В первом случае движущая сила процесса определяется отрезком D`С, во втором- HI. В случае кристаллизации комбинированным способом рабочая линия процесса изображается отрезком ADE, а движущая сила — отрезком D`E.
При кристаллизации высаливанием пересыщение в растворе может создаваться путем добавления в систему какого либо вещества, снижающего растворимость основного вещества в растворителе. Добавляемое вещество называют высаливанием.
В качестве примера можно привести процесс кристаллизации хлороксида циркония. В результате химической реакции получают раствор хлороксида циркония в воде. К полученному раствору добавляют соляную кислоту, при этом растворимость хлороксида циркония снижается, и он выпадает из раствора в виду кристаллов.
Иногда в результате химической реакции исходный раствор становится пересыщенным по отношению к продукту реакции.
Примером может служить процесс извлечения аммиака из коксовых газов путем перевода его в сульфат аммония в результате взаимодействия коксовых газов с серной кислотой. При этом сульфат аммония выпадает в виде кристаллов. Этот способ называют кристаллизацией в результате химической реакции.
Процесс кристаллизации состоит из двух последовательных стадий: образование зародышей кристаллов и рост кристаллов. Образование зародышей кристаллов происходит в пересыщенных растворах, когда пересыщение достигает определенной величины. Разность между концентрацией раствора, при которой начинают образовываться зародыши, и концентрацией насыщенного раствора называют максимальным пересыщением.
Механизм образования зародышей можно представить следующим образом. Молекулы растворенного вещества непрерывно сталкиваются между собой, образуя ассоциаты. Вероятность образования ассоциатов из определенного числа молекул уменьшается с увеличением числа молекул. Растворимость кристаллов увеличивается с уменьшением их размера. Очень мелкие кристаллы растворяются даже в пересыщенных растворах. Таким образом, для каждого пересыщения существует минимальный размер кристалла, обеспечивающий устойчивость его при данном пересыщении и равновесие с раствором. Кристаллы, имеющие размер меньше этого минимального, или критического, будут растворяться, а кристаллы, имеющие размер больше критического, будут расти.
После возникновения в пересыщенном растворе зародышей кристаллов с размерами, большими критических, на их поверхности начинает отлагаться кристаллизуемое вещество. Линейная скорость роста кристалла в направлении нормали к грани кристалла, является основной характеристикой этой второй стадии процесса кристаллизации.
В настоящее время наибольшее распространение получила диффузионная теория роста кристаллов. Эта теория основана на предположении, что вещество осаждается на кристаллической грани со скоростью, пропорциональной разности концентраций кристаллизуемого вещества непосредственно у грани кристалла и в основной массе раствора. Процесс роста кристаллов в этом случае считают состоящим из двух стадий: переноса молекул кристаллизуемого вещества к поверхности кристаллов и встраивания молекул в кристаллическую решетку. При этом возможны при варианта протекания процесса.
Диффузионная теория не объясняет всех особенностей роста кристаллов, в частности, их огранку плоскостями.
Кроме того, экспериментально доказано, что зависимость между скоростью роста и пересыщением в большинстве случаев не линейна.
На кинетику процесса кристаллизации влияет большое число факторов, из которых основными являются: пересыщение, температура, интенсивность перемешивания. Количественный эффект воздействия того или иного фактора определяется экспериментально для конкретной системы.
На гранях кристалла происходит одновременное образование и разрастание нескольких плоских зародышей. При этом новые слои возникают раньше, чем предыдущие полностью покроют всю грань. В результате появляются полости, включающие маточный раствор. Чем больше размер кристалла и чем больше пересыщение, тем больше вероятность несовершенного роста. Кроме того, при высоких пересыщениях возможен так называемый «блочный» рост кристаллов, т.е. рост за счет присоединения целых групп определенным образом ориентированных молекул или ионов, а также трехмерных зародышей и мелких кристаллов. В результате структура граней оказывается особенно несовершенной.
С ростом температуры увеличивается скорость образования зародышей, что объясняется, в первую очередь, уменьшением критического размера зародыша и, следовательно, увеличением вероятности образования ассоциатов критического размера.
Кроме того, с повышением температуры уменьшается удельная поверхностная энергия образования кристаллов, а также уменьшается гидратация ионов (в случае кристаллизации из водных растворов), что облегчает их объединение в зародыши.
С повышением температуры увеличивается скорость роста кристаллов. Если лимитирующий стадией является стадия подвода вещества к поверхности кристалла, то с ростом температуры увеличивается коэффициент диффузии и уменьшается вязкость. Если скорость процесса определяется скоростью поверхностной реакции, то уменьшение критического размера двухмерного зародыша с ростом температуры также приводит к увеличению скорости процесса.
Перемешивание, ультразвуковые колебания и другие механические воздействия резко увеличивают скорость образования кристаллических зародышей. В настоящее время нет общепризнанной теории, объясняющей этот факт. Однако можно предположить, что увеличение интенсивности перемешивания и различные механические воздействия вызывают более частые столкновения молекул и тем самым увеличивают вероятность образования зародышей критического размера. На стадии роста кристаллов перемешивание оказывает влияние на скорость процесса только в том случае, если лимитирующий стадией является подвод вещества к поверхности кристалла, т.е. если процесс протекает в диффузионной области. Тогда с увеличением интенсивности перемешивания возрастает скорость конвективной диффузии, что приводит к увеличению скорости роста кристаллов.
2.
РАСЧЕТНАЯ ЧАСТЬ
1 Конструктивный расчет
Общие данные:
Раствор: MgSO4, где= 5500 кг/ч
а1 = 0,23
t1 = 55
t2 = 20
Определение концентрации маточного раствора и давления в аппарате при t2= 20ºC.
Растворимость MgSO4 при 20ºC равна17,2. Средняя теплоемкость вещества в интервале от 60 до 20ºC равна 4,18Дж/кг. Скрытая теплота кристаллизации равна 159,84 Дж/кг. Охлаждающая вода поступает в рубанку при температуре равной 18ºC, нагревается в кристаллизаторе до 23 ≈ 25ºC.
Концентрация соли в маточном растворе (в массовых долях) составляет:
a2═ 17,2 =0,14
Молекулярный вес MgSO4 =159,61г/моль
Молекулярный вес MgSO4 * 2H2O = 250г/моль, следовательно
Кm = 159.61 = 0.64
1. Определяем количество кристаллизующего раствора при заданной производительности
Gp= Gkp * (Km * a2)
1-a2
Где Vp — действие с водяной рубашкой и мешалкой от 1≈3 [3.576]
- Для нахождения теплового баланса находим Gkp, следовательно потом найдем Q.
Gkp = 0.15-0.14 = 0.01 *1.0*360=4.4
- 0.14 0.86
Gkp = _____0.64-0.14________= 179 кг.
,15-0,14+0,008*0,14
2 Расчет теплового баланса
3. Из теплового баланса определяем количество отдаваемого тепла:
Q = Km * C1* (tk1 — tn1)+ Km * Gkp -0.008*2417.63= 0.64*3.6*(55-20)+0.64*4.4-0.008*2417.63=70.5
где, 2417,63 (577 ккал/кг) теплота преобразования теплоты при средней температуре [4.272]
4. По Δ tср лог определяем по уравнению.
tср = (tн1 + tk1) ,
tср = (20+55)= 37.5 ºC
Δ tср лог= Δtн — Δtk1 ,
ln * Δtн/ Δtk
Δ tср лог = (55-25) — (20-18) = 35-2 = __33 = 33 = 9.54 ≈10 ºC
Ln( 55-25)/(20-18) ln(37/2) ln(35/2) 2.86
2.3 Материальные расчеты
Определяем поверхность теплообмена по уравнению:
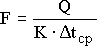
Где, К=205 коэффициент теплоотдачи
Для шнековых кристаллизаторов и других типов кристаллизаторов с шириной корыта 600 мм на 1 м длины аппарата теплопередающая поверхность составляет 0,9 м2.Требуемая длина кристаллизатора в этом случае будет равна: [5, 194-210]
t= 28.6=34м
,9
Так как кристаллизатор с ближайшей большей поверхностью F=37 м 2
то принимаем к установке два последовательно соединенных вакуум — шнековых кристаллизатора с поверхностью теплообмена 17 м2, каждый из них длиной 12 м, собирается из четырех секций. [5, 194-210]
- Расход охлаждающей воды составляет:
Gв = ______Q_____ ,
С2* (t2k — t2H)
Gв = ___75500___ = 9 кг/см 324 (кг/ч).
*(20-18)
Где, 4190- теплоемкость воды Дж/кг*град[2.822]
3. Вопросы техники безопасности при эксплуатации кристаллизационной установки с учетом окружающей среды
1 Общее действие высокой температуры окружающей среды — перегревание и тепловой удар
Процессы жизнедеятельности происходят в организме человека при условии сохранения постоянной температуры его тела около 36,5ºC, которая может колебаться без ущерба для здоровья в небольших пределах.
Постоянная температура тела поддерживается теплорегуляцией, посредством рефлекторных механизмов, обеспечивающих необходимое соотношение процессов теплообразования и теплоотдачи в организме в зависимости от температуры окружающей среды. Важную роль играет центральная нервная система. Тепло в организме образуется за счет происходящих в нем химических процессов (обмена веществ), отдача тепла происходит различными путями, главным образом через кожу. Возможности теплорегуляции путем уменьшения или увеличения теплообразования и теплоотдачи ограничены и могут длительно осуществляться только в определенном диапазоне температуры окружающей среды. Поэтому длительное пребывание человека в условиях высокой температуры окружающей среды ведет к общему перегреванию организма, резким проявлением которого является тепловой удар. Он нередко возникает при работе в условиях высокой температуры воздуха в помещениях, а также во время длительных маршей и переходов, особенно плотными колоннами.
При температуре воздуха выше 33º теплорегуляция осуществляется повышенной теплоотдачей за счет испарения пота. Интенсивность этого процесса зависит от температуры, влажности и скорости движения воздуха.
Повышенная влажность усиливает, а движение воздуха ослабляет вредное действие на организм высокой температуры.
Поэтому температура воздуха, которая может привести к перегреванию, не имеет абсолютного значения и колеблется в зависимости от продолжительности воздействия, влажности и скорости движения воздуха.
Организм человека в состоянии осуществлять теплорегуляцию, если температура окружающего воздуха не превышает 45º. При влиянии неблагоприятных факторов внешней среды эта способность утрачивается уже при более низкой температуре и наступает перегревание организма.
Например, при относительной влажности 85% перегревание может наступить при температуре 30-31º. Перегреванию способствует также мышечная работа, которая сопровождается усиленным образованием тепла в организме, и плотная одежда. При переутомлении, заболеваниях (сердечно — сосудистых, ожирении, расстройствах функции щитовидной железы), алкоголизме, в пожилом и раннем детском возрасте устойчивость организма к перегреванию снижена. Сказываются и индивидуальные особенности организма, поскольку при одних и тех же условиях внешней среды у разных лиц интенсивность потоотделения не одинаковая.
Имеет значение также продолжительность воздействия. Повышение температуры тела до 40º в течение небольшого срока обычно не сопровождается резкими нарушениями функций организма. Пострадавшие жалуются на общую слабость, головную боль, сухость во рту, жажду. Более длительное перегревание резко нарушает деятельность важнейших органов и систем организма, вызывая тепловой удар. При этом температура тела повышается до 40-41º и выше. Расстраивается деятельность центральной нервной системы, происходит или угнетение ее (головная боль, сонливость, апатия), или же возбуждение. Отмечаются расстройство речи, бред, затемненное сознание, иногда судороги (причем температура тела может быть повышена незначительно).
Нарушение деятельности сердечно- сосудистой системы ведет к учащению пульса и падению артериального давления, кожа краснеет, в некоторых случаях наблюдается посинение губ, носовое кровотечение. Дыхание учащается. В результате потери большого количества жидкости с потом происходит сгущение крови. В крови накапливаются продукты распада белков, в моче появляются белок и эритроциты. Нередко возникают рвота и понос. В дальнейшем при длительном перегревании появляются бледность и сухость кожи, которая на ощупь становится холодной, заостряются черты лица, под глазами возникают темные круги, температура тела падает ниже нормы, человек впадает в полусонное состояние, резко падает сердечная и дыхательная деятельность и наступает смерть.
В одних случаях симптомы теплового удара развиваются постепенно, в других — тяжелое состояние может наступить внезапно.
Если перегревание организма своевременно прекращено и пострадавшему оказана медицинская помощь, тепловой удар заканчивается выздоровлением. При несвоевременно принятых мерах выздоровление иногда затягивается, отмечаются неврозы и психозы. В редких случаях тяжелое перегревание может привести к смерти (в течение нескольких часов), что служит поводом для производства судебно-медицинского исследования трупа.
При вскрытии трупа каких-либо характерных изменений не обнаруживается. Отмечаются полнокровие внутренних органов, точечные кровоизлияния на поверхности сердца и легких, полнокровие и отек головного мозга и его оболочек, скопление слизи в дыхательных путях, может быть отек легких, расширение полостей сердца, т.е. такие изменения, которые встречаются и при иных причинах смерти. Поэтому на основании одной морфологической картины нельзя установить диагноз смерти от теплового удара.
Эксперту необходимы также сведения о развитии симптомов заболевания, предшествовавших смерти, об обстоятельствах происшествия и о физических факторах окружающей среды.
Солнечный удар в отличие от теплового возникает не вследствие высокой температуры окружающей среды и общего перегревания тела, а от действия прямых солнечных лучей на непокрытую голову и шею, что приводит к местному перегреву, поражающему центральную нервную систему. Поэтому солнечный удар может возникать без предварительно общего перегревания организма и выраженного нарушения теплорегуляции.
Клинические проявления солнечного и теплового удара сходны. В солнечную, жаркую погоду возможно комбинированное вредное действие солнечных лучей и высокой температуры окружающей среды на организм.
Солнечный удар в очень редких тяжелых случаях может привести к смертельному исходу, причем на вскрытии наблюдают те же изменения, что и при тепловом ударе.
2 Правила, техника безопасности и обслуживание оборудования
Кристаллизатор должен находится под наблюдением эксплуатационного персонала. Периодичность осмотров и проверок устанавливается местными инструкциями в соответствии с требованиями «Правил устройства и безопасной эксплуатации сосудов, работающих под давлением».
Эффективность работы теплообменов контролируется по нагреву сетевой воды. Степень загрязнения контролируется по перепаду давления в теплообменнике. Периодичность и способы чистки теплообменника устанавливается местными инструкциями в соответствии с требованиями «Правил устройства и безопасной эксплуатации сосудов, работающих под давлением».
Кристаллизатор должен подвергаться техническому освидетельствованию после монтажа, до пуска в работу, периодически в процессе эксплуатации и в необходимых случаях — внеочередному освидетельствованию.
Наружный и частичный внутренний осмотр (конструкция корпуса неразъемная и внутреннему осмотру не подлежит) должен проводится не реже одного раза в 2 года.
Перед внутренним осмотром и гидравлическим испытанием теплообменник остановить, охладить, слить воду, отключить заглушками от всех трубопроводов, соединяющих теплообменник с источником давления или другими сосудами.
Гидравлическое испытание теплообменника проводить в собранном виде в следующей последовательности: сначала полость трубной системы, затем полость корпуса пробным давлением, указанным в чертеже и паспорте кристаллизатора.
Эксплуатационные требования:
Эксплуатироваться кристаллизатор ГОСТ 11909-66 должен в соответствии с «Правилами технической эксплуатации электрических станций и сетей РФ», «Правилами устройства и безопасной эксплуатации сосудов, работающих под давлением» и «Правилами техники безопасности при эксплуатации тепломеханического оборудования электростанций и тепловых сетей».
Для получения наибольшего экономического эффекта при эксплуатации кристаллизатора необходимо:
- Поддерживать в чистоте поверхности нагрева кристаллизатора;
- Следить за удалением воздуха и других неконденсирующихся газов из него;
- Обеспечивать оптимальные расходы сетевой и греющей воды.
Качество сетевой воды должно удовлетворять требованиям действующих правил технической эксплуатации электрических станций и сетей РК.
При работе кристаллизатора разность температур между грающей и сетевой водой не должна превышать 55ºC. [5,194-210]
3.3 Охрана окружающей среды и экология
Охрана природы — система мер, направленных на поддержание рационального взаимодействия между человеком и окружающей природной средой, обеспечивающая сохранение и восстановление природных богатств, разумное использование природных ресурсов, предупреждающая прямое и косвенное вредное влияние результатов деятельности общества на природу. В процессе развития общества задачи охраны природы менялись. В течение многих веков человек получал в природе средства к существованию и отдавал в нее то, что могли использовать другие организмы. Задачи охраны окружающей среды ограничились преимущественно вопросами сохранения заповедных территорий, увеличения численности вымирающих ценных животных и растений, борьбой с браконьерством.
В целом задачи направлены на экологизацию производства, которая позволит обеспечить полное и комплексное использование природных ресурсов, сырья и материалов, снизит вредное влияние на окружающую среду отходов промышленности. Необходимо в связи с этим шире внедрять малоотходные и безотходные технологические процессы.
Необходимо продолжать последовательно улучшать охрану водных ресурсов и атмосферного воздуха и в этих целях также совершенствовать технологические процессы, связанные с работой очистных сооружений, улучшать качество сырья и топлива. Нужно снижать потери полезных ископаемых при их добыче, обогащении и переработке, наладить комплексное использование минеральных ресурсов и охрану недр. Эти задачи не снимают и поставленных ранее в области охраны окружающей природной среды, в частности усиление работ по охране, воспроизводству и рациональному использованию растительного и животного мира, расширению сети заповедников, благоустройству зеленых зон городов. Для решения поставленных задач необходимо активнее внедрять имеющиеся в экологии научно- технические достижения, разрабатывать новые фундаментальные основы экологии как теоретической основы для осуществления мер по охране природы. Широкое развитие в области охраны природы получило международное сотрудничество. Существует две формы такого сотрудничества: межгосударственное соглашения и конвенции по вопросам охраны окружающей среды и национального использования природных ресурсов; участие в деятельности международных природоохранных организаций.
Экология как наука имеет длительный предварительный этап накопления сведений об органическом мире и природных условиях на Земле. История развития представлений о биосфере отражает изменение взглядов на природу, непосредственно окружающую человека.
Проблема загрязнения природной среды становится столь острой как из-за роста объемов промышленного и сельскохозяйственного производства, так и в связи с качественным изменением производства под влиянием научно-технического прогресса.
Многие металлы и сплавы, которыми пользуется человек, неизвестны природе в чистом виде, и, хотя они в какой-то мере подвластны утилизации и вторичному употреблению, часть их рассеивается, накапливаясь в биосфере в виде отходов. Проблема загрязнения природной среды в полный рост встала после того, как в XX в. человек существенно расширил количество используемых им металлов, стал изготавливать синтетические волокна, пластмассы и другие вещества, имеющие свойства, не только не известные природе, но вредные для организмов биосферы. Эти вещества (количество и разнообразие которых постоянно растет) после их использования не поступают в природный кругооборот. Отходы производственной деятельности все больше загрязняют литосферу, гидросферу и атмосферу Земли. Адаптационные механизмы биосферы не могут справиться с нейтрализацией увеличивающегося количества вредных для ее нормального функционирования веществ, и естественные системы начинают разрушаться.
Загрязнение литосферы.
Почвенный покров Земли представляет собой важнейший компонент биосферы. Именно почвенная оболочка определяет многие процессы, происходящие в биосфере.
Несовершенство сельскохозяйственных приемов приводит к быстрому истощению почв, а применение крайне вредных, но дешевых ядохимикатов для борьбы с вредителями растений и в целях повышения урожайности усугубляет эту проблему. Не менее важной проблемой является экстенсивное использование пастбищ, превращающее в пустыни огромные участки земли.
Загрязнение гидросферы.
Водная среда — это воды суши (реки, озера, водохранилища, пруды, каналы), Мировой океан, ледники, подземные воды <http://geoinfoed.ru/ekoland/240-perenos-vlagi-v-podzemnoj-chasti-geosistemy.html >, содержащие природно-техногенные и техногенные образования. Которые, испытывая воздействие экзогенных, эндогенных и техногенных сил, влияют на здоровье человека, его хозяйственную деятельность <http://geoinfoed.ru/geo3/115-osobennosti-sovremennogo-ekonomicheskogo-i-socialnogo.html > и все остальное живое и неживое на Земле. Вода, обеспечивая существование всего живого на планете, входит в состав основных средств производства материальных благ.
Ухудшается качество воды в закрытых водоемах. Озеро Байкал загрязняется промышленными стоками Байкальского целлюлозно-бумажного завода, Селенгильского целлюлозно-картонного комбината и предприятий Улан-Удэ.
Загрязнение атмосферы.
Человек загрязняет атмосферу уже тысячелетиями. В последние годы местами отличается сильное загрязнение воздуха, связанное с расширением очагов промышленности, с технизацией многих областей нашей жизни, успешной моторизации
Загрязнение окружающей среды
Под загрязнением окружающей среды понимают нежелательное изменение ее свойств в результате антропогенного поступления веществ и соединений. Основной источник загрязнения — это возвращение в природу массы отходов, которые образуются в процессе производства и потребления человека. При этом следует различать количественное и качественное загрязнение. Количественное загрязнение окружающей среды возникает в результате возвращения в нее тех веществ и соединений, которые встречаются в природе в естественном состоянии, но в гораздно меньших количествах. Качественное загрязнение связано с поступлением в нее неизвестных природе веществ и соединений, создаваемых в первую очередь промышленностью органического синтеза.
Загрязнение окружающей среды включает:
- загрязнение литосферы, которое происходит в результате строительства и горных выработок, а также за счет промышленных, сельскохозяйственных и бытовых отходов;
- загрязнение гидросферы, которое происходит в результате сброса отходов в моря и реки;
- загрязнение атмосферы, которое происходит в результате сгорания минерального топлива.
Существует три пути решения природоохранительных проблем:
- создание очистных сооружений;
- разработка природоохранительных технологий;
- В результате роста загрязнения окружающей среды началось массовое движение в защиту природы.
В настоящее время разработаны международные программы защиты окружающей среды. В системе ООН существует специальная программа по охране окружающей среды ЮНЕП, которая объединяет все страны.
Список использованной литературы.
[Электронный ресурс]//URL: https://inzhpro.ru/kursovaya/kristallizator/
1.Послание президента Назарбаева Н.А. 2012 . 29 с.
- Основы общей химии, т.3, Б.В. Некрасов. — М.: Химия, 1970. 195с.
- Плановский А.Н.
Процессы и аппараты химической промышленности, М.: Химия. 1967-842с.
- Кувшинский М.Н. Соболева А.П. Курсовое проектирование по предмету «Процессы и аппараты химической промышленности», М.: высшая школа. 1980-223с.
- Плановский А.Н.
,Николаев П.И. Процессы и аппараты химической и нефте- химической технологии М.: Химия. 1987- 496с.
- Романков П.Г., Курочкина М.И. Примеры и задачи по курсу «Процессы и аппараты химической промышленности» Л.: Химия. 1984- 229с.
- Романков П.Г., Курочкина М.И.
Расчетные диаграммы и номограммы по курсу «Процессы и аппараты химической промышленности» Учебное пособие для техникумов Л.: Химия. 1985-7л.
- Павков К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов. Л.: Химия,1987, 576 с.
- Основные процессы и аппараты химической технологии: Пособие по проектированию.
Под ред. Ю. И. Дытнерского. М.: Химия, 1983, 38, 272 с.
- Кристаллизация из растворов химической промышленности Л. Н. Матусевич. М.: Химия 1968, 194-210 с.
