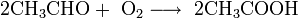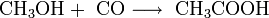1. История
Уксус является продуктом брожения вина и известен человеку с незапамятных времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии. [1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)).
Andreas Libavius
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту. [2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго. [1] [3]
2. Физические свойства
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров [4] .
Медь реферат по геологии
... хлороводородом при 500—600 °C: С бромоводородом: Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода: Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов: Окисляется ... F m3m, a = 0,36150 нм, Z = 4. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра, удельная проводимость при 20 °C ...
Абсолютная уксусная кислота называется ледяной , ибо при замерзании образует льдовидную массу (см. изображение справа).
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования Δf G0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования Δf S0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл : 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | t кип , °C | массовая доля уксусной кислоты |
|---|---|---|
| четыреххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
-
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
- Уксусная кислота образует тройные азеотропные смеси
3. Получение
- Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3 COO)2 при температуре 50-60 °С:
2 CH 3 CHO + O2 → 2 CH3 COOH
3.1. В промышленности
3.1.1. Окислительные методы
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана [5] .
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола [5] .
3.1.2. Каталитическое карбонилирование метанола
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода [6] , которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. [7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. [8] [9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты. [10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
3.1.3. Биохимический способ производства
При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта [11] .
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением [12] :
- СН 3 СН2 ОН + О2 → СН3 СООН + Н2 О
4. Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.

В результате диссоциации уксусной кислоты образуется ацетат-ион CH 3 COO− и протон H+ . Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями. [13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Mg(тв) + 2CH 3 COOH → (CH3 COO)2 Mg + H2
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
CH 3 COOH + Cl2 → CH2 ClCOOH + HCl
Этим путем могут быть получены также дихлоруксусная (CCl 2 COOH) и трихлоруксусная (CCl3 COOH) кислоты.
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
5. Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260 ) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона).
Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
6. Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³. [4]
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. [4] Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[14] .
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена [15] . Смертельная доза составляет примерно 20 мл.
Примечания
- ↑ 1 2 3 Martin Geoffrey Industrial and Manufacturing Chemistry. — Part 1, Organic. — London: Crosby Lockwood, 1917. — P. pp. 330–31.
- Goldwhite, Harold (September 2003).
«Short summary of the career of the German organic chemist, Hermann Kolbe — membership.acs.org/N/NewHaven/bulletins/Bulletin_2003-09.pdf » (PDF).
New Haven Section Bull. Am. Chem. Soc. 20 (3).
- Schweppe, Helmut (1979).
«Identification of dyes on old textiles — aic.stanford.edu/jaic/articles/jaic19-01-003_1.html ». J. Am. Inst. Conservation 19 (1/3): pp. 14–23. DOI:10.2307/3179569 — dx.doi.org/10.2307/3179569.
- ↑ 1 2 3 Уксусная кислота — www.chemport.ru/chemical_substance_858.html
- ↑ 1 2 3 Реутов О.А. Органическая химия. — М .: Изд-во МГУ, 1999. — Т. 4.
- Advances in Organometallic Chemistry — books.google.com/books?id=elXhfl482OAC&lpg=PA255&ots=4XJCp-S2hj&dq=Acetic acid production Monsanto&lr=&hl=uk&pg=PA255#v=onepage&q=Acetic acid production Monsanto&f=false
- Acetic Acid Production and Manufacturing Process — www.icis.com/v2/chemicals/9074780/acetic-acid/process.html
- U.S. Patent 3769329 — patft.uspto.gov/netacgi/nph-Parser?patentnumber=3769329 — www.pat2pdf.org/pat2pdf/foo.pl?number=3769329 (англ.)
- Патент США — www.google.com/patents?id=0JsyAAAAEBAJ&zoom=4&dq=Acetic acid production Monsanto&pg=PA2#v=onepage&q=Acetic acid production Monsanto&f=false
- Экологический фактор, или Окружающая среда как стимул эволюции промышленной химии — www.chem.msu.su/rus/journals/chemlife/env.html
- Кандидат биологических наук Н. Кустова Уксус. Что это такое и как его делают — wsyachina.narod.ru/technology/vinegar.html . Интернет-ресурс «Всякая всячина».
- Биотехнология органических кислот и белковых препаратов: Учебное пособие — window.edu.ru/window_catalog/redir?id=56750&file=muratova-r.pdf
- Jones, R.E.; Templeton, D.H. (1958).
«The crystal structure of acetic acid». Acta Crystallogr. 11 (7): pp. 484–87. DOI:10.1107/S0365110X58001341 — dx.doi.org/10.1107/S0365110X58001341.
- Уксусная кислота : Медицинский портал Eurolab — www.eurolab.ua/encyclopedia/urgent.medica.aid/342/2469/
- www.textra-vita.com/technology Глава 17. Уксусная кислота 7. Токсиколого-гигиеническая оценка — www.textra-vita.com/technology/konserv17.php
Данный реферат составлен на основе .