Органическая химия — наука, изучающая органические соединения, а также законы их превращений.[1] Органические соединения — химические соединения, содержащие химический элемент углерод.[2] Одним из классов органических соединений являются карбоновые кислоты.
Карбоновые кислоты – это кислородсодержащие органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.[3] Карбоксильная группа — COOH — функциональная группа карбоновых кислот — состоит из карбонильной группы и связанной с ней гидроксильной группы.[4]
По числу карбоксильных групп карбоновые кислоты подразделяются на монокарбоновые, или одноосновные (одна группа —СООН), дикарбоновые, или двухосновные (две группы —СООН) и т.д. В зависимости от строения углеводородного радикала, карбоновые кислоты могут быть алифатическими (например, CH 3 COOH), алициклическими (циклогексанкарбоновая кислота C 6 H 11 COOH) или ароматическими (бензойная кислота C 6 H 5 COOH).[5]
Кроме того, карбоновые кислоты можно классифицировать по числу атомов углерода (низшие, средние, высшие) и по наличию в них предельных и не предельных связей (предельные и непредельные).
Примеры карбоновых кислот.
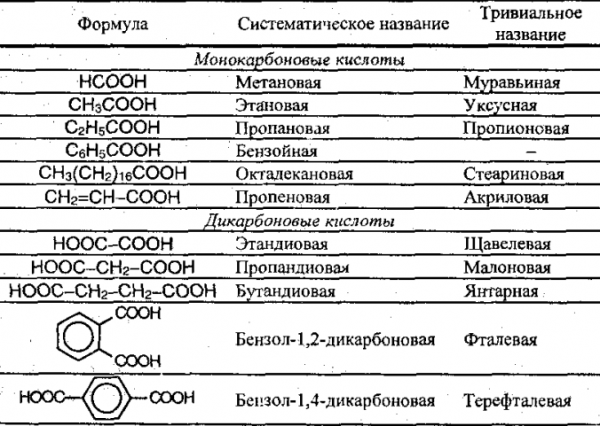
Рисунок 1
Номенклатура
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота.
Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы.
Технология синтеза эфира карбоновых кислот
... жидкой фазе, газофазная этерификация карбоновых кислот спиртами является экзотермической и имеет более высокую константу равновесия, зависящую от температуры. Так, при получении этилацетата в газовой фазе ... на этом заканчивается. Но в более жестких условиях выделившаяся кислота этерифицирует спирт, причем используются обе ацильные группы ангидрида: (CH3CO)2O + ROH → CH3COOR + CH3COOH 2CH3COOR + ...
Например, соединение с разветвленной углеродной цепью (CH3)2CH-CH2-COOH называется 3-метилбутановая кислота.
Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения.
Для многоосновных кислот применяют суффиксы -диовая, -триовая и т.д.
Например:
-
HOOC-COOH — этандиовая (щавелевая) кислота
-
HOOC-CH2-COOH — пропандиовая (малоновая) кислота
Если атом углерода карбоксильной группы не входит в состав главной углеродной цепи (например, цикла), название кислоты строят из названия этой структуры, суффикса –карбоновая и слова кислота. Так, систематическое название бензойной кислоты С6Н5СООН – бензолкарбоновая кислота.[6]
История открытия
Уксусная кислота знакома людям с древности. Получение при сухой перегонке древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли — винного камня (гидротартрат калия).
Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году Якоб Берцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля. [7]
Общие способы получения карбоновых кислот
1. Окисление альдегидов. R-COH + [O] → R-COOH
2. Окисление спиртов. R-CH2-OH + 2[O]
3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода. [11]

Физические свойства
Карбоновые кислоты, благодаря карбоксильной группе, полярны и могут участвовать в образовании межмолекулярных водородных связей. Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4) в воде и спирте. Высшие кислоты в воде растворяются плохо. Хорошо растворяются в этиловом спирте и диэтиловом эфире. Это связано с гидрофобными свойствами УВ-радикала в кислоте: чем больше масса радикала, тем меньше кислота растворима в воде.
Низшие кислоты – бесцветные, резко пахнущие жидкости, начиная с пентановой (валериановой) кислоты – маслянистые жидкости, высшие кислоты — твердые вещества без вкуса и запаха.
Для карбоновых кислот характерна межмолекулярная ассоциация. Так, жидкие карбоновые кислоты, например, уксусная кислота, существуют в виде димеров. В водных растворах димеры распадаются на мономеры.[8]
Химические свойства
Карбоксильная группа полярная, вследствие этого карбоновые кислоты проявляют общие свойства, характерные для всех слабых неорганических кислот. Реакции протекают по так называемому кислотному центру.[8]
Хлеб химической промышленности. серная кислота хлеб химической промышленности
... Это очень важный химический продукт, используемый по всему миру. Например, Великобритания в год производит более одного миллиона тонн серной кислоты. Серную кислоту получают путем сжигания ... Он может быть разбавлен водой до серной кислоты нужной концентрации. Применение. Серная кислота – важнейший продуктхимической промышленности. Она находит примерение в производстве минеральныхудобрений, волокон, ...
Строение
Карбоксильная группа планарна, длина связи C=O в различных кислотах составляет 0,118-0,126 нм, связи C-O — 0,121-0,137 нм — наблюдается выравнивание длин связей углерод-кислород при диссоциации. Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118—122,5°. Дипольный момент карбоксильной группы составляет ~5,4·10−30 Кл·м. При диссоциации образуется стабилизированный сопряжением анион. В нём обе связи C-O равноценны и составляют 0,127-0,129 нм.[9]
Длина водородной связи в димере 0,26 нм.[10]
Применение
Муравьиная кислота используется в качестве протравы шерсти и кожи перед крашением, в промышленности — в качестве сильного восстановителя. Применяется в медицине в виде раствора под названием «муравьиный спирт». Из муравьиной кислоты получают сложные эфиры.
Уксусная кислота используется для производства искусственного шёлка, пластмасс, красителей, лекарств (аспирина).
Используется в качестве растворителя при крашении тканей, в кожевенном производстве, лакокрасочной промышленности. Является отличным консервантом, поэтому применяется для консервирования пищевых продуктов. Из уксусной кислоты получают гербициды для борьбы с сорняками. Эфиры уксусной кислоты входят в состав фруктовых эссенций.
Высшие (жирные) карбоновые кислоты используются для производства мыла, основу которого составляют натриевые или калиевые соли этих кислот (стеараты C 17 H 35 COONa, пальмиаты C 15 H 31 COONa, олеаты C 17 H 33 COONa и другие).
ЗАКЛЮЧЕНИЕ
Таким образом, карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН. Карбоновые кислоты часто встречаются в природе. Они содержатся в растениях, играют важную роль в обмене веществ животных и человека.
Карбоновые кислоты имеют обширный спектр получения и применения.
Задолго до того, как органическая химия сформировалась как самостоятельная теоретическая дисциплина, наши предки были знакомы с органическими веществами. Карбоновые кислоты нашли широкое применение во всех сферах человеческой жизни. Их используют в медицине, косметологии, пищевой промышленности, сельском хозяйстве и для бытовых нужд.
Технология изготовления и контроль качества лекарственных форм, ...
... организациях (аптеках)» [2]. Объект исследования: Технология изготовления и внутриаптечный контроль качества лекарственных форм содержащих витамины. Предмет исследования: Лекарственные ... В последнее время на фармацевтическом рынке России появилось множество ... При поступлении в организм рибофлавин взаимодействует с аденозинтрифосфорной кислотой и образует флавин-мононуклеотид и флавинаденин-динуклеотид. ...
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ
[1] http://www.chemport.ru/data/chemipedia/article_2627.html
[2] Научно-технический словарь
[3] https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass—tretij-god-obucenia/urok-no37-odnoosnovnye-predelnye-karbonovye-kisloty-stroenie-molekul-izomeria-i-nomenklatura
[4] http://www.yaklass.ru/materiali?mode=lsntheme&themeid=142
[5] Н.Е.Кузъменко, В.В.Еремин, В.А.Попков. Химия. Для школьников старших классов и поступающих в вузы. М.: Дрофа, 1995 — 527 с.
[6] http://orgchem.ru/chem4/o42.htm
[7] Аксёнова М., Леенсон И. Химия. Энциклопедия для детей. — Аванта+, 2007 — 357-359 с.
[8] https://foxford.ru/wiki/himiya/himicheskie-svoystva-karbonovyh-kislot
[9] Шабаров Ю.С. Органическая химия. — Лань, 2011
[10] Иоффе Д. В. Карбоновые кислоты // Химическая энциклопедия / Редкол.: Кнунянц И. Л. (гл. ред.) и др. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 326—328
[11]
