Открытие метода полимеразной цепной реакции (ПЦР) стало одним из наиболее выдающихся событий в области молекулярной биологии за последние десятилетия. Это позволило поднять медицинскую диагностику на качественно новый уровень. Принцип метода полимеразной цепной реакции был разработан Кэрри Мюллисом в 1983 году. За разработку ПЦР-анализа К.Мюллис в 1993 году был удостоен Нобелевской премии в области химии.
После открытия ПЦР она была очень быстро внедрена в практику. Метод стал настолько популярен, что сегодня уже трудно представить работу в области молекулярной биологии без его использования. Особенно бурное развитие метод ПЦР получил благодаря международной программе «Геном человека». Были созданы современные лазерные технологии секвенирования (расшифровки нуклеотидных последовательностей ДНК).
Если в недавнем прошлом для расшифровки последовательности ДНК размером в 250 пар нуклеотидов (п.н.) требовалась неделя, то современные лазерные секвенаторы позволяют определять до 5000 п.н. в день. Это в свою очередь способствует значительному росту информационных баз данных, содержащих последовательности ДНК. В настоящее время предложены различные модификации ПЦР, показана возможность создания тест-систем для обнаружения микроорганизмов, выявления точечных мутаций, описаны десятки возможных применений метода.
Появление метода ПЦР было обусловлено определенными достижениями в области молекулярной генетики, прежде всего расшифровкой нуклеотидной последовательности геномов ряда микроорганизмов. Следует отметить, что этому открытию сопутствовало развитие некоторых технологий. В частности, появление приборов, позволяющих автоматически синтезировать одноцепочечные фрагменты ДНК (олигонуклеотиды).
В тот же период были обнаружены уникальные микроорганизмы, живущие в гейзерах. Их ферментативная система, в частности ДНК-полимераза, выдерживает высокие температуры горячих источников и сохраняет свою биологическую активность вплоть до 95°С, что является необходимым условием для проведения полимеразной цепной реакции.
Полимеразная цепная реакция в настоящее время является наиболее совершенным диагностическим методом молекулярной биологии, молекулярной генетики и клинической лабораторной диагностики, позволяющим выявлять в тканях и биологических жидкостях организма единичные клетки возбудителей многих инфекционных заболеваний.
Алканы. Особенности строения. Методы синтеза. Реакции
... В результате крекинга высшие алканы превращаются в алканы и алкены с меньшим молекулярным весом; таким образом, ... крупнотоннажного производства. Полученные из нефти смеси алканов и других углеводородов применяются в качестве моторного топлива ... нм) соответственно. Такая структура этана полностью подтверждена методом дифракции электронов и спектральными исследованиями; соответствующие измерения ...
В основе метода ПЦР лежит комплиментарное достраивание участка геномной ДНК или РНК возбудителя, осуществляемое in vitrо с помощью фермента термостабильной ДНК-полимеразы. Специфичность метода определяется уникальностью генетического материала выявляемых инфекционных агентов, к которому подобраны олигонуклеотидные праймеры, участвующие в процессе амплификации.
Диагностика инфекционных заболеваний, в том числе вызванных трудно культивируемыми агентами, генотипирование микроорганизмов, оценка их вирулентности, определение устойчивости микрофлоры к антибиотикам, пренатальная диагностика, биологический контроль препаратов крови — вот неполный перечень направлений медицины с применением ПЦР. На сегодняшний день ПЦР-анализ остается наиболее распространенной и динамично развивающейся технологией. Ежегодно на рынке появляются десятки новых тест-систем для ПЦР-анализа, предназначенных как для выявления нуклеотидных последовательностей различных микроорганизмов — возбудителей заболеваний, так и для исследования генов человека. Себестоимость ПЦР-анализа неуклонно снижается, что способствует все более широкому использованию метода в лечебных и диагностических учреждениях. Количество ПЦР-лабораторий в странах СНГ растет в геометрической прогрессии и, видимо, в ближайшее время ПЦР-анализ станет одним из самых распространенных методов лабораторной диагностики.
1. ПРИНЦИП МЕТОДА ПЦР
Полимеразная цепная реакция — это метод, имитирующий естественную репликацию ДНК и позволяющий обнаружить единственную специфическую молекулу ДНК в присутствии миллионов других молекул.
Суть метода заключается в многократном копировании (амплификации) в пробирке определенных участков ДНК в процессе повторяющихся температурных циклов. На каждом цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-полимеразой. Благодаря этому происходит многократное увеличение количества специфических фрагментов ДНК, что значительно упрощает дальнейший анализ.
В основе метода ПЦР лежит природный процесс — комплементарное достраивание ДНК матрицы, осуществляемое с помощью фермента ДНК-полимеразы. Эта реакция носит название репликации ДНК.
Естественная репликация ДНК включает в себя несколько стадий:
- Денатурация ДНК (расплетение двойной спирали, расхождение нитей ДНК);
- Образование коротких двухцепочечных участков ДНК (затравок, необходимых для инициации синтеза ДНК);
Синтез новой цепи ДНК (комплементарное
Данный процесс можно использовать для получения копий коротких участков ДНК, специфичных для конкретных микроорганизмов, т.е. осуществлять целенаправленный поиск таких специфических участков, что и является целью генодиагностики для выявления возбудителей инфекционных заболеваний.
Thermisaquaticus
Комплементарное достраивание цепи начинается не в любой точке последовательности ДНК, а только в определенных стартовых блоках — коротких двунитевых участках. При присоединении таких блоков к специфическим участкам ДНК можно направить процесс синтеза новой цепи только в этом участке, а не по всей длине ДНК цепи. Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные затравки (20 нуклеотидных пар), называемые праймерами. Праймеры комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК протекает только между ними.
Технический анализ на рынке ценных бумаг. Основные методы технического ...
... задачи: выявление сущности технического анализа; обозначить принципы технического анализа; характеристика основных методов технического анализа; применение методов технического анализа на практике. В качестве информационной базы при выполнении курсового проекта использовались как общие книги по рынку ценных бумаг, так и специализированная ...
Таким образом, ПЦР представляет собой многократное увеличение числа копий (амплификация) специфического участка ДНК катализируемое ферментом ДНК- полимеразой.
СТАДИИ ПРОВЕДЕНИЯ ПЦР-АНАЛИЗА
Методика проведения анализа с использованием метода ПЦР включает три этапа:
1. Выделение ДНК (РНК) из клинического образца;
2. Амплификация специфических фрагментов ДНК;, . Детекция продуктов амплификации., . Выделение ДНК (РНК)
На данной стадии проведения анализа клиническая проба подвергается специальной обработке, в результате которой происходит лизис клеточного материала, удаление белковых и полисахаридных фракций, и получение раствора ДНК или РНК, свободной от ингибиторов и готовой для дальнейшей амплификации. Выбор методики выделения ДНК (РНК) в основном определяется характером обрабатываемого клинического материала.
2.Амплификация специфических фрагментов ДНК
На данной стадии происходит накопление коротких специфических фрагментов ДНК в количестве, необходимом для их дальнейшей детекции.
Для проведения полимеразной цепной реакции необходимо наличие в реакционной смеси ряда компонентов:
— Праймеры — искусственно синтезированные олигонуклеотиды, имеющие, как правило, размер от 15 до 30 п.н., идентичные соответствующим участкам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции амплификации. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы.
Taq-полимераза
Смесь дезоксинуклеотидтрифосфатов (дНТФ)
- Буфер — смесь катионов и анионов в определенной концентрации, обеспечивающих оптимальные условия для реакции, а также стабильное значение рН.
Анализируемый образец
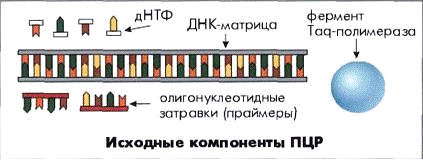
Рис.1 Компоненты реакционной смеси
Каждый цикл амплификации включает 3 этапа, протекающих в различных температурных режима:
Денатурация ДНК
Одна из цепей (+) используется в качестве основной матрицы. Ее пять штрих-концов фиксируются ферментом ДНК-полимеразой, что обеспечивает построение из отдельных нуклеотидов второй цепи ДНК, комплиментарной первой. То же самое, только в обратном направлении, происходит и на второй нити ДНК, однако, поскольку расплетение молекулы ДНК идет в обратном порядке, новая цепь строится небольшими фрагментами, которые затем сшиваются. Для того чтобы фермент ДНК-полимераза начал свою работу, требуется наличие затравки или праймера — небольшого одноцепочечного фрагмента ДНК, который, соединяясь с комплиментарным участком одной из цепей родительской ДНК, образует стартовый блок для наращивания дочерней нити.
Присоединение праймеров (отжиг).
Поскольку наращивание дочерних нитей ДНК может идти одновременно на обеих цепях материнской ДНК, то для работы ДНК-полимеразы на второй цепи тоже требуется свой праймер. Таким образом, в реакционную смесь вносятся два праймера. Фактически праймеры, присоединившись к противоположным цепям молекулы ДНК, ограничивают собой тот ее участок, который будет в дальнейшем многократно удвоен или амплифицирован. Такие фрагменты ДНК называются ампликонами. Длина ампликона может составлять несколько сот нуклеотидов. Меняя пару праймеров, мы можем переходить от анализа одного возбудителя к анализу другого.
Полициклические ароматические углеводороды: проведение контроля ...
... физико-химического и биологического анализов служат подспорьем в оценке состояния и динамических характеристик природных экосистем. Актуальность ГЛАВА 1. ПОЛИЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (ПАУ) Среди ... масс некоторых соединений, различающихся строением и токсичностью. В высокоэффективной жидкостной хроматографии (ВЭЖХ) используются главным образом два типа детекторов: флуориметрический ...
Время отжига -20-60 сек.
Достраивание цепей ДНК (элонгация).
Механизм копирования таков, что комплементарное достраивание нитей может начаться не в любой точке последовательности ДНК, а только в определенных стартовых блоках (коротких двунитевых участках).
Для создания стартовых блоков в заданных участках ДНК используют затравки, представляющие собой олигонуклеотиды длиной около 20 п.н., также называемые праймерами. Они комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента и ориентированы таким образом, что синтез ДНК, осуществляемый ДНК-полимеразой, протекает только между ними.
Комплементарное достраивание цепей ДНК идет в направлении от 5`-конца к 3`-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служит вносимый дезоксирибонуклеотидфосфат. Этот процесс катализируется ферментом Tag-полимеразой. Образовавшиеся в первом цикле синтеза новые ДНК служат исходным материалом для второго цикла, в котором происходит образование искомого специфического фрагмента ДНК (ампликона) и т.д.
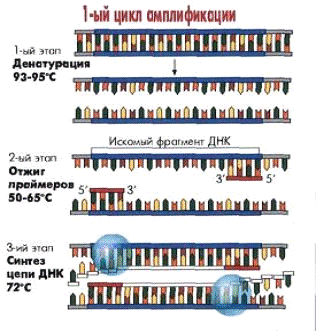
Рис.2 Принцип амплификации ДНК
В настоящее время применяется несколько способов подготовки образца для проведения ПЦР. Процедура подготовки пробы включает лизис микроба и экстракцию нуклеиновой кислоты. С целью разрушения микробной клетки используют простое кипячение, замораживание-оттаивание в присутствии лизоцима, а также специальные лизирующие буферы, содержащие детергенты и протеиназу. Выбор метода, как правило, диктуется природой микроба, точнее, природой его клеточной стенки. Стандартной и ставшей уже классической считается методика получения чистого препарата ДНК, описанная В.R.Marmionetal. (1993).
Она включает ферментативный протеолиз с последующей депротеинизацией и осаждением ДНК спиртом. Этот метод позволяет получить чистый препарат ДНК, однако он довольно трудоемок и предполагает работу с такими агрессивными и имеющими резкий запах веществами, как фенол и хлороформ.
Одним из наиболее популярных является метод выделения ДНК, предложенный R.Boometal. (1990), основанный на использовании для лизиса клеток сильного лизирующего агента — гуанидинатиоционата (GuSCN) и последующей сорбции ДНК на носителе (стеклянные бусы, диатомовая земля, стеклянное «молоко» и т.д.).
После отмывок в пробе остается ДНК, сорбированная на носителе, с которого она легко снимается с помощью элюирующего буфера. Метод удобен, технологичен и пригоден для подготовки образца к амплификации. Однако возможны потери ДНК вследствие необратимой сорбции на носителе, а также в процессе многочисленных отмывок. Особенно большое значение это имеет при работе с небольшими количествами ДНК в образце. Кроме того, даже следовые количества GuSCN могут ингибировать ПЦР, поэтому при использовании этого метода очень важен правильный выбор сорбента и тщательное соблюдение технологических нюансов. Следует отметить, что из-за большого числа стадий добавления и удаления растворов при работе с образцом требуется аккуратность, поскольку возможна перекрестная контаминация между пробами и образующимся аэрозолем ДНК.
Общий белок, его значение и методы определения
... в фракцию γ-глобулинов, и в крови появляются патологические протеины — парапротеины, которые выявляют при электрофорезе. Для ... функцию (гормоны, ферменты и другие биологически активные белковые вещества). Клинико-диагностическое значение Нормопротеинемия – нормальное содержание ... стрессорной реакции и воспалительных процессов при перечисленных видах патологии. - Бета - 7.3 – 13.0 (β-фракция содержит ...
При классической процедуре фенольно-хлороформной экстракции ДНК достигается хорошая очистка ДНК, в первую очередь от ингибиторов Tag-полимеразы, но неизбежны большие потери нуклеиновой кислоты, особенно заметные при работе с образцами небольшого объема с низкой концентрацией инфекционного агента.
Другая группа методов пробоподготовки основана на использовании ионообменников типа Chilex (США), которые, в отличие от стекла, сорбируют не ДНК, а примеси, мешающие реакции. Как правило, эта технология включает две стадии: кипячение образца и сорбция примесей на ионообменнике. Метод чрезвычайно привлекателен простотой исполнения. В большинстве случаев он пригоден для работы с клиническим материалом. К сожалению, иногда встречаются образцы с такими примесями, которые невозможно удалить с помощью ионообменников. Кроме того, некоторые микроорганизмы не поддаются разрушению простым кипячением. В этих случаях необходимо введение дополнительных стадий обработки образца.
При массовом скрининге, когда важно получить статистические данные, возможно использование простых способов с применением детергентов или обработки биологического материала щелочами с последующей их нейтрализацией. В то же время использование подобных методов для клинической диагностики может приводить к ложноотрицательным результатам вследствие применения в реакционной смеси некачественного препарата ДНК. Таким образом, к выбору метода пробоподготовки следует относиться с пониманием целей проведения предполагаемых анализов.
Во время следующей процедуры — амплификации — образец, содержащий ДНК возбудителя, вносится в небольшую пробирку с компонентами, обеспечивающими протекание полимеразной реакции, два вида праймеров, два энзима (Таg-полимераза и N-урацил-гликолаза) и четыре вида нуклеотида A, Г, Ц, У. Для проведения полимеразной реакции используется специальное устройство (термоциклер или ДНК-амплификатор), позволяющее автоматически, по определенной программе изменять температурный режим реакционной смеси. В первом цикле осуществления ПЦР образец нагревается до температуры 94°С для разделения двух комплиментарных нитей ДНК. Затем температура снижается до 40-60°С, при которой праймеры присоединяются к единичной цепи ДНК, после чего температура вновь поднимается до 72°С, когда наиболее выражена активность полимеразы. Весь цикл с изменением температуры продолжается менее 3 минут.
Для правильной оценки результатов ПЦР важно понимать, что данный метод не является количественным. Теоретически продукты амплификации единичных молекул ДНК-мишени могут быть обнаружены с помощью электрофореза уже после 30-35 циклов. Однако на практике это выполняется лишь в случаях, когда реакция проходит в условиях, близких к идеальным, что встречается нечасто. Особенно большое влияние на эффективность амплификации оказывает степень чистоты препарата ДНК, т.е. наличие в реакционной смеси тех или иных ингибиторов, от которых избавиться в некоторых случаях бывает крайне сложно. Иногда из-за их присутствия не удается амплифицировать даже десятки тысяч молекул ДНК-мишени. Таким образом, прямая связь между исходным количеством ДНК-мишени и конечным количеством продуктов амплификации часто отсутствует.
Акустические и капиллярные методы контроля РЭСИ. Электролиз (пузырьковый метод)
... месторасположение дефектов в них не позволяют достигать требуемой чувствительности магнитопорошковым или ферромагнитным методами. Капиллярные методы подразделяются на четыре класса чувствительности (таблица ... методы. В их основе лежат различные способы, позволяющие визуализировать дефекты, реакциями у дефектных мест или декорированием. Рассмотрим, например, метод, основанный на реакциях ...
Для визуализации результатов амплификации используют различные методы. Наиболее распространенный на сегодняшний день — электрофорез, основанный на разделении молекул ДНК по размеру. Для этого готовят пластину агарозного геля, представляющего собой застывшую после расплавления в электрофорезном буфере агарозу в концентрации 1,5-2,5% с добавлением специального красителя ДНК, например бромистого этидия. Застывшая агароза образует пространственную решетку. При заливке с помощью гребенок в геле формируют специальные лунки, в которые в дальнейшем вносят продукты амплификации. Пластину геля помещают в аппарат для горизонтального гель-электрофореза и подключают источник постоянного напряжения. Отрицательно заряженная ДНК начинает двигаться в геле от минуса к плюсу. При этом более короткие молекулы ДНК движутся быстрее, чем длинные. На скорость движения ДНК в геле влияют концентрация агарозы, напряженность электрического поля, температура, состав электрофорезного буфера и, в меньшей степени, состав ДНК. Все молекулы одного размера движутся с одинаковой скоростью. Краситель встраивается (интеркалирует) плоскостными группами в молекулы ДНК. После окончания электрофореза, продолжающегося от 10 минут до 1 часа, гель помещают на фильтр трансиллюминатора, излучающего свет в ультрафиолетовом диапазоне (254 — 310 нм).
Энергия ультрафиолета, поглощаемая ДНК в области 260 нм, передается на краситель, заставляя его флуоресцировать в оранжево-красной области видимого спектра (590 нм).
В качестве «положительного контроля» используют стандарт ДНК искомого микроорганизма. Размер неспецифических ампликонов может быть как больше, так и меньше по сравнению с «положительным контролем». В худшем случае эти размеры могут совпадать и читаются в электрофорезе как положительные.
«Положительный контроль» позволяет удостовериться, что все компоненты, входящие в состав реакционной смеси, обеспечивают нормальное прохождение реакции. В то же время препарат ДНК, подготовленный для ПЦР из биологического материала, может содержать примеси ингибиторов, заметно снижающих эффективность реакции, а в некоторых случаях приводящих к отсутствию специфических ампликонов даже при наличии искомого возбудителя. Необходимо контролировать ход амплификации в каждой пробирке с реакционной смесью, для чего используют дополнительный, так называемый «внутренний контроль», который представляет собой любой стандарт ДНК, несхожий с ДНК искомого микроорганизма.
Для инфекционных тест-систем иногда, например, используют р-глобиновый ген, к концам которого с помощью генно-инженерных манипуляций пришивают участки ДНК, гомологичные праймерам, входящим в состав тест-системы. Если «внутренний контроль» внести в реакционную смесь, то он станет такой же мишенью для отжига праймеров, как и хромосомальная ДНК искомого возбудителя инфекции. Размер продукта амплификации внутреннего контроля подбирают таким образом, чтобы он был в 2 и более раз больше, чем ампликоны, образуемые от амплификации искомой ДНК микроорганизма. В результате, если внести ДНК «внутреннего контроля» в реакционную смесь вместе с испытуемым образцом, то, независимо от наличия микроорганизма в биологическом образце, «внутренний контроль» станет причиной образования специфических ампликонов, но значительно более длинных (тяжелых), чем ампликон микроорганизма. Наличие тяжелых ампликонов в реакционной смеси свидетельствует о нормальном прохождении реакции амплификации и отсутствии ингибиторов. Если ампликоны нужного размера и «внутреннего контроля» не образовались, можно сделать вывод о наличии в анализируемом образце нежелательных примесей, от которых следует избавиться, но не об отсутствии искомой ДНК.
Современные методы очистки сточных вод от ионов тяжелых металлов
... для доочистки от небольших количеств ионов тяжелых металлов из-за их отравляющего воздействия на микроорганизмы /53,54/. Механизм влияния тяжелых металлов на процессы биохимической очистки еще недостаточно изучен ... реагентов по сравнению с привычной известью /15/. Также известны методы, позволяющие удалить ионы тяжелых металлов путем связывания их в нерастворимые комплексы с последующим отделением ...
Несмотря на всю привлекательность такого подхода, у него есть существенный изъян. Так, если в реакционной смеси находится нужная ДНК, то эффективность ее амплификации резко снижается из-за конкуренции с «внутренним контролем» за праймеры. Это принципиально важно при низких концентрациях ДНК в исследуемом образце и может приводить к ложноотрицательным результатам. Тем не менее, при условии решения проблемы конкуренции за праймеры этот способ контроля эффективности амплификации, безусловно, будет весьма полезен.

Рис.3 Второй цикл амплификации ДНК
Детекция продуктов амплификации
- Метод горизонтального электрофореза
Одним из методов визуализации результатов амплификации является метод электрофореза, основанный на разделении молекул ДНК по размеру. В большинстве методик на данном этапе проводится разделение смеси продуктов амплификации, полученной на 2-ой стадии, методом горизонтального электрофореза в агарозном геле. До проведения электрофоретического разделения, к амплификационной смеси добавляется раствор бромистого этидия, образующий с двухцепочечными фрагментами ДНК прочные соединения внедрения. Эти соединения под действием УФ-облучения способны флуоресцировать, что регистрируется в виде светящихся полос после электрофоретического разделения амплификационной смеси в агарозном геле. Яркость полос продуктов амплификации может быть различной. Поэтому часто в ПЦР-лабораториях принято оценивать результат по трех-, четырех- или пятибалльной системе. Однако нельзя связывать с начальным количеством ДНК-мишени в образце. Часто уменьшение яркости свечения полос связано со снижением эффективности амплификации под влиянием ингибиторов или других факторов.

Рис.4 Детекция продуктов амплификации методом горизонтального электрофореза
- Метод вертикального электрофореза
Метод вертикального электрофореза принципиально схож с горизонтальным электрофорезом. Их отличие заключается в том, что в данном случае вместо агарозы используют полиакриламид. Его проводят в специальной камере для вертикального электрофореза. Электрофорез в полиакриламидном геле имеет большую разрешающую способность по сравнению с агарозным электрофорезом и позволяет различать молекулы ДНК разных размеров с точностью до одного нуклеотида. Приготовление полиакриламидного геля несколько сложнее агарозного. Кроме того, акриламид является токсичным веществом. Поскольку необходимость определить размер продукта амплификации с точностью до 1 нуклеотида возникает редко, то в рутинной работе этот метод не используют.
Ультразвуковая диагностика воспалительных заболеваний придатков матки (3)
... воспалительных форм заболеваний придатков матки удаётся только выделить с помощью трансвагинального ультразвукового сканирования. клиническую ... позволяет особого труда решить диагностическую являются. Не задачу исключением случаи однокамерного варианта ошибочно, гидросальпингса расцениваемого, независимо от способа сканирования, киста как яичника. Необходимость дифференциальной диагностики ...
3).
Метод гибридизационных зондов
В качестве альтернативы электрофоретическому методу детекции, имеющему некоторые недостатки: субъективность чтения результатов, ограничения по определению ДНК различных микроорганизмов в одной реакции, могут быть предложены гибридизационные схемы детекции. В этих схемах образующийся в результате амплификации фрагмент ДНК гибридизуется (образует 2-х цепочечные комплексы — «гибриды») со специфическим олигонуклеотидным зондом. Регистрация таких комплексов может быть проведена колориметрически или флуориметрически.
3. МЕТОД ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ (Real-Time PCR)
Метод Real-Time PCR позволяет проводить детекцию продуктов амплификации в процессе реакции и вести мониторинг кинетики накопления ампликонов. Для детекции PCR-продукта используются флуоресцентные красители, обеспечивающие флуоресценцию, прямо пропорциональную количеству ПЦР-продукта — репортерную флуоресценцию. Механизмы ее генерации различаются в зависимости от конкретного типа Real-Time PCR.
Кинетическая кривая в координатах «Уровень репортерной флуоресценции — цикл амплификации» имеет S-образную форму.
В ней можно выделить три стадии:
1. Стадию инициации (когда ПЦР-продукты еще не детектируется флуоресцентной меткой).
2. Экспоненциальную стадию (в которой наблюдается экспоненциальная зависимость количества флуоресценции от цикла ПЦР).
- Плато (стадию насыщения).
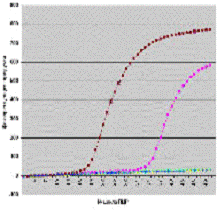
Рис.5 График кинетической кривой флуоресценции методом Real-Time PCR
Регистрация флуоресцентного сигнала проводится в процессе амплификации на специальном приборе — амплификаторе для Real-Time PCR. По нарастанию интенсивности флуоресцентного сигнала с помощью программного обеспечения, прилагаемого к амплификатору, вычисляется концентрация исходной матрицы ДНК.
Преимущества метода ПЦР в режиме реального времени
n возможность детекции накопления продуктов амплификации непосредственно во время проведения амплификации;
- n принципиальным преимуществом является возможность осуществления детекции накопления ампликонов без открытия пробирки, что минимизирует риск получения ложноположительных результатов из-за контаминации проб и реагентов продуктами амплификации;
- n существенное уменьшение количества манипуляций с исследуемым образцом сокращает затраты времени, упрощает анализ и позволяет снизить вероятность ошибок;
- n подобный подход позволяет отказаться от стадии электрофореза, что ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации;
- n снижение требований, предъявляемых к ПЦР лаборатории;
- n увеличение объективность интерпретации результатов ПЦР-исследования, поскольку обработка ведется с помощью программного обеспечения прибора;
- n значительно, практически в два раза, сокращается общее время исследования позволяя получить результат уже через 1.5 — 2 часа после поступления клинического материала в лабораторию;
- n данный метод впервые позволяет проводить количественную оценку содержания ДНК микроорганизма в клинической пробе;
- n применение наряду с праймерами гибридизационных зондов обеспечивает повышение специфичности анализа;
— n возможность независимой одновременной регистрации флуоресцентного сигнала от нескольких гибридизационных ДНК-зондов допускает выявление в одном исследовании нескольких различных участков одной или различных ДНК-мишеней.
Ультразвуковая диагностика заболеваний надпочечников
... П.В. Лучевая диагностика заболеваний надпочечников / / Мед. визуализация. М.: Видар, 1999. № 4 . С. 31-37. Рук. по ультразвуковой диагностике заболеваний органов брюшной ... методов наибольшее значение в диагностике опухолей надпочечника и забрюшинных параганглиев имеет пресакральный пневморетроперитонеум, особенно в сочетании с томографией и ретроградной пиелографией. Пневморетроперитонеум позволяет ...
ПРЕИМУЩЕСТВА МЕТОДА ПЦР
Непосредственное определение возбудителей инфекционных заболеваний
Метод ПЦР дает прямое указание на присутствие в забранном у пациента материале специфического фрагмента ДНК возбудителя.
Высокая специфичность ПЦР
Методом ПЦР в исследуемом материале выделяется фрагмент ДНК присущий только конкретному возбудителю — бактерии или вирусу. Данный участок ДНК уникален и не характерен ни для одной инфекции на земле. Специфичность задается нуклеотидной последовательностью праймеров, что исключает возможность получения ложных результатов, в отличие от метода иммуноферментного анализа, где нередки ошибки в связи с перекрестно-реагирующими антигенами.
Высокая чувствительность ПЦР
Метод ПЦР позволяет выявлять даже единичные клетки бактерий или вирусов. ПЦР-диагностика обнаруживает наличие возбудителей инфекционных заболеваний в тех случаях, когда другими методами (иммунологическими, бактериологическими, микроскопическими) это сделать невозможно. Чувствительность ПЦР-анализа составляет 10-1000 клеток в пробе (чувствительность иммунологических и микроскопических тестов — 103-105 клеток).
Универсальность ПЦР
Поскольку возбудитель может содержаться в любых биологических выделениях и тканях при ПЦР-исследовании может применяться практически любые материалы, в том числе недоступные для исследования другими методами — слизь, моча, кровь, сыворотка, мокрота, эякулят, соскоб эпителиальных клеток.
Высокая скорость получения результата ПЦР-анализа
Для проведения ПЦР-анализа не требуется выделение и выращивание культуры возбудителя, что занимает большое количество времени. Унифицированный метод обработки биоматериала и детекции продуктов реакции, и автоматизация процесса амплификации дают возможность провести полный анализ за 4-4.5 часа.
Возможность диагностики любого вида инфекции
Высокая чувствительность метода ПЦР позволяет диагностировать инфекцию не только на острой стадии заболевания, но и хронические инфекции и даже наличие единичных бактерий или вирусов.
В настоящее время преимущество ПЦР-анализа перед культуральным методом обнаружения микроорганизмов состоит в следующем:
— Более высокая частота обнаружения микроба, превышающая аналогичный показатель при использовании культурального метода, на 6-7%. Эти различия объясняются возможной гибелью микроба при хранении и транспортировке, тогда как ПЦР способна обнаруживать и нежизнеспособные формы микроорганизма.
- Время, необходимое для обнаружения возбудителя культуральным методом, составляет около 4 суток, тогда как использование ПЦР позволяет обнаружить микроб через 4-5 часов.
- Использование технологии ПЦР позволяет проводить определение возбудителей, например хламидий, в образцах, взятых неинвазивным путем, например в порциях мочи.
Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях.
Возможность проведения
Возможность выявления
Возможность определения
Данный метод сравним по трудоемкости с классическими методами (иммуноферментным, иммунофлуоресцентным и т.п.), но дает более достоверную диагностическую информацию, позволяя непосредственно обнаруживать ДНК или РНК инфекционного агента в клиническом материале. Поэтому метод ПЦР, наравне с культуральным методом, признается «золотым стандартом» для диагностики инфекционных заболеваний.
5. ОГРАНИЧЕНИЯ МЕТОДА ПЦР
Это налагает определенные требования при использовании ПЦР для контроля эффективности лечения. В общем случае подобный контроль должен проводиться спустя промежуток времени, в течение которого происходит полная элиминация возбудителя. Обычно этот интервал составляет 4-8 недель.
Возможность перекрестной реакции
Подбор праймеров происходит на основе существующих знаний о геноме данного и сходных микроорганизмов. Теоретически существует возможность присутствия такого же фрагмента и у других микроорганизмов, геном которых в настоящее время не расшифрован, и которые не были протестированы на возможность перекрестной реакции. Присутствие в пробе таких микроорганизмов может привести к ложноположительному результату анализа.
Изменчивость микроорганизмов
Хотя при конструировании тест-системы фрагмент генома, используемый для амплификации, выбирается из высоко консервативной области, изменчивость микроорганизмов может приводить к тому, что некоторые генотипы или штаммы исследуемого возбудителя могут приобретать мутации в амплифицируемом участке генома, и, таким образом, становиться неуловимыми данной тест-системой.
Последние два пункта важны для разработчиков ПЦР-диагностикумов. В настоящее время разработаны стандарты, регламентирующие объем испытаний (включая проверку на перекрестные реакции, а также тестирование известных штаммов определяемого возбудителя), которые должна выдержать тест-система, прежде чем она попадет на рынок.
6. ПРИМЕНЕНИЕ МЕТОДА ПЦР
полимеразный диагностика инфекционный заболевание
ПЦР используется во многих областях для проведения анализов и в научных экспериментах:
1. криминалистика
ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с места преступления — кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически — одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью электрофореза ДНК. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев.
2. установление отцовства
При анализе результатов электрофореза ДНК-фрагментов, амплифицированных с помощью ПЦР отец-ребенок-мать обнаруживается, что ребенок унаследует некоторые особенности генетического отпечатка обоих родителей, что дает уникальный отпечаток. Хотя «генетические отпечатки пальцев» уникальны (за исключением случая однояйцевых близнецов), родственные связи все же можно установить, сделав несколько таких отпечатков. Тот же метод можно применить, слегка модифицировав его, для установления эволюционного родства среди организмов.
3. медицинская диагностика
ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных и вирусных заболеваний. Нужный ген амплифицируют с помощью ПЦР с использованием соответствующих праймеров, а затем секвенируют для определения мутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы до того, как проявятся симптомы заболевания.
4. клонирование генов
Клонирование генов — это процесс выделения генов и, в результате генно-инженерных манипуляций, получения большого количества продукта данного гена. ПЦР используется для того, чтобы амплифицировать ген, который затем вставляется в вектор — фрагмент ДНК, переносящий чужеродный ген в тот же самый или другой, удобный для выращивания, организм. В качестве векторов используют, например, плазмиды или вирусную ДНК. Вставку генов в чужеродный организм обычно используют для получения продукта этого гена — РНК или, чаще всего, белка. Таким образом в промышленных количествах получают многие белки для использования в сельском хозяйстве, медицине и др.
5. секвенирование ДНК
В методе секвенирования с использованием меченых флуоресцентной меткой или радиоактивным изотопом дидезоксинуклеотидов ПЦР является неотъемлемой частью, так как именно в ходе полимеризации в цепь ДНК встраиваются производные нуклеотидов, меченые флуоресцентной или радиоактивной меткой. Это останавливает реакцию, позволяя определить положения специфических нуклеотидов после разделения синтезированных цепочек в геле.
6. мутагенез
В настоящее время ПЦР стала основным методом проведения мутагенеза (внесения изменений в нуклеотидную последовательность ДНК).
Использование ПЦР позволило упростить и ускорить процедуру проведения мутагенеза, а также сделать её более надёжной и воспроизводимой.
7. диагностика инфекционных заболеваний
Использование метода ПЦР для диагностики инфекционных заболеваний как бактериальной, так и вирусной природы имеет колоссальное значение для решения многих проблем микробиологии и эпидемиологии. Применение этого метода также способствует развитию фундаментальных исследований в области изучения хронических и малоизученных инфекционных заболеваний.
Наиболее рационально и эффективно применение ПЦР для обнаружения микроорганизмов, трудно культивируемых в лабораторных условиях, атипичных форм бактерий. К ним также относятся внутриклеточные паразиты и микроорганизмы, способные длительно персистировать в организме хозяина. Высокоспецифичная, чувствительная и быстрая диагностика многих тяжелых заболеваний способствует не только их эффективному лечению, но и предотвращению распространения инфекции.
8. диагностика вирусных заболеваний
Наиболее всесторонние преимущества ПЦР при диагностике вирусных заболеваний можно продемонстрировать, рассматривая инфекционный процесс, обусловленный вирусом гепатита С (ВГС).
Особую диагностическую ценность ПЦР для обнаружения этого вируса представляет по
отсутствие способа культивирования ВГС; 2) наборы для антигенной диагностики не существуют; 3) реакция образования антител к ВГС настолько замедлена, что диагноз во время острой фазы инфекции, как правило, поставить невозможно.
Поэтому в настоящее время становится общепризнанным использование технологии ПЦР для диагностики, контроля качества лечения и эпидемиологического анализа заболеваемости, обусловленной ВГС.
При этом только технология ПЦР позволяет решать следующие задачи: 1) проводить диагностику острой инфекции при позднем выявлении антител к ВГС; 2) осуществлять этиологическую диагностику хронического гепатита С у иммуносупрессированных пациентов; 3) оценивать эффективность противовирусной терапии; 4) выявлять виремию у доноров крови с нормальным уровнем аминотрансфераз; 5) определять возможную контаминацию препаратов крови; 6) оценивать широту распространения ВГС.
9. применение ПЦР в пульмонологии и фтизиатрии
Частой причиной атипичных пневмоний, рецидивирующих хронических бронхитов являются микоплазмы и хламидии. Диагностика этих возбудителей традиционными методами микроскопии и бакпосева неэффективна. ПЦР позволяет не только диагностировать хламидиозы и микоплазмозы, но и проводить видовую идентификацию возбудителя (С. pneumoniae, C. trachomatis, M. hominis, M. pneumoniae).
Использование метода ПЦР позволяет значительно улучшить раннюю диагностику туберкулеза. В настоящее время разработаны и появились на рынке ПЦР-наборы для определения устойчивости микобактерий к антибиотикам.
10. применение ПЦР в практике службы крови
Обследование донорской крови на гепатиты, сифилис, ВИЧ серологическим методами не исключает опасности использования инфицированной крови из-за наличия у этих заболеваний определенного серонегативного периода, который может составлять до нескольких недель с момента появления возбудителя в крови. Наиболее эффективным методом анализа крови на присутствие этих возбудителей является метод ПЦР.
11. применение ПЦР в неонатологии
Целый ряд микроорганизмов способны поражать плод во время беременности. Это цитомегаловирус, токсоплазмы, вирус герпеса, вирус краснухи, микоплазмы, хламидии и др. Использование серологических тестов для определения этих инфекций у новорожденных неэффективно, поскольку формирование иммунной системы у ребенка происходит в течение нескольких месяцев, и наличие инфекционного агента может не сопровождаться выработкой специфических антител. С другой стороны, в крови новорожденного длительное время могут присутствовать материнские антитела класса IgG, способные проникать через плацентарный барьер. Таким образом, наличие специфических IgG у ребенка в первые месяцы жизни не свидетельствует о присутствии возбудителя. Применение ПЦР-анализа значительно увеличивает возможности диагностики неонатальных инфекций, в том числе и на внутриутробном этапе.
12. применение ПЦР в урогинекологической практике
Среди инфекционных агентов, поражающих урогенитальный тракт в последнее время большое внимание уделяется возбудителям латентных и хронических инфекций — хламидиям, микоплазмам. Для заболеваний, вызываемых этими возбудителями, характерна стертость клинической симптоматики, хроническое течение, часто приводящее к поражению репродуктивных функций — невынашиванию беременности, бесплодию. Многочисленные исследования по изучению применения метода ПЦР для выявления Сhlamydiatrachomatis, Mycoplasmahominis, Mycoplasmagenitalium, Ureaplasmaurealiticum, проведенные в крупных клиниках разных странах, показали высокую эффективность данного метода. Признано, что по показателям чувствительности и оперативности ПЦР превосходит культуральный метод, принятый в качестве «золотого стандарта».
ЗАКЛЮЧЕНИЕ
Таким образом, технология ПЦР — мощный инструмент, обеспечивающий возможность изучения и диагностики хронических инфекционных процессов, экологии возбудителей инфекционных заболеваний. Метод ПЦР-диагностики дополняет уже существующие приемы микробиологической диагностики, качественно меняет методологию решения прикладных проблем медицинской микробиологии и эпидемиологии.
Учитывая вышесказанное, сформулируем направления исследований в инфекционной патологии, в решении которых ПЦР начинает играть ведущую роль.
- Диагностика хронических инфекционных состояний, обусловленных персистенцией бактерий или вирусов. Это наиболее очевидная область применения ПЦР в диагностических целях.
- ПЦР — незаменимый инструмент при идентификации и молекулярно-генетических исследованиях практически всех внутриклеточных и мембранных паразитов, таких как вирусы, риккетсии, хламидии, микоплазмы.
- ПЦР — наиболее эффективный метод для выявления и изучения возбудителей, которые, находясь в «некультивируемом» состоянии, способны там сохраняться, переживая неблагоприятные внешние условия.
- ПЦР позволяет проводить определение антибиотикорезистентности у медленно растущих и труднокультивируемых бактерий.
Перспективными направлениями практического использования ПЦР-диагностики являются:
- диагностика онкологических заболеваний;
- диагностика лейкемий и лимфом;
- диагностика рака молочной железы;
- диагностика других злокачественных заболеваний;
- ДНК-диагностика доброкачественных и злокачественных новообразований ограничивается небольшим, но все возрастающим числом сведений о генах, ассоциированных с этими заболеваниями;
- диагностика генетических заболеваний.
Диагностика генетических заболеваний может развиваться только вслед за проведением широких научных исследований генома человека. Однако медицинское сообщество уже осознало важность изучения генетической основы заболеваний, а также возможность диагностирования и начала лечения болезни до появления ее симптомов;
- идентификация личности: судебная медицина, криминалистика;
- трансплантация органов и тканей;
- определение отцовства. Эксперты оценивают это направление на рынке ДНК-диагностикумов как одно из наиболее крупных и быстрорастущих;
- диагностика патогенов в пище.
Суммируя все вышесказанное, сформулируем те направления исследований, в которых ПЦР начинает играть решающую роль:
- диагностика инфекционных заболеваний
- диагностика онкологических заболеваний
- диагностика генетических заболеваний
- идентификация личности
— диагностика патогенов в пище.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
[Электронный ресурс]//URL: https://inzhpro.ru/referat/ptsr-tehnologiya/
1. Костюк С.А., Кулага О.К., Хворик Д.Ф. Новые аспекты клинического применения полимеразной цепной реакции. — «Медицинские новости» <http://www.mednovosti.by/Journal.aspx?type=1>. — -№5. 2006 <http://www.mednovosti.by/journal.aspx?id=115>г.
— Бонецкий А., к.м.н. Таирова М.М., Кутукеев Т.С. Использование полимеразной цепной реакции в клинической практике. — Методические рекомендации, Бишкек. — 2003г.
— Порываев В.Д., Кандрушин Е.В. Особенности количественного анализа методом полимеразной цепной реакции в режиме реального времени. — «Новости «Вектор-Бест»». — N4(50).
— 2008г.
— Шибата Д.К. Полимеразная цепная реакция и молекулярно-генетический анализ биоптатов. В кн.: «Молекулярно-клиническая диагностика. Методы».- М., «Мир», 1999г. — с.395-425.
— Покровский В.В., Федоров Н.А., Шипулин Г.А., Безруков В.М. «Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения» — Утверждены Государственным комитет санэпиднадзора Российской Федерации 22 июня 1995г.
— Соловьева С.В., Гой Е.Г., Зигангирова Н.А // Клиническая лабораторная диагностика. — 2000. — №1. — С. 43-46.
— Скала Л.З. Современные аспекты клинической микробиологии. — М., 1999. — 323 с.
8. Херрингтон С., Макгли Дж. Молекулярная клиническая диагностика. Методы. — М.: Мед. книга, 1999. — 433 с.
