Алканы представляют собой бесцветные вещества, в обычных условиях газообразные или жидкие. Алканы с большим числом углеродных атомов являются твердыми веществам. Многие жидкие алканы имеют слабый характерный «бензиновый» запах. Алканы намного легче воды.
Основными источниками алканов служит нефть и сопутствующий ей природный газ. Гниение и миллионы лет геологических преобразований превратили сложные органические соединения, из которых состояли растения и животные, в смесь алканов, имеющих в своем составе от донного до 30-40 атомов углерода. Одновременно с алканами образовывались и циклоалканы, которые присутствуют в значительном количестве, например в калифорнийской нефти, и которые известны в нефтяной промышленности под названием нафтенов.
Природный газ содержит только более летучие алканы, т.е. алканы с низким молекулярным весом; в основном он состоит из метана и значительно меньших количеств этана, пропана и высших алканов.
Фракционной перегонкой нефти получают различные фракции; поскольку температура кипения зависит от молекулярного веса, перегонка приводит к грубому разделению алканов в зависимости от числа атомов углерода. Каждая фракция представляет собой очень сложную смесь алканов с различным числом атомов углерода, и каждый алкан представлен несколькими изомерами. Использование каждой фракции зависит главным образом от ее летучести или вязкости и очень мало от того, является ли она сложной смесью или чистым соединением.
Все нелетучие фракции используются в основном как топливо. Газовая фракция, как и природный газ, применяется в основном также как топливо. Бензин используется в двигателях внутреннего сгорания, работающих на летучем топливе, керосин — в тракторах и форсунках реактивных двигателей, а соляровое масло — в дизелях. Керосин и соляровое масло находят также применение как топливо.
Фракция смазочных масел часто содержит большие количества алканов с длинной цепью (С 20 — С24 ), которые имеют довольно высокие температуры плавления. Если они остаются в масле, то при холодной погоде они могут кристаллизоваться с образованием воскообразных твердых веществ. Чтобы предотвратить это, масло охлаждают и воск отделяют фильтрованием. После очистки получают твердый парафин (т. пл. 50-55ºС), который можно использовать для получения вазелина. Асфальт используют при строительстве крыш и дорог. Нефтяной кокс, получаемый из остатка от перегонки нефти, состоит из сложных углеводородов, в которых отношение углерод : водород велико; он находит применение как топливо, а также в производстве угольных электродов для электрохимической промышленности.
Основные виды жидких топлив из нефти и их характеристики
... наиболее летучее жидкое топочное топливо. Используется как компонент моторного топлива. Хороший керосин должен иметь ... фракций получают реактивные топлива. Фракционный состав реактивных топлив различных марок различается. 8. Топливо ... топливо сравнивается со смесью цетана – парафинового углеводорода с 16-ю атомами ... из основных причин повышения расхода топлива является более высокая вязкость топлива ...
Петролейный эфир и лигроин являются хорошими растворителями для многих малополярных органических соединений. Кроме того, некоторые петролейные фракции используют для синтеза других соединений. В результате крекинга высшие алканы превращаются в алканы и алкены с меньшим молекулярным весом; таким образом, повышается выход бензина. Кроме того, образующиеся при крекинге алкены служат важным сырьем для синтеза алифатических соединений в больших масштабах. В результате каталитического реформинга алканы и циклоалканы превращаются в ароматические углеводороды, используемые в качестве сырья для синтеза другого обширного класса органических соединений.
Алканы являются не только простым и относительно дешевым топливом, но и исходным сырьем для крупнотоннажного производства. Полученные из нефти смеси алканов и других углеводородов применяются в качестве моторного топлива для двигателей внутреннего сгорания и реактивных двигателей.
Строение метана
В молекуле метана каждый из четырех атомов водорода связан с атомом углерода ковалентной связью, т.е. за счет общей электронной пары. Если углерод связан с четырьмя другими атомами, его связывающие орбитали (sp 3 -орбитали, образующиеся в результате гибридизации одной s- и трех р-орбиталей) направлены к углам тетраэдра (рис. 1, а ). При таком тетраэдрическом расположении орбитали максимально удалены друг от друга. Для того чтобы перекрывание каждой из этих орбиталей со сферической орбиталью атома водорода было наиболее эффективно и образовывалась наиболее прочная связь, необходимо, чтобы ядро каждого атома водорода располагалось в углу такого тетраэдра (рис. 1, б).
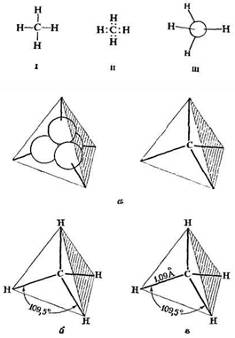
Рис. 1. − Молекула метана
а — тетраэдрические sp3 -орбитали;
- б — предполагаемая форма: ядра водорода расположены так, что возможно максимальное перекрывание;
в — форма и размеры
Тетраэдрическая структура метана доказана методом дифракции электронов (рис. 1, в) — методом, который позволяет установить расположение атомов в таких простых молекулах. Ниже будут рассмотрены некоторые данные, на основании которых химики приняли тетраэдрическое строение атома углерода гораздо раньше, чем стали известны квантовая механика и метод дифракции электронов.
В формуле метана черточкой обычно обозначают каждую пару электронов, общую для углерода и водорода (I).
В тех случаях, когда хотят сконцентрировать внимание на индивидуальной паре электронов, ее иногда обозначают двумя точками (II).
И наконец, если рассматривается реальная форма молекулы, то используется простое изображение в трех измерениях (Ш).
Строение этана
Этан С 2 Н6 является следующим по величине после метана алканом. Если соединить атомы этой молекулы ковалентными связями, следуя правилу о существовании одной связи (одна пара электронов) для каждого атома водорода и четырех связей (четыре пары электронов) для каждого атома углерода, то получается структура
Типы химической связи
... электроны, тем сильнее выражены у электрона металлические свойства. Потенциал ионизации растет в пределах периода слева направо, уменьшается сверху вниз. Ионная связь образуется за счет перехода одного или нескольких электронов ... положение, что углерод обычно имеет валентность 4, образует 4 связи с другими ... атом, на внешнем уровне которого содержится максимальное число электронов (2 и 8 электронов). ...
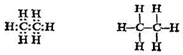
Каждый атом углерода связан с тремя атомами водорода и другим атомом углерода.
Поскольку каждый углеродный атом связан с четырьмя другими атомами, его связывающие орбитали (sр 3 -орбитали) направлены к вершинам тетраэдра. Как и в случае метана, связи углерод — водород возникают благодаря перекрыванию этих sр3 -орбиталей с s-орбиталями водородов. Углерод-углеродная связь возникает в результате перекрывания двух sр3 -орбиталей.
s-связи (сигма-связи).
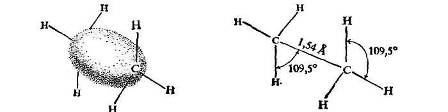
Рис. 2. − Молекула этана. Простая связь углерод — углерод: s-связь. Форма и размеры
В этане углы и длины углерод-водородных связей должны быть такими же, как в метане, т.е. приблизительно 109,5° (1,911 рад) и 1,09 А (10,9 х 10 -2 нм) соответственно. Такая структура этана полностью подтверждена методом дифракции электронов и спектральными исследованиями; соответствующие измерения дали следующие значения для молекулы этана (рис. 2.2): углы связей 109,5° (1,911 рад); длина связи С-Н 1,10 А (11,0·10-2 нм) и длина связи С-С 1,54 А (15,4·10-2 нм).
Аналогичные исследования показали, что эти величины с небольшими отклонениями характерны для углов связей и длин связей углерод — водород и углерод — углерод в алканах.
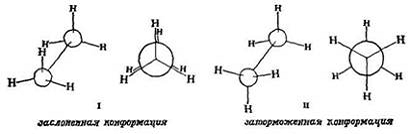
Приведенные выше значения углов и длин связей не ограничивают нас одним-единственным расположением атомов в молекуле этана, поскольку не определено отношение между атомами водорода, связанными с одним атомом углерода, и атомами водорода, связанными с другим. Возможно расположение типа I, в котором атомы водорода находятся точно друг за другом, и расположение типа II, когда атомы водорода, связанные с одним углеродным атомом, расположены между атомами водорода, связанными с другим атомом углерода, т.е. заторможены, а также неопределенное число промежуточных расположений. Какое же из них отвечает истинному строению этана? Все.
существует свободное вращение вокруг простой углерод-углеродной связи.
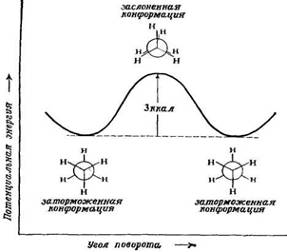
Рис. 3. − Зависимость потенциальной энергии этана от угла поворота вокруг простой углерод-углеродной связи
конформациями.
проекции Ньюмена
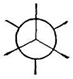
не совсем свободно:
Насколько свободно вращение в молекулах этана для перехода из одной заторможенной конформации в другую? Барьер в 3 ккал (12,56·10 3 Дж) не является очень высоким; даже при комнатной температуре энергия столкновений достаточно велика, чтобы происходило быстрое взаимопревращение между заторможенными конформациями. Для большинства практических целей можно считать, что вокруг простой углерод-углеродной связи существует свободное вращение.
заторможенной
торсионной энергией.
При замене атомов водорода в этане на другие атомы или группы атомов возникают иные факторы, влияющие на относительную устойчивость конформеров: вандерваальсовы силы, диполь-дипольные взаимодействия, водородная связь. Но тенденция орбиталей связей соседних атомов углерода находиться в заторможенной конформации остается, и любое отклонение от заторможенной конформации приводит к появлению торсионного напряжения.
Пропан и бутаны
Следующий член ряда пропан С3 Н8 . Исходя из того, что водород образует одну связь, а углерод — четыре, для пропана можно написать структуру I.
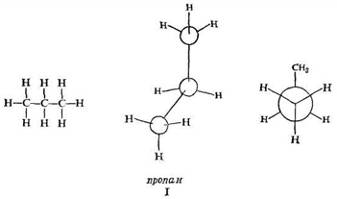
торсионному напряжению.
прямой цепью
Таблица 1. − Физические свойства изомерных бутанов
|
Изомер |
Т. кип., º С |
Т. пл., º С |
Уд. вес при -20°С |
Растворимость в 100 мл спирта, мл |
|
н-Бутан Изобутан |
0 -12 |
-138 -159 |
0,622 0,604 |
1813 1320 |
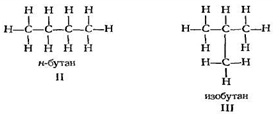
В соответствии с предсказанным были получены два соединения с одной и той же формулой С 4 Н10 . Эти два вещества несомненно являются различными соединениями, поскольку они имеют различные физические и химические свойства (табл. 1); например, одно из них кипит при 0°С, а другое — при -12°С.
н-бутаном
Рассмотрим подробнее молекулу н-бутана и конформации, в виде которых он существует. Если рассматривать молекулу вдоль связи С 2 -С3 , то получается молекула, аналогичная этану, только у каждого атома углерода один из водородов заменен на метильную группу.
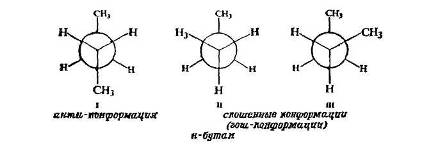
различных
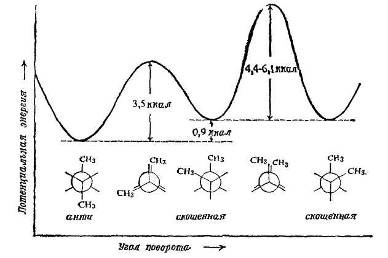
Рис. 4. − Зависимость потенциальной энергии н-бутана от угла поворота вокруг связи C 2 -C3
Существует антиконформация (I), в которой метильные группы максимально удалены друг от друга [двугранный угол равен 180° (3,141 рад)]. Существуют две скошенные, или гош-конформации (II и III), в которых метильные группы образуют угол 60° (1,047 рад); они представляют несовместимые зеркальные изображения друг друга.
силами отталкивания
Вандерваальсовы силы могут влиять не только на относительную устойчивость различных заторможенных конформаций, но также и на высоту энергетических барьеров между ними. Энергетический максимум, достигаемый, когда две метильные группы расположены одна за другой, а не за атомами водорода, представляет собой максимальный вращательный барьер; найдено, что он равен 4,4-6,1 ккал/моль (18,42·10 3 -25,54·103 Дж/моль).
Получение в промышленности и в лаборатории
промышленные
В результате синтеза в промышленных масштабах обычно получают большое количество нужного материала по низкой цене. В лаборатории требуется синтезировать несколько сот граммов или даже несколько граммов вещества или еще меньше; цена обычно имеет меньшее значение, чем время, затраченное на синтез.
В промышленности часто можно использовать не только чистое соединение, но и требуемое соединение в смеси с другими; даже когда требуется одно соединение, может быть экономически выгодно выделять его из смеси, особенно если одновременно можно выделить и другие соединения. В лаборатории химику почти всегда требуется индивидуальное чистое соединение. Выделение чистого вещества из смеси родственных соединений требует много времени, и часто не удается достигнуть нужной степени чистоты. Кроме того, сырье для определенного синтеза может быть труднодоступным веществом из предыдущего синтеза или даже серии синтезов, и, следовательно, химики заинтересованы в наиболее полном превращении его в нужное соединение. В промышленном масштабе, если нельзя выделить соединение из природного сырья, его можно синтезировать наряду с родственными соединениями в результате какой-то экономичной реакции. В лаборатории, если возможно, выбирают реакцию, в которой образуется одно соединение с хорошим выходом.
В промышленности часто бывает выгодна разработка процесса и проектирование аппаратуры, которые можно использовать для синтеза только одного представителя класса. В лаборатории химик редко заинтересован в многократном получении одного и того же соединения и, следовательно, использует методы, которые применимы ко многим или ко всем представителям определенного класса.
При изучении органической химии основное внимание уделяется различным лабораторным методам синтеза, а не отдельным промышленным способам получения. При изучении этих методов в целях упрощения можно использовать в качестве примеров синтез соединений, которые в действительности данным методом никогда не получались. Например, обсуждается получение этана гидрированием этилена, хотя этан в необходимом количестве дает нефтяная промышленность.
Методы синтеза
Каждый из низших алканов, от метана до н-пентана и изопентана, может быть получен в чистом виде фракционной перегонкой нефти или природного газа; неопентан в природе не встречается. После пентана число изомеров для каждого гомолога становится настолько большим и различия в температурах кипения настолько малы, что уже трудно выделить индивидуальные чистые соединения; эти алканы можно синтезировать одним из приведенных ниже методов.
В некоторых из рассматриваемых реакций символ R используется для обозначения любой алкильной группы. Это удобное обозначение позволяет объединить реакции, характерные для всего класса, и обратить внимание на аналогию различных представителей класса.
При написании общих реакций, однако, не следует забывать одно важное обстоятельство. Например, уравнение с RCl в качестве примера имеет смысл только с точки зрения возможности проведения данной реакции в лаборатории с каким-то реальным соединением, например хлористым метилом или трет -бутилхлоридом. Эта реакция, типичная для алкилгалогенидов, сильно различается по скорости или выходам в зависимости от природы алкильной группы, участвующей в реакции. Можно использовать различные экспериментальные условия для хлористого метила и для трет- бутилхлорида; в редких случаях реакция, которая хорошо идет с хлористым метилом, может быть совершенно неприменима для трет -бутилхлорида, поскольку будет протекать слишком медленно или приводить к большому числу побочных продуктов.
МЕТОДЫ СИНТЕЗА АЛКАНОВ
1. Гидрирование алкенов
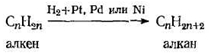
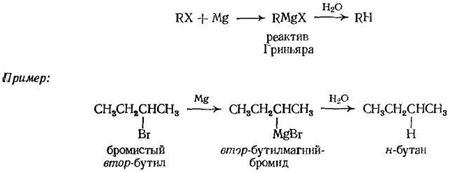
Восстановление алкилгалогенидов
а) Гидролиз реактива Гриньяра
б) Восстановление металлом в кислоте
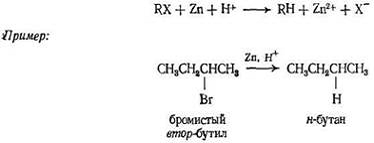
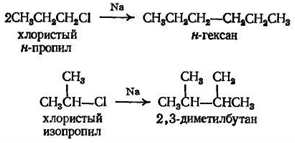
3. Реакция Вюрца
![]()
Примеры
Наиболее важный из этих методов — гидрирование алкенов. При встряхивании с водородом под невысоким давлением, в присутствии небольших количеств катализатора алкены количественно превращаются в алканы с тем же углеродным скелетом. Метод ограничен только доступностью алкенов. Это не очень серьезное ограничение; алкены легко получить в основном из спиртов; в свою очередь спирты различного строения можно без труда синтезировать.
Восстановление алкилгалогенидов реактивом Гриньяра или непосредственно металлом в кислоте заключается в прямой замене галогена на атом водорода; углеродный скелет остается нетронутым. Этот метод имеет те же ограничения, что и предыдущий, поскольку алкилгалогениды, как и алкены, легко получаются из спиртов. Если можно использовать оба метода, то следует предпочесть гидрирование алкенов, так как он проще и дает лучшие выходы.
Реакция Вюрца — единственный метод построения нового углеродного скелета. Этот метод ограничен синтезом симметричных алканов R — R.
Реактив Гриньяра
реактивом Гриньяра
алкилмагний-галогенид.
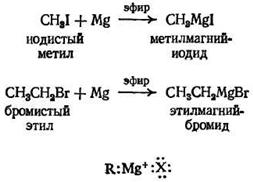
В действительности строение реактива Гриньяра значительно сложнее, чем приведенное; для некоторых реактивов Гриньяра может и не существовать молекул RMgX; тем не менее для удобства эта формула используется химиками-органиками.
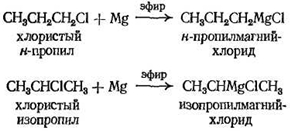
Поскольку магний связывается с тем же углеродным атомом, с которым раньше был связан галоген, алкильная группа при синтезе реагента остается неизменной. Таким образом, из хлористого н -пропила образуется н -пропил-магнийхлорид, а из хлористого изопропила — изопропилмагнийхлорид.
Использование реактива Гриньяра связано с его высокой реакционной способностью. Он реагирует с различными неорганическими соединениями, включая воду, двуокись углерода, кислород, и с большим числом органических соединений; во многих случаях подобная реакция представляет собой наилучший путь синтеза определенного класса органических соединений.
Реакция с водой, приводящая к образованию алкана, характеризует отношение реактива Гриньяра к кислотам. Как уже говорилось, связь углерод — магний сильно полярна или, другими словами, имеет в значительной степени ионный характер. Следовательно, реактив Гриньяра можно считать солью магния RMgX и очень слабой кислоты R-Н. В реакции
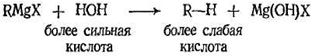
более слабая кислота R — Н вытесняется из ее соли более сильной кислотой НОН.
Алкан — настолько слабая кислота, что он вытесняется из реактива Гриньяра соединениями, которые обычно сами считаются очень слабыми кислотами или даже совсем не считаются кислотами. Любое соединение, содержащее водород, связанный с кислородом или азотом, будет значительно более кислым, чем алкан, и, следовательно, оно может разлагать реактив Гриньяра, например аммиак или метиловый спирт
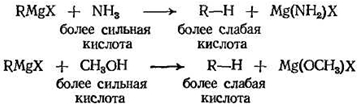
Для получения алкана можно использовать любую кислоту, поэтому естественно, что берут наиболее доступную и удобную — воду.
Реакция Вюрца
ограниченное
симметричных
Хотя многие реакции простых алкилгалогенидов можно распространить и на более сложные галогенсодержащие соединения, это не относится к реакции Вюрца. Металлический натрий — очень реакционноспособное вещество, и он будет реагировать не только с галогеном, но и с любой другой группой, которая может быть в более сложном соединении. Например, реакцию Вюрца нельзя применять для соединений, в которых, кроме галогена, имеется НО-группа, поскольку натрий будет реагировать с гидроксильной группой быстрее, чем с галогеном.
Механизм реакции Вюрца сложный и до конца еще не выяснен, но ясно, что в реакции сначала образуется натрийорганическое соединение, аналогичное магнийорганическому соединению, описанному выше, RX + +2Na = RNa + NaX, которое затем реагирует со второй молекулой алкилгалогенида RNa + RX = R−R + NaX (Реактив Гриньяра менее реакционноспособен, чем натрийорганическое соединение: он реагирует только с некоторыми очень реакционноспособными органическими соединениями.)
Реакции
алкан синтез галогенирование пиролиз
Инертность метана к большинству реагентов характерна для всех алканов. Как и метан, высшие алканы вступают в относительно небольшое число реакций; все они протекают только в жестких условиях и, как правило, приводят к смеси продуктов. Обычно это свободнорадикальные цепные реакции.
Можно объяснить в общем виде эти характерные реакции алканов. Только очень реакционноспособная частица — атом или свободный радикал — может атаковать молекулу алкана. Возникновение этой активной частицы требует жестких условий: например, диссоциации молекулы галогена на атомы или даже (как при пиролизе) диссоциации самой молекулы алкана.
При атаке реакционноспособная частица отщепляет водород от алкана; сам алкан при этом превращается в реакционноспособную частицу, которая продолжает реакцию, т.е. продолжает цепь. Но молекула алкана содержит большое число атомов водорода, и получаемый продукт зависит от того, какой атом водорода отщепляется. Хотя атакующая частица может проявлять определенную селективность, она может отщеплять водород от любой части молекулы и, таким образом, вызывать образование многих изомерных продуктов.
РЕАКЦИИ АЛКАНОВ
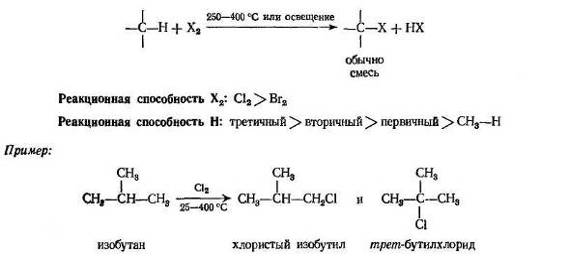
1. Галогенирование
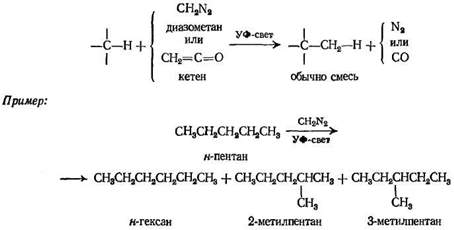
2. Внедрение метиленовой группы (СН 2 )
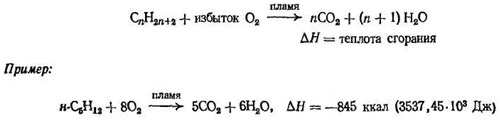
3. Горение
4. Пиролиз (крекинг)
![]()
Галогенирование
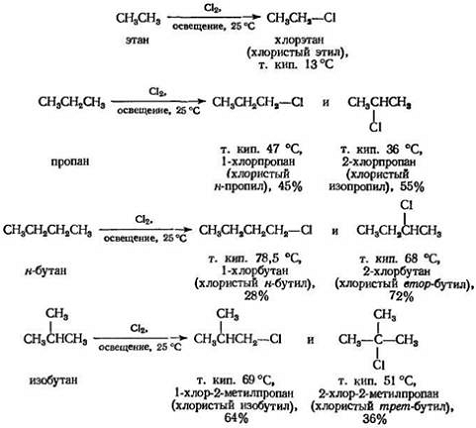
Как и следовало ожидать, галогенирование высших алканов по существу протекает так же, как и галогенирование метана. Однако оно может усложняться образованием смеси изомеров.
Под влиянием ультрафиолетового света или при 250-400°С хлор или бром превращают алканы в хлоралканы (хлористые алкилы) или бромалканы (бромистые алкилы); одновременно выделяется эквивалентное количество хлористого или бромистого водорода. Установлено, что при разбавлении инертным газом и в специальной аппаратуре, в которой отводится выделяющееся тепло, фтор реагирует аналогично. Как и в случае метана, йодирование высших алканов не происходит.
Из одного алкана в зависимости от того, какой атом водорода замещается, может образоваться несколько изомерных продуктов. Из этана может образоваться только один галогенид; пропан, н -бутан и изобутан могут дать два изомера, н -пентан — три изомера и изопентан — четыре. Экспериментально показано, что при галогенировании алкана образуется смесь всех возможных изомерных продуктов, что свидетельствует о способности всех водородных атомов подвергаться замещению. Например, при хлорировании.
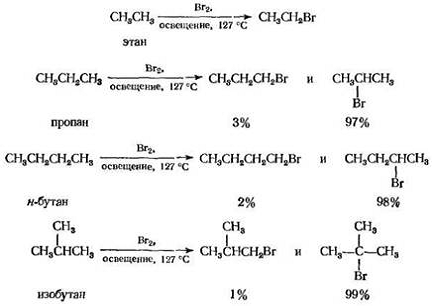
Бромирование приводит к соответствующим бромидам, но в другом соотношении:
относительные количества
Хлорирование алкана не всегда удобно для лабораторного получения хлористого алкила; любой из продуктов образуется с низким выходом, и его трудно отделить от изомеров, температуры кипения которых мало отличаются от его собственной. Однако бромирование часто приводит к почти чистым бромистым алкилам с высоким выходом. Кроме того, можно предсказать какой изомер будет преобладать; если это требуемый продукт, то прямое бромирование может быть удобным методом синтеза.
Хлорирование алканов имеет значение в промышленном масштабе. Для многих целей, например в качестве растворителей, вполне пригодна смесь изомеров, и она значительно дешевле, чем чистое соединение. Иногда в случае необходимости следует разделять смесь изомеров, особенно если каждый изомер можно затем реализовать.
Механизм галогенирования
Галогенирование алканов протекает по такому же механизму, как и галогенирование метана:
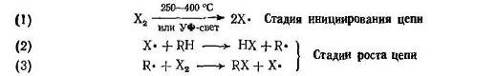
затем (2), (3), (2), (3) и т.д. до обрыва цепи/
Атом галогена отщепляет водород от алкана (RH) с образованием алкильного радикала (R·).
Радикал в свою очередь отщепляет атом галогена от молекулы галогена с образованием алкилгалогенида (RX).
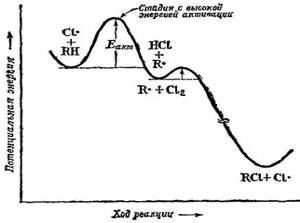
Рис. 5. − Изменение потенциальной энергии для реакции хлорирования алкана. Стадией, определяющей скорость реакции, является стадия образования радикала
Направление реакции, т.е. какой алкилгалогенид получается в результате реакции, зависит от того, какой алкильный радикал образуется.
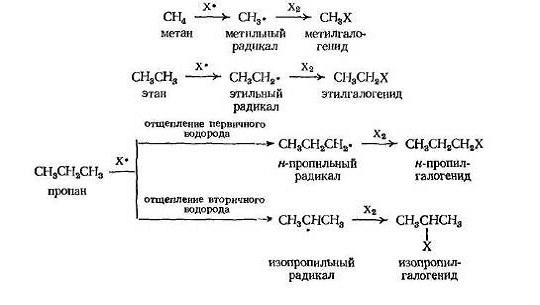
Это в свою очередь зависит от строения алкана и от того, какой водород отщепляется. Например, н -пропилгалогенид образуется из н- пропильного радикала, который получается из пропана при отщеплении первичного водорода; изопропилгалогенид возникает из изопропильного радикала, образующегося при отщеплении вторичного водорода.
Насколько быстро протекает образование алкилгалогенида, зависит от скорости образования алкильного радикала. И здесь, так же как и в случае метана, из двух стадий роста цепи стадия (2) протекает медленнее, чем стадия (3), и, следовательно, она контролирует скорость всей реакции. Образование алкильного радикала происходит с трудом, но если радикал образовался, он легко превращается в алкилгалогенид (рис. 5).
Ориентация при галогенировании
Теперь вернемся к проблеме ориентации, т.е. рассмотрим факторы, которые определяют наиболее реакционноспособное место молекулы. Эта проблема возникает всякий раз при изучении соединения, в котором реагент может атаковать различные положения. Это важная проблема, поскольку ориентация определяет строение образующегося продукта.
В качестве примера рассмотрим хлорирование пропана. Относительные количества образующихся н -пропилхлорида и изопропилхлорида зависят от относительных скоростей, с которыми образуются н -пропильный и изопропильный радикалы. Если, например, изопропильный радикал образуется быстрее, то изопропилхлорид будет образовываться быстрее и будет составлять большую часть продукта. Как видно, н -пропильные радикалы образуются в результате отщепления первичных водородов, а изопропильные — при отщеплении вторичных водородов.
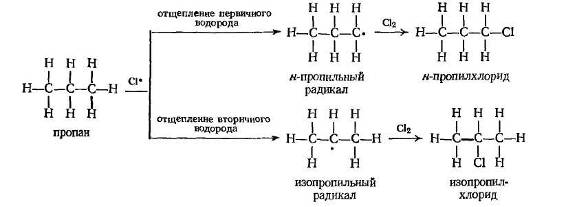
ориентация определяется относительными скоростями конкурирующих реакций.
Во-первых, частота столкновений. Она должна быть одинаковой для обеих реакций, поскольку обе включают столкновение одних и тех же частиц: молекулы пропана и атома хлора.
Затем, фактор вероятности. Для отщепления первичного водорода молекула пропана должна быть ориентирована в момент столкновения таким образом, чтобы атом хлора сталкивался с первичным атомом водорода, а для отщепления вторичного водорода пропан в момент столкновения должен быть ориентирован таким образом, чтобы хлор сталкивался со вторичным атомом водорода. Поскольку в каждой молекуле имеется шесть первичных атомов водорода и только два вторичных, то фактор вероятности благоприятствует отщеплению первичных атомов водорода в отношении 6:2, или 3:1.
Учитывая только частоту столкновений и фактор вероятности, можно предсказать, что хлорирование пропана приведет к н -пропилхлориду и изопропилхлориду в соотношении 3:1. Однако два хлорида образуются примерно в равных количествах, т.е. в отношении 1:1 или 3:3. Количество изопропилхлорида примерно в 3 раза больше, чем предсказывалось. Очевидно, что благоприятных столкновений со вторичным водородом в 3 раза больше, чем с первичным. Если предположение о факторе вероятности правильно, то это означает, что Еакт для отщепления вторичного атома водорода меньше, чем для отщепления первичного.
Хлорирование изобутана представляет аналогичную проблему. В этом случае отщепление одного из девяти первичных атомов водорода приводит к образованию изобутилхлорида, а отщепление одного третичного водорода — к трет -бутилхлориду. Фактор вероятности благоприятствует образованию изобутилхлорида в соотношении 9:1.
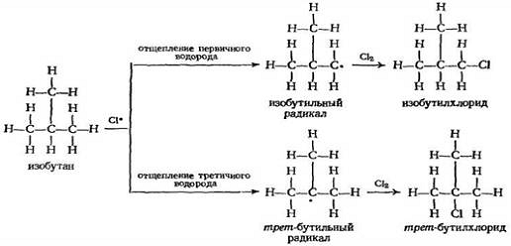
Е акт
на один водородный атом

Несмотря на эти различия в реакционной способности, при хлорировании редко значительно преобладает один из изомеров.
Такое же изменение реакционной способности: третичный > вторичный > первичный наблюдается и при бромировании, но со значительно большим соотношением относительных реакционных способностей. При 127 °С, например, относительные скорости на один атом водорода составляют 1600 : 82 : 1. В данном случае различия в реакционной способности настолько велики, что влияние фактора вероятности уже не существенно.
Метилен (карбен).
Внедрение
метиленовую группу.
диазометана

Существование метилена как очень реакционноспособной частицы было впервые предложено в 30-х годах для объяснения образования соединения, которое способно снимать некоторые металлические зеркала. Существование метилена было доказано в 1959 г. спектральными исследованиями.
синглетный
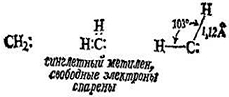
триплетный
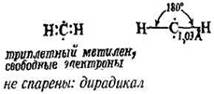
Триплетный метилен является свободным радикалом, в действительности дирадикалом. Вследствие различной электронной конфигурации два типа молекул отличаются по форме и химическим свойствам. Синглетный метилен менее стабилен и часто, хотя и не всегда, образуется в первую очередь при фотолизе. Поскольку свет, поглощаемый диазометаном или кетеном при фотолизе, обладает большей энергией, чем необходимо для фотолиза, образовавшийся метилен является «горячим», т.е. эти молекулы метилена имеют большую энергию, чем они должны были бы обладать при данной температуре.
Химические свойства метилена зависят от условий синтеза: реагента, из которого образуется метилен; длины волны используемого света; проводится ли реакция в жидкой или газовой фазе, и если в газовой фазе, то в присутствии инертного газа (азота, аргона и двуокиси углерода) или не такого уж инертного газа, кислорода. Ситуация очень сложная и не всегда соответствует точной интерпретации фактов. В общем можно представить два типа метилена: состояние с высокой энергией, высокой реакционной способностью и низкой селективностью; состояние с низкой энергией, более низкой реакционной способностью и большей селективностью. Согласно одной точке зрения (той, которая более принята), два типа метиленов являются просто синглетным и триплетным метиленом соответственно; согласно другой точке зрения, свойства метилена определяются не его спиновым состоянием, а тем, насколько он «горячий».
внедрения
![]()
Метилен, возникающий в присутствии алкана, внедряется в каждую связь углерод — водород
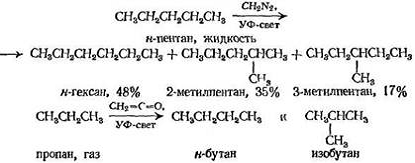
Реакция с н- пентаном в жидкой фазе представляет интерес по следующей причине: соотношение продуктов реакции соответствует произвольной атаке реагентом. Полное отсутствие селективности в данном случае объясняется тем, что метилен, который является атакующей частицей, находится не только в синглетном состоянии, но еще и «горячий», поэтому каждое столкновение с первичной или вторичной связью имеет достаточно энергии для реакции.
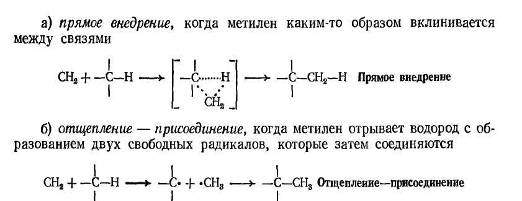
В реакциях метилена с алканами можно увидеть следующие довольно простые закономерности:

Горение
Реакция алканов с кислородом, приводящая к образованию двуокиси углерода, воды и, что наиболее важно, выделению тепла, является основной реакцией, происходящей в двигателе внутреннего сгорания; ее огромное практическое значение очевидно.
Механизм этой реакции очень сложен и до сих пор полностью не установлен. Однако нет сомнений, что это свободнорадикальная цепная реакция. Реакция очень экзотермична, но для того, чтобы она началась, требуется очень высокая температура — температура пламени. Как и в случае хлорирования, необходимо большое количество энергии для разрыва связи, в результате которого образуется реакционноспособная частица, начинающая цепь; если преодолеть этот барьер, то соответствующие стадии, продолжающие цепь, протекают легко и с выделением энергии.
Использование высокого давления сделало современные двигатели более эффективными, но в то же время создало новую проблему. При определенных условиях мягкий взрыв смеси топлива и воздуха в цилиндре сменяется детонацией, которая значительно уменьшает мощность двигателя.
Проблема детонации успешно решается двумя путями: а) выбором соответствующего углеводорода в качестве топлива и б) добавлением тетраэтилсвинца.
Испытания чистых соединений показали, что детонационные свойства углеводородов очень сильно изменяются в зависимости от структуры. Относительная антидетонационная способность топлива обычно характеризуется так называемым октановым числом: была выбрана произвольная шкала, причем н -гептану, который сильно детонирует, приписано октановое число, равное нулю, а 2,2,4-триметилпентану (изооктану) — октановое число 100. В настоящее время имеются топлива с антидетонационными свойствами, лучшими, чем у изооктана.
(бензин прямой гонки),
этилированным
Пиролиз: крекинг
Пиролиз — это разрушение соединений при нагревании. Этот термин происходит от греческих слов руr — огонь и lysis — разрушение и, следовательно, означает «расщепление при нагревании».
термическом крекинге
Алканы с низким молекулярным весом, получаемые при крекинге, можно разделить и очистить; они служат важным сырьем для синтеза алифатических соединений в крупных масштабах.
каталитический крекинг.
алкилирования
каталитического реформинга
Заключение
Значение алканов для человечества огромно! Это сырье для органического синтеза и химической промышленности. Это топливо, на котором сейчас работает все человечество. Это основа экономики нашей страны, т.к. алканы составляющая часть нефти, причем очень немаловажная. Представить нашу жизнь без алканов очень сложно. Но тот факт, что нефть на земле довольно скоро закончится, ставит под вопрос столь простой и выгодный для человечества способ получения энергии, как сжигание алканов. Количество энергии, полученное человечеством от этих соединений очень велико.
Список литературы
[Электронный ресурс]//URL: https://inzhpro.ru/kursovaya/predelnyie-uglevodorodyi-alkanyi/
1. Мориссон Р., Бойд Р. Органическая химия. − М.: Мир, 1974.
2. Нейланд О.Я. Органическая химия. − 1990.
— Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. − М.: Химия, 1962.
— Степаненко Б.Н. Курс органической химии. − М.: Высшая школа, 1976.
— Белобородов В.Л., Зурабян С.Э., Лузин А.Р., Тюкавкина Н.А. Органическая химия. − М.: Дрофа, 2002.
— Марч Дж. Органическая химия. − М.: Мир, 1987.
— Кери Ф., Сандберг Р. Углубленный курс органической химии. − М.: Мир, 1981.
— Гауптман З., Греффе Ф., Ремане Х. Органическая химия. − М.: Мир, 1979.
— Агрономов А.Е. Избранные главы органической химии. − М.: Химия, 1990.
— Кочетков Н.К. Общая органическая химия. − М.: Химия, 1984.
