Соединения магния были известны человеку очень давно. Магнезитом (по-гречески Magnhsia oliqV) называли мягкий белый, мылкий на ощупь минерал (мыльный камень, или тальк), который находили в районе Магнезии в Фессалии. При прокаливании этого минерала получали белый порошок, который стали именовать белой магнезией.
4
Гемфри Дэви
Магний есть в кристаллических горных породах в виде нерастворимых карбонатов или сульфатов, а также (в менее доступной форме) в виде силикатов. Оценка его общего содержания существенно зависит от используемой геохимической модели, в частности, от весовых отношений вулканических и осадочных горных пород. Сейчас используются значения от 2 до 13,3%. Возможно, наиболее приемлемым является значение 2,76%, которое по распространенности ставит магний шестым после кальция (4,66%) перед натрием (2,27%) и калием (1,84%).
Большие области суши, такие как Доломитовые Альпы в Италии состоят преимущественно из минерала доломита MgCa(CO3)2. Там встречаются и осадочные минералы магнезит MgCO3, эпсомит MgSO4·7H2O, карналлит K2MgCl4·6H2O, лангбейнит K2Mg2(SO4)3.
Залежи доломита есть во многих других районах, в том числе в Московской и Ленинградской областях. Богатые месторождения магнезита найдены на Среднем Урале и в Оренбургской области. В районе г.Соликамска разрабатывается крупнейшее месторождение карналлита. Силикаты магния представлены базальтовым минералом оливином (Mg,Fe)2(SiO4), мыльным камнем (тальк) Mg3Si4O10(OH)2, асбестом (хризотил) Mg3Si2O5(OH)4 и слюдой. Шпинель MgAl2O4 относится к драгоценным камням.
Большое количество магния содержится в водах морей и океанов и в природных рассолах (см. ХИМИЯ ГИДРОСФЕРЫ).
В некоторых странах именно они являются сырьем для получения магния. По содержанию в морской воде из металлических элементов он уступает только натрию. В каждом кубометре морской воды содержится около 4 кг магния. Магний есть и в пресной воде, обусловливая, наряду с кальцием, ее жесткость.
Магний всегда содержится в растениях, так как входит в состав хлорофиллов.
Особенности химии магния
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl 2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
Магний и его сплавы. Резиновые материалы. Быстрорежущая сталь
... магния - электролиз расплавленного карналлита или MgCl 2 . Металлический магний имеет важное значение для народного хозяйства. Он используется при изготовлении сверхлегких сплавов ... и источниках. В растительных и животных организмах магний содержится в количествах порядка сотых долей процента, а ... KCl3H2 O. На поверхности Земли магний легко образует водные силикаты (тальк, асбест и др.), примером ...
MgCl 2 (электролиз) = Mg + Cl2 .
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование , переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
MgO + C = Mg + CO
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO 3 ·MgCO3 , не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO 3 ·MgCO3 = CaO + MgO + 2CO2 ,
2MgO + CaO + Si = Ca 2 SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C).
Выше 464 °C устойчива гексагональная β-форма. t пл = 650 °C, t кип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C).
Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²).
Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO
Mg (раск.) + Н
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О 2 = 2MgO;
Железо и его свойства
... так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности. Для железа характерен полиморфизм, он ... Блеск: смолистый, стеклянный Твёрдость: 2-2,5 Устойчивость: кристаллы устойчивы на воздухе, но растворимы в воде, при нагревании обезвоживается в следствии чего кристалл ...
3Mg + N 2 = Mg 3 N 2
Магний хорошо горит даже в углекислом газе:
![]()
Металлический магний — сильный восстановитель, применяется в промышленности для восстановления титана до металла из тетрахлорида титана и металлического урана из его тетрафторида
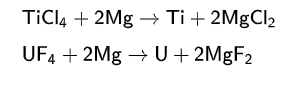
Физические и химические свойства
Магний – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой оксидной пленкой, придающей ему матовый цвет. Кристаллическая решетка магния относится к гексагональной системе.
Атомный радиус, Å 1,6
Радиус иона Mg2+, Å 0,74
Энергия ионизации, эв, для Mg0 ® Mg+ 7,64
для Mg+ ® Mg2+ 15,03
Плотность (20 oC), г/см3 1,739
Температура плавления., oC 651
Температура кипения, oC 1107
Теплота плавления, кал/г-атом 2100
Теплота испарения, кал/г-атом 31000
Теплота возгонки (при 25 oC), кал/г-атом 35000
Удельная теплоемкость (20 oC), кал/г-град 0,248
Теплопроводность (20 oC), кал/смžсек. град 0,37
Удельное электрическое сопротивление, Омžсм 4,5ž10-6
Поперечное сечение захвата тепловых электронов, барн 0,059
Электропроводность (Hg=1) 22
В природе магний встречается в виде трех стабильных изотопов: 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%).
Искусственно были получены изотопы с массами 23, 27 и 28.В периодической системе элементов магний располагается в главной подгруппе II группы; его порядковый номер – 12, атомный вес 24,312. Электронная конфигурация невоз-бужденного атома – 1s22s2p63s2; валентные электроны наружного слоя определяют валент-ность +2 и объясняет типичный характер восстановительных реакций , в которые вступает магний. Строение внешних электронных оболочек атома Mg (3s2) соответствует его нульва-лентному состоянию. Возбуждение до обычного двухвалентного (3s3p) требует затраты 62 ккал/г-атомНа внешнем электронном уровне атома содержатся только 2 электрона, которые легко отдаются для образования стабильной 8-электронной конфигурации, в результате чего обра-зуются двухвалентные положительно заряженные ионы магния. Поэтому химически магний очень активен, на воздухе окисляется, но образующаяся при этом на поверхности окисная пленка отчасти препятствует дальнейшему окислению.Магний наряду с бериллием, кальцием, стронцием, барием и радием относится к группе щелочноземельных металлов. Все они имеют бело-серебристый цвет (исключение составляет барий – он светло-серый), все они мягкие и легкие (кроме радия – он тяжелый и радиоактивный).
Щелочноземельные металлы плохо проводят электрический ток; почти все они неустойчивы на воздухе, активны, легко растворяются в разбавленных кислотах, при нагревании энергично реагируют с кислородом, водородом, азотом, углеродом, галогенами, серой, фосфором и др.; они используются в качестве восстановителей в промышленном мно-гих веществ. Но как конструкционный материал из всей группы широко применяется только магний.Пары магния содержат молекулы Mg2, энергия диссоциации которых оценивается в 7 ккал/моль.Сжимаемость Mg мала, под давлением в 100 тыс. ат его объем уменьшается до 0,85 исходного.Аллотропические модификации магния неизвестны.На магний не оказывают заметного действия дистиллированная вода, фтористоводо-родная кислота любой концентрации, водные растворы фтористых солей, сера (жидкая и газ), сернокислый алюминий, сероуглерод, растворы едких щелочей, углекислая щелочь, су-хие углеводороды, органические галогенпроизводные, не содержащие спирта и H2O, безвод-ная C2H5OH, этиловый и уксусный эфиры, жиры и масла, не содержащие кислот, ароматиче-ские соединения и минеральные масла.Разрушающе действуют на магний морская и минеральная вода, водные растворы HCl, H2SO4, HNO3, H3PO4, кремнефтористоводородные кислоты, водные растворы галоид-ных солей, сернистых соединений , NH3, его водные растворы, NxOy, растворы двууглекислой соды, органические кислоты, водные и спиртовые растворы хлорметила и хлорэтила, мети-ловый спирт, гликоли и гликолевые смеси, многие альдегиды.При комнатной температуре на воздухе компактный магний химически стоек. На его поверхности образуется оксидная пленка, предохраняющая металл от окисления. При нагревании химическая активность магния повышается. Считается, что верхний температурный предел устойчивости магния в кислороде лежит в интервале 350–400 oC.На воздухе магний воспламеняется при температуре 600-650 oC, при этом образуется MgO, частично Mg3N2; при 400–500 oC в атмосфере H2 под давлением образуется гидрид MgH2. Реакции сопровождаются большим выделением тепла (чтобы нагреть стакан ледяной воды до кипения, достаточно 4 г магния) и мощным излучением ультрафиолета.
Реферат биологическая роль магния
... водные растворы, NxOy, растворы двууглекислой соды, органические кислоты, водные и спиртовые растворы хлорметила и хлорэтила, метиловый спирт, гликоли и гликолевые смеси, многие альдегиды. При комнатной температуре на воздухе компактный магний ... В растительных и животных организмах магний содержится в количествах порядка ... магния значительно больше атома бериллия, это свидетельствует о значительной роли ...
При нагревании магний взаимодействует с галогенами с образованием галогенидов; при 500–600 oC при взаимодействии с серой образуется MgS; при более высокой температуре возможно образование карбидов MgC2 и Mg2C3, силицидов MgSi и Mg3Si2, фосфида Mg3P2.Нормальный электродный потенциал магния в кислой среде составляет -2,37 в, в щелочной -2,69 в. Магний – сильный восстановитель, может вытеснить большин-ство металлов из их солей, H2 из воды и кислот.Холодная вода на магний почти не действует, с горячей водой он медленно взаимо-действует с выделением водорода. В разбавленных кислотах магний растворяется даже на холоду. В HF магний не растворяется, поскольку на поверхности образуется пленка из труд-но растворимого в воде MgF2; в концентрированной H2SO4 почти не растворяется.Нормальный потенциал магния равен -2,37 в (в кислой среде) и -2,69 в (в щелочной среде).Поэтому оба металла должны были бы разлагать воду. Однако при обычной темпера-туре такое разложение практически не происходит. Обусловлено это малой растворимостью оксида магния, образующего защитный слой на поверхности металла.С водным раствором аммиака магний почти не реагирует, зато он растворим при дей-ствии на него растворов солей аммония. Реакция в этом случае идет по схеме 2NH4++Mg=Mg2++H2+2NH3.Растворы щелочей на магний не действуют.
Монтаж двухтрубной системы отопления
... достоинства или недостатки систем. В настоящее время практический интерес вызывает отопление и проектирование системы отопления, монтаж и наладка автономных закрытых насосных систем отопления жилых зданий с индивидуальным источником тепловой энергии ...
Использования соединений магния в препаратах различных фармакотерапевтических групп
Биологическая роль магния
В человеческом организме количество магния составляет всего несколько десятых или сотых долей процента, однако он играет немаловажную роль в процессах жизнедеятельности. Доказано, что недостаток магния в организме способствует заболеванию инфарктом миокарда. Недостаточное количество магния в крови – признак переутомления или стрессового состояния.
Основные продукты, содержащие магний – это абрикосы, персики, цветная и белокочанная капуста, помидоры, картофель.
Потребность взрослого организма в магнии составляет 300–500 мг/день. Обычно магний в достаточном количестве поступает с пищей , в случае нехватки его недостаток проще всего восполнить, потребляя минеральную воду. В организме усваивается менее 40% поступающего в него магния, так как его соединения плохо всасываются кишечником. Магний усиливает процессы обмена углеводов в мышцах, укрепляет кости; если в организме нарушено магние-кальциевое равновесие, то почти весь магний включается в состав костных тканей, вытесняя оттуда кальций. Это ведет к заболеванию рахитом.
В нервной системе также содержатся большие количества магния, особенно в спинном мозге. Большое значения магния для деятельности нервной системы подтверждается тем, что при инъекции магния в кровь человек или животное впадает в состояние, близкое к наркотическому. Это свойство магния используется в медицине.
В организмах некоторых животных содержание магния сравнительно высоко. Так, например, в организме известковой губки содержится 4% магния, в талломе некоторых водорослей – больше 3%.
Магний входит в состав хлорофилла и, следовательно, играет незаменимую роль в фотосинтезе и в газообмене планеты; общее содержание магния в тканях растений на Земле по некоторым оценкам составляет порядка 10 11 тонн.
Кроме хлорофилла, магний во всех тканях растений участвует также в образовании жиров, в превращении фосфорных соединений. Особенно много магния в соке каучуконосных растений. Нехватка магния приводит к уменьшению количества хлорофилла и к побледнению и смене окраски листьев на красную и желтую.
Магний как лекарственное средство
Английская соль (MgSO 4 7H2 O) используется как слабительное и желчегонное средство. При инъекциях она вызывает состояние, близкое к наркотическому, и используется для борьбы с судорогами, для лечения гипертонии, психического возбуждения; в сочетании с другими препаратами – для обезболивания при родах.
Водные растворы тиосульфата магния используются для лечения ожогов и других заболеваний кожи.
Белая магнезия (MgCO 3 ) входит в состав зубных порошков и присыпок ; кроме того, она уменьшает кислотность желудочного сока.
Жженая магнезия (MgO) тоже нейтрализует желудочный сок. Кроме того, она применяется внутрь при кислотных отравлениях.
Заключение
Магний – один из жизненно необходимых нашему организму химических элементов, он принимает активное участие более чем в трехстах пятидесяти ферментативных реакциях.
Энергетические затраты организма при физических нагрузках
... кислорода (МПК) – необходимое количество кислорода, которое организм может потребить в минуту при определенной мышечной работе. У нетренированных людей МПК составляет 2- 3,5 л/ мин., у ... его объема, что повышает мощность и работоспособность сердечной мышцы. Кровь в организме человека выполняет следующие функции: транспортная; регуляторная; защитная; теплообмен. При регулярных занятиях физическими ...
Роль магния для здоровья человека переоценить сложно, ведь он является составной частью абсолютно всех тканей и клеток организма человека.
Магний участвует в таких процессах жизнедеятельности организма, как:
- образование новых клеток;
- работа сердечнососудистой системы (магний даже называют «минералом сердца»);
- укрепление нервной системы;
- работа мозга;
- пищеварение;
- здоровая работа почек;
- правильный энергообмен;
- формирование и укрепление костей и зубов;
- тонус и работа мышц.
Также магний активизирует усвоение витаминов группы В и витамина С, поддерживает нормальный уровень кальция.
Чтобы понять степень необходимости присутствия этого минерала в нашем организме, достаточно посмотреть, к чему приводит недостаток магния. Вот перечень лишь основных заболеваний, связанных с дефицитом магния в организме человека:
- депрессия, повышенная тревожность, быстрая утомляемость, физическая и психологическая усталость, бессонница;
- негативные изменения внутричерепного и артериального давления;
- появление заболеваний сердечнососудистой системы;
- острые желудочные боли , жидкий стул;
- спонтанные головокружения, появления «мушек» перед глазами;
- нарушение концентрации внимания, проблемы с памятью;
- мышечные спазмы, судороги, онемение конечностей;
- постоянные головные боли, мигрень;
- появление метеозависимости;
- разрушение зубных тканей, кариес, выпадение зубов;
- ломкость и выпадение волос.
Магний так необходим нашему организму, что создается обманчивое впечатление, что чем больше этого вещества, тем лучше. Однако, это совсем не так. Избыток магния не менее опасен, чем недостаток. Как правило, передозировка магния возникает в случае неправильного и чрезмерного приема магнийсодержащих препаратов. Определить переизбыток магния довольно сложно, это можно сделать только в медучреждениях при помощи анализов и рентгена. Однако видимыми симптомами избытка магния могут служить постоянная тошнота, диарея, вялость, нарушения сердечного ритма.
Оптимальной суточной дозой магния принято считать:
Для мужчин 20-40 лет – 400 мг, после 40 лет – 420 мг.
Для женщин 20-50 лет – 300 мг, после 50 лет – 280 мг.
Это общие рекомендации, но у каждого конкретного организма своя потребность в магнии. Так, для спортсменов, кормящих женщин и подростков потребность в магнии увеличивается.
Человек получает магний с водой и пищей, а также с солью и некоторыми минеральными водами. Магнием богаты орехи (миндаль, арахис), кунжут, семечки, бобовые (фасоль, чечевица), крупы (гречневая, овсяная, пшенная, перловая), бананы, тыква, отруби и какао. Кроме того магний содержится в морской капусте, морской рыбе, кальмарах, яйцах, зелени, цитрусовых и в свежих молочных продуктах.
Список литературы
[Электронный ресурс]//URL: https://inzhpro.ru/referat/primenenie-magniya-v-meditsine/
