альцинированная сода, или карбонат натрия, находит большое применение, и ее производство относится к крупнотоннажному. В больших количествах кальцинированная сода применяется при получении едкого натра, в производстве стекла, цветных металлов, для очистки нефтепродуктов, в мыловарении, текстильной промышленности, в производстве искусственного шелка и прочее.
Основные потребителями кальцинированной соды являются: химическая промышленность-28%, стекольная промышленность-26%, цветная металлургия-15,1%, пищевая, целлюлозно-бумажная промышленность-6,3%, нефтехимическая и нефтеперерабатывающая промышленность-3,2%, потребление в быту-1,6%, медицинская промышленность-1,1%, электротехническая промышленность-1,0% и прочие потребители-18,7%. Мировое потребление соды превысило 50 миллионов тонн. Огромные масштабы производства кальцинированной соды свидетельствует о большом значении этого продукта для всех областей человеческой деятельности.
Станция обжига известняка является одной из первых стадий технологической схемы получения кальцинированной соды. Необходимая для производства соды известь и двуокись углерода образуются при термическом разложении известняка (мела) в известково-обжигательных печах.
Известь является одним из наиболее распространенных и разносторонне используемых химических продуктов, производимых и потребляемых по всему миру.
Известь используется для получения кальцинированной соды, едкого натра, карбида кальция, хлорной извести, хлористого кальция, гипохлорита кальция, бертолетовой соли, белильных растворов, кальциевой селитры. Большие количества извести используются для нейтрализационного обеззараживания промышленных сточных вод.
1. Характеристика химического продукта
Кальцинированная сода, или углекислый натрий, называемый также карбонатом натрия, представляет собой кристаллический порошок белого цвета.
Углекислый натрий-это натриевая соль угольной кислоты. Его химическая формула Nа 2 СО3 ; молекулярный вес 106; температура плавления 851°. Удельный вес соды 2,53 г/см3 . Насыпной вес (отношение веса порошка к занимаемому им объему) составляет примерно 0,5 кг/л. Специальные сорта так называемой тяжелой соды имеют насыпной вес около 1 кг/л.
Сода хорошо растворяется в воде, при этом выделяется тепло и раствор разогревается. Растворимость соды зависит от температуры. Ниже помещены данные о растворимости соды при различных температурах.
Производство кальцинированной соды (2)
... кальцинированной соды для совершенствования технологии литейного производства в машиностроении. В медицинской промышленности сода используется в производстве медикаментов. В легкой промышленности сода ... не менее Массовая концентрация кальция в пересчете на кальций-ион, г/дм3, не более ... Отход содового производства - HCI - перерабатывали на хлор и хлорные продукты (белильную известь и бертолетовую ...
Таблица 1- Зависимость растворимости соды от температуры
|
Температура, 0 С |
Растворимость Nа 2 СО3 г в 100 г воды |
|
0 |
6,86 |
|
10 |
11,98 |
|
40 |
48,9 |
|
80 |
44,5 |
|
100 |
44,5 |
Водные растворы соды обладают сильно щелочными свойствами. Удельные веса растворов увеличиваются по мере повышения концентрации Nа 2 СО3 в растворе.
Кальцинированная сода или углекислый натрий, подобно некоторым другим солям, образует в соединении с водой кристаллогидраты: одноводную соду- Nа 2 СО3 *H2 О-моногидрат; семиводную соду — Nа2 СО3 *7H2 О; десятиводную соду- — Nа2 СО3 *10H2 О.
Кристаллогидраты углекислого натрия растворяются в воде быстрее, чем — Nа 2 СО3 , поэтому их используют в быту, в фотографии и для других целей. Кальцинированная сода по качеству должна удовлетворять требованиям Государственного общесоюзного стандарта (ГОСТ)№5100-49.В зависимости от степени чистоты продукта различают следующие марки кальцинированной соды: техническую, фотографическую, оптическую (таблица 2).
Таблица 2 — Требования, предъявляемые к кальцинированной соде (ГОСТ №5100-49)
|
Показатели |
Техническая |
Фотографическая |
Оптическая |
|
Общая щелочность продукта в пересчете на Nа 2 СО3 , %, не менее |
95 |
95 |
96 |
|
Потеря веса при прокаливании, % , не более |
3,5 |
3,5 |
2,5 |
|
Хлористый натрий NаСI, %, не более |
1 |
1 |
0,5 |
|
Сернокислый натрий Nа 2 SО4 , %, не более |
Не нормируется |
0,1 |
0,05 |
|
Железо Fе, %, не более |
Не нормируется |
0,01 |
0,005 |
Соду следует хранить в специально оборудованных помещениях, применяя для упаковки многослойные бумажные мешки. Это связано с тем, что сода поглощает из воздуха влагу и СО 2 , превращаясь в бикарбонат, вследствие чего снижается общая щелочность продукта.
2. Методы получения
Кальцинированная сода (карбонат натрия) была известна еще в глубокой древности. Издавна соду получали из золы морских и солончаковых растений и извлекали из рапы природных содовых озер. Ее использовали в стеклоделии и в качестве моющего средства. К концу ХVПI в. эти источники уже не могли удовлетворить возрастающую потребность в соде. В 1775 г. французский фармацевт Леблан предложил получать соду прокаливанием смеси сульфата натрия, измельченного мела или известняка и угля согласно реакции:
а 2 SО4 +СаСОз+2С-Nа2 СО3 +Са+2СО2 (2.1) .
Из полученного плава соду выщелачивали водой и раствор упаривали, выделяя Nа 2 СО3 в твердом виде. В шламе оставался СаS, являющийся отходом производства. Так как в природе натрий встречается чаще в виде NаСI, необходимый для производства соды, Nа2 SО4 было предложено получать взаимодействием хлорида натрия и серной кислоты.
Способ Леблана сыграл большую роль в развитии химической промышленности и разработке сырьевых баз. Вокруг содовых заводов концентрировались производства и других продуктов: серной кислоты, а за ней и азотной, поскольку серную кислоту получали лишь нитрозным способом с помощьюазотной кислоты. Отход содового производства — НСI — перерабатывали на хлор и хлорные продукты: белильную известь и бертолетовую соль. Из отхода СаS получали элементарную серу. Огарок после обжига медистого серного колчедана, служившего сырьем для получения серной кислоты, использовали для производства медного купороса и других солей меди. Сама сода использовалась как исходный продукт для получения многих натриевых солей, например NаНСО 3 , NаОН, Nа2 SОз, NаНSОз и др. Содовые заводы стали центрами зарождавшейся химической промышленности.
В 1865 г. бельгийским инженером Сольве был разработан и осуществлен в промышленном масштабе аммиачный способ получения соды, отличавшийся следующими преимуществами: более высоким качеством получаемого продукта, непрерывностью процесса, лучшими условиями труда и меньшим расходом рабочей силы, снижением расхода тепла, а следовательно, и топлива, возможностью применения растворов NаСI, более дешевых, чем твердая поваренная соль, необходимая при способе Леблана. В целом «аммиачная сода» получалась более дешевой и лучшего качества.
Одновременно с развитием аммиачного способа получения соды совершенствовался и способ Леблана. Чтобы предотвратить вредное влияние хлорида водорода на окружающую природу и коррозионное разрушение оборудования и строений, были разработаны способы переработки НСI на хлор и хлорсодержащие продукты, которые находили достаточно широкий спрос. В те годы содовые заводы, работающие по способу Леблана, были единственными поставщиками хлорных продуктов, поэтому на них были установлены весьма высокие цены. Это позволило соответственно снизить стоимость соды, получаемой по методу Леблана, и тем самым выдерживать конкуренцию с аммиачным производством соды. Когда же с 1890 г. стал распространяться электрохимический способ получения хлора, производство соды по способу Леблана постепенно прекратилось.
По аммиачному способу Сольве соду получают из поваренной соли, раствор которой насыщают аммиаком и СО 2 с последующим прокаливанием выпавшего в осадок бикарбоната натрия. Процесс насыщения рассола аммиаком и получения бикарбоната натрия осуществляют в высокопроизводительных колоннах-аппаратах непрерывного действия. Фильтровую жидкость, остающуюся после отделения бикарбоната натрия, обрабатывают известью и паром для регенерации и возвращения в производственный цикл, содержащихся в ней аммиака и угле- кислого газа. Основные реакции аммиачно-содового процесса проводятся в жидкой среде, протекают они с большими скоростями. В результате использования дешевого сырья-раствора поваренной соли (рассола), экономного расходования топлива и механизации производственных процессов по аммиачному способу можно получать дешевую и высокого качества соду.
Процесс получения кальцинированной соды аммиачным методом можно описать следующим образом.
Кальцинированную соду получают через гидрокарбонат аммония:
4 НСО3 + NаСI = NаНСО3 + NH4 Сl. (2.2)
На содовых заводах гидрокарбонат аммония получают из NH 3 и СО2 непосредственно в водных растворах NаСI, т. е. с химической точки зрения процесс получения гидрокарбоната натрия можно объединить в виде одной реакции:
аСI + NH 3 + СО2 + Н2 О == NаНСО3 + NH4 Сl . (2.3)
Так как диоксид углерода плохо растворяется в воде в отсутствие аммиака, то практически сначала раствор NаСI (рассол) насыщают аммиаком, а затем полученный аммонизированный рассол обрабатывают диоксидом углерода, т. е. процесс проводят в две ступени. Первая ступень — поглощение аммиака — протекает в отделении абсорбции, а вторая — поглощение СО 2 -в отделении карбонизации.
Выпавший в процессе карбонизации осадок NаНСОз отфильтровывают, и далее он разлагается с получением соды:
NаНСО 3 = Nа2 СО3 + СО2 + Н2 О. (2.4)
В зависимости от конструкции печи температура разложения NаНСОз составляет 160-180°С. Эта операция протекает в отделении кальцинации. Выделяющийся диоксид углерода используют в процессе карбонизации.
Кроме основных процессов на содовых заводах осуществляется ряд побочных, не имеющих непосредственного отношения к получению соды. Образующийся по реакции хлорид аммония завод может выпускать как дополнительный готовый продукт. Однако обычно на содовых заводах аммиак регенерируют из хлорида аммония и возвращают обратно в производство. С этой целью гидрокарбонатный маточник, содержащий NH 4 Сl,обрабатывают известковым молоком
NH 4 Сl + Са (ОН)2 — 2 NH3 + 2Н2 О + СаСI2 . (2.5)
Образующийся аммиак отгоняют из раствора и направляют в отделение абсорбции. Раствор хлорида кальция является отходом производства. Эта операция регенерации аммиака протекает в отделении дистилляции. На некоторых заводах раствор хлорида кальция используется для получения продукционного СаСI 2 .
Для получения известкового молока необходим оксид кальция — СаО, который на содовых заводах получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100-1200°С. Образующийся при этом диоксид углерода
СаСО 3 — СаО + СО2 (2.6)
используют в процессе карбонизации, а известь -СаО — гасят избытком воды с получением известкового молока
СаО + Н 2 О == Са (ОН)2 . (2.7)
И, наконец, на всех содовых заводах производится предварительная очистка водного раствора хлорида натрия (сырого рассола) от примесей — солей кальция и магния с помощью Nа 2 СО3 и Са(ОН)2 . В процессе очистки образуются плохо растворимые Мg(ОН)2 и СаСО3 , выпадающие в осадок
МgСl 2 + Са(ОН)2 — Мg(ОН)2 + СаСI2 , (2.8)
СаСI 2 + Nа2 СО3 — СаСО3 + 2 NаСI. (2.9)
Осадки Мg(ОН) 2 и СаСО3 удаляют, а очищенный рассол поступает в производство. В последние годы разработан новый способ получения глинозема, соды, поташа и цемента на базе комплексного использования руд, содержащих нефелин 3Nа2 О*К2 О•4Аl2 О3 *9SiО2 . Небольшое количество соды получают из природных источников, расположенных в Западной Сибири.
Природная сода . К природным источникам соды относятся трона (Nа2 СО3 * NаНСО3 *2Н2 О), содовые озера и содовые отложения, расположенные главным образом в Западной Сибири и Кулундинской степи(Петуховская и Михайловская группа озер).
Пластовые отложения, которые служат в основном для получения соды, содержат 8-I2% Nа2 СО3 , 1,0% Nа2 SО4 , 0,5% NаСI, до 65% нерастворимых веществ и 20-30% влаги.
Нефелин. Большое значение для производства соды приобретает нефелин, в среднем соответствующий формуле 3Nа 2 О*К2 О•4Аl2 О3 *9SiО2 . При комплексной переработке нефелина на глинозем и цемент остается раствор, содержащий Nа2 СО3 и К2 СО3 , используемый для получения соды и поташа. Руды, содержащие нефелин, широко распространены. Нефелиновый концентрат, отличающийся постоянством состава и не требующий предварительной обработки — измельчения, является хорошим сырьем для производства соды при комплексной его переработке.
Таким образом, в химической промышленности выделяют несколько методов производства кальцинированной соды:
аммиачный метод,
получение соды из нефелиновых руд,
природные источники соды.
[Электронный ресурс]//URL: https://inzhpro.ru/kursovaya/objig-izvestnyaka/
В курсовой работе выбран аммиачный метод получения кальцинированной соды, который обладает следующими преимуществами: более высокое качество получаемого продукта, непрерывность процесса, возможность применения растворов NаСI, более дешевых, чем твердая поваренная соль, необходимая при способе Леблана. В целом «аммиачная сода» получается более дешевой и лучшего качества.
3. Получение кальцинированной соды аммиачным методом, .1 Характеристика основного и вспомогательного сырья
Основным сырьем в производстве кальцинированной соды являются мел или известняк и раствор поваренной соли. Аммиак служит важнейшим вспомогательным веществом, в состав готовой соды он не входит. Помимо сырья, для производства кальцинированной соды расходуют топливо, воду, пар и электрическую энергию.
Поваренная соль.
На тонну кальцинированной соды расходуется более полутора тонн поваренной соли. Поэтому содовые заводы располагают вблизи соляных месторождений. Для производства соды предпочитают пользоваться рассолами, а не твердой солью, которая значительно дороже. К рассолу, применяемому для производства соды, предъявляются определенные требования. Рассол должен быть концентрированным, с содержанием хлористого натрия 306-310 г/л. Если рассол содержит меньше хлористого натрия, его подвергают донасыщению, растворяя в нем твердую поваренную соль. Донасыщение рассола является относительно простой операцией, но она вызывает удорожание рассола. Работать с разбавленными рассолами экономически невыгодно, так как при этом снижается производительность аппаратов, увеличивается расход пара, возрастают потери аммиака и т. п. В рассоле и твердой соли содержатся в виде примесей различные соли кальция и магния.Соли кальция и магния при насыщении рассола аммиаком и СО 2 выпадают в осадок и загрязняют аппаратуру, трубопроводы и готовую соду. Поэтому рассол подвергают предварительной очистке.
Углекислый кальций.
В содовом производстве в качестве сырья, содержащего СаСО 3 и называемого карбонатным сырьем, применяют известняк или мел. Расход карбонатного сырья составляет примерно 2000 кг на тонну соды; чтобы уменьшить издержки на транспортировку, содовые заводы обычно располагают вблизи месторождений карбонатного сырья.
Известняк — твердая и плотная горная порода, удельный вес 2,4- 2,9 г/см 3 ; мел-мягкая и пористая порода удельный вес 1,8-2,0 г/см3 . Из-за значительной пористости содержание влаги в меле доходит до 20% и выше. В меле и известняке содержатся примеси: двуокись кремния SiО2 , окислы железа Fе2 О3 , окислы алюминия Аl2 О3 , сернокислый кальций или гипс СаSО4 , углекислый магний МgСО3 и др. Большая часть этих примесей отрицательно влияет на процесс обжига и на качество получаемой извести. Из-за повышенного содержания влаги в меле необходимо расходовать тепло на ее испарение. Это вызывает дополнительный расход топлива и ведет к снижению концентрации СО2 в газе известково-обжигательных печей.
К вспомогательным материалам относятся: а ммиак в производстве соды аммиачным методом совершает замкнутый цикл. После регенерации в отделении дистилляции он возвращается обратно на начальную стадию процесса. Неизбежные при этом потери компенсируются введением аммиачной воды, поступающей с заводов синтетического аммиака, а также с коксохимических предприятий. Топливо. В производстве кальцинированной соды топливо применяют в известковых печах при получении извести и в содовых печах при кальцинации гидрокарбоната натрия. Для обжига карбонатного сырья в шахтных известковых печах требуется топливо с малым содержанием летучих примесей (кокс и антрацит).
Наилучшим в этом отношении является кокс. Кокс значительно легче антрацита, поэтому при одинаковом размере кусков топлива в шихте находится больше кусков кокса и следовательно, в ней больше очагов горения. Кокс содержит меньше летучих веществ, и благодаря этому потери тепла с летучими у кокса в 5 раз меньше, чем у антрацита, а содержание СО2 в печном газе получается более высоким. Однако стоимость кокса более высокая, чем антрацита. (В сравнении с коксом антрацит имеет более высокую плотность, поэтому он сгорает медленнее пористого кокса, снижая производительность печи. Антрацит содержит больше летучих веществ).
При оценке качества топлива имеет значение его зольность. Зола, содержащая SiО 2 и полуторные оксиды, способствует шлакообразованию в печи. Топливо, содержащее свыше 10% золы, не рекомендуется применять для обжига карбонатного сырья в содовом производстве. Теплота сгорания антрацита и кокса в зависимости от влажности и месторождения составляет 27200 — 29 300 кДж/кг. Не исключена возможность применения в качестве топлива для обжига карбонатного сырья природного газа. Он является наиболее дешевым беззольным высококалорийным топливом (теплота сгорания около 35700 кдж/кг).
Вода . На содовых заводах вода потребляется в основном для охлаждения жидкостей и газов (в летнее время расходуется около 200 000 м3 воды в сутки).
Сравнительно меньше ее расходуют на чисто технологические нужды, например, на приготовление рассола, известкового молока и т. д. В настоящее время на заводах стараются использовать так называемую оборотную воду, получаемую охлаждением уже использованной в холодильниках воды, в специальных установках — градирнях, брызгальных бассейнах и др. Следует отметить, что отход содовых заводов — СаСI2 способствует повышению жесткости воды в близлежащих водоемах и делает иногда ее непригодной для использования.
Водяной пар, .2 Физико-химические характеристики основных стадий процесса
Рассмотрим физико-химические основы стадии обжига известняка.
Источником тепла при обжиге служит топливо — кокс или антрацит, которое перед загрузкой в печь смешивают с карбонатным сырьём. Таким образом, топливо сгорает среди кусков известняка (или мела), отдавая ему и воздуху, поступающему в печь, тепло горения. При достаточном количестве воздуха углерод топлива, реагируя с кислородом воздуха, образует углекислый газ:
С + О 2 → СО2 + 94,25 ккал (3.2.1)
При недостатке воздуха происходит неполное сгорание углерода — только до окиси углерода:
С + 1/2О 2 → СО + 26,15 ккал (3.2.2)
Как видно из уравнений, при неполном сгорании топлива выделяется значительно меньше тепла. Чтобы предотвратить потери тепла от неполноты сгорания топлива, в печь подают обычно избыток воздуха сверх теоретически необходимого. Избыток воздуха снижает концентрацию СО 2 в печном газе. В содовом производстве стремятся получить газ с максимально возможной концентрацией СО2 . Поэтому избыток воздуха в известковых печах допускается очень малый — не более 5% сверх теоретического. Для полного сгорания топлива при столь малом избытке воздуха имеет большое значение равномерное распределение среди кусков карбонатного сырья как топлива, так и воздуха, поступающего в печь для горения топлива. Последнее возможно только при наличии одинакового сопротивления шихты по всему поперечному сечению печи. При обжиге известняка расход воздуха для получения 1 т извести составляет 1000 м3 .
Образовавшаяся при неполном сгорании углерода топлива окись углерода, встречаясь при дальнейшем движении в печи с кислородом, при достаточно высокой температуре может с ним реагировать, полностью сгорая до углекислого газа:
СО + 1/2О 2 → СО2 + 68,1 ккал. (3.2.3)
О соблюдении правильного технологического режима при горении топлива можно судить по содержанию кислорода в печном газе (его должно быть не менее 1 %) и окиси углерода (содержание её не должно превышать 0,5%).
Процесс горения топлива в печи состоит из нескольких стадий. Вначале из топлива удаляется влага и оно подсушивается; затем из топлива выделяются летучие вещества и оно нагревается до температуры воспламенения; наконец, топливо в присутствии кислорода воздуха сгорает.
В соответствии с этими процессами в печи условно различают несколько зон: подсушки, подогрева и горения топлива, а также зону охлаждения.
При горении топлива в слое высота зоны горения, в которой расходуется кислород воздуха, очень незначительна и равна всего 2-3 диаметрам кусков топлива. Вследствие этого происходит частичное восстановление СО 2 раскалённым углеродом до окиси углерода:
СО 2 + С = 2СО — 37 ккал (3.2.4)
При уносе СО из топочного пространства резко возрастают потери топлива вследствие недожога.
В шихте шахтных известково-обжигательных печей содержится не более 10% топлива, которое распределено в негорючей массе — «разбавлено» известняком (мелом) — и потому не составляет сплошного слоя. Благодаря этому резко увеличивается длина зоны горения, достигая 50 — 75 диаметров среднего куска топлива. Выделяемое тепло расходуется на разложение СаСО 3 в зоне горения, поэтому температура газов в этой зоне не превышает 1200- 1300 °; в результате восстановления СО2 до СО не наблюдается.
Длина зоны горения может резко колебаться, если размеры кусков топлива не будут соответствовать размерам кусков известняка. В шахтной печи куски обжигаемого известняка являются своеобразной колосниковой решёткой, на которой происходит горение топлива. При больших промежутках между кусками известняка топливо будет проваливаться несгоревшим и удаляться из печи неиспользованным.
Причины образования окиси углерода в шахтных печах.
Для того чтобы в печных газах содержалось меньше окиси углерода, необходимо хорошее перемешивание газов в печи, обеспечивающее дожигание окиси углерода. Это достигается двумя путями: увеличением давления дутья (т.е. увеличением скорости газов в печи) и уменьшением мелких фракций в известняке (менее 40 мм в поперечнике).
Содержание СО в газах растёт также при большом количестве мелочи в первоначальной шихте и при образовании её в печи вследствие неправильной загрузки шихты или растрескивании кусков карбоната кальция.
Другой причиной увеличения содержания окиси углерода в печном газе может явиться повышенный расход топлива. Тепло, выделяющееся при сгорании избыточного топлива, будет расходоваться только на нагрев газов и извести. Температура газов при этом резко возрастает и возрастает и возникнут благоприятные условия для образования зоны восстановления СО 2 до окиси углерода. Увеличение дутья в таких случаях вредно, так как способствует повышению температуры в печи и дальнейшему увеличению концентрации СО в отходящих газах. Снизить содержание окиси углерода в печном газе можно путём уменьшения количества топлива в шихте, так как при этом соответственно уменьшится количество выделяемого тепла, температура в зоне горения понизится и процесс восстановления СО2 прекратится.
При повышении температуры в зоне горения не только увеличивается содержание СО в газах, но начинается также интенсивное образование плавов («козлов») в печи. Следовательно, повышение содержание окиси углерода в газах печи, работающей не нормальном дутьевом режиме, указывает на опасность образования «козлов». В этом случае нельзя уменьшать отбор извести из печи, так как уменьшение скорости движения шихты будет способствовать взаимодействию СаО с шамотной футеровкой.
Снижение температуры в зоне горения за счёт уменьшения нормы расходы топлива не достигает цели, так как новая шихта проходит зону подсушки и достигает зоны горения только через 5 — 10 часов. За это время в печи может образоваться «козел». Более эффективной мерой является уменьшение дутья; при этом уменьшается количество сгораемого топлива, т.е. количество выделяющегося тепла в единицу времени.
В результате уменьшения дутья без снижения отбора извести в кожухе печи повышается температура и возрастают потери тепла с выгружаемой известью.
Таким образом, присутствие окиси углерода в печных газах объясняется не только недостатком воздуха в печи. Окись углерода является одним из первичных продуктов горения твёрдого топлива независимо от количества подводимого воздуха.
Содержание окиси углерода в газах зависит от условий догорания СО в печи, т.е. от перемешивания газов, а также от наличия в печи зоны восстановления. При нормальных условиях эксплуатация печей зона восстановления обычно не образуется.
Снижение содержания СО в газах на 1% может сберечь примерно 7 кг условного топлива на тонну извести.
Разложение карбоната кальция
Необходимые для производства соды известь и углекислый газ получают путём обжига карбонатного сырья — известняка или мела, основной составной частью является CaCO 3 — углекислый кальций, или карбонат кальция.
При обжиге углекислый кальций разлагается по реакции:
CaCO 3 = CaО + СО2 ↑ — 42,5 ккал (3.2.5)
Удаление углекислого газа из сферы реакции способствует разложению углекислого кальция. При проведении реакции в закрытом сосуде разложение CaCO 3 прекращается по достижению равновесного давления СО2 над CaCO3 . Если создать давление СО2 выше равновесного, то реакция пойдёт в сторону образования CaCO3 .Равновесное давление СО2 над CaCO3 зависит только от температуры.
Начало разложения CaCO 3 в атмосфере, не содержащей СО2 , соответствует температуре около 580 °С. В известково-обжигательной печи в процессе обжига в газе присутствует СО2 , которая затрудняет разложение углекислого кальция. Максимальное давление СО2 в печном газе составляет 300 мм рт. ст. Из таблицы видно, что при таком давлении углекислого газа разложение CaCO3 наступает только при температуре около 840 °С. Однако эта начальная температура разложения практически относится лишь к поверхностным слоям кусков известняка (или мела), откуда выделяющийся углекислый газ может уноситься потоком газов, омывающих куски. По мере продвижения границы разложения вглубь куска удаление углекислого газа из его внутренних частей затрудняется, и практически давление СО2 над поверхностью неразложенной части куска становится равным 1 атм, если обжиг ведётся при атмосферном давлении. Следовательно, температура, необходимая для разложения внутренних частей кусков мела или известняка, практически поднимается до 900 °С, когда давление СО2 над СаСО3 становится равным 1 атм. Таким образом, в зоне обжига известково-обжигательной печи нижний предел температуры равен 900 °С.
Разложение СаСО 3 идёт с поглощением 42,5 ккал тепла на 1 г*моль СаСО3 , как это показано в уравнении. Поэтому в процессе обжига температура обжигаемого куска не может подняться до температуры обжигающих его горячих газов, пока процесс разложения в нём полностью не закончится. Разложение мелких кусков заканчивается раньше, чем крупных. Поэтому температура мелких кусков в зоне обжига может быть выше, чем крупных.
Повышение температуры извести выше 1200 °С способствует образованию так называемого «перекала», или «пережога». При этом известь получается более плотной, т.е. менее пористой, с менее развитой поверхностью. Такая известь плохо гасится водой и обладает меньшей реакционной способностью. Практика показывает, что «перекал» наблюдается главным образом у мелких кусков.
Скорость разложения карбоната кальция (т.е. количество разложившегося СаСО 3 на 1 см3 поверхности куска в единицу времени) в большой степени зависит от температуры. Чем выше температура обжига, тем больше СаСО3 разложится в единицу времени.
Разложение карбоната кальция не захватывает всю толщу куска, а происходит от поверхности в глубь куска. Границу раздела между слоем образовавшейся извести и неразложенным карбонатом кальция можно различить по внешнему виду и таким образом определить толщину неразложившегося слоя. О скорости разложения СаСО 3 судят по времени, затраченному на полный обжиг кусков определённого размера и формы. Так как куски СаСО3 в зависимости от формы (куб, цилиндр, и шар) при одинаковых размерах (высота, диаметр) разлагаются в различные промежутки времени, необходимо для выяснения влияния температуры на скорость разложения применять куски, одинаковые по размерам и форме.
Если величину радиуса шара разделить на время, в течение которого происходила диссоциация, то можно получить среднюю скорость продвижения границы разложения в глубь куска. Такой способ выражения скорости удобен тем, что позволяет приближённо оценить время, необходимое для разложения любого куска СаСО 3 .
Влияние температуры окружающей среды на скорость продвижения границы в глубь куска показано на графиках (рис.1).
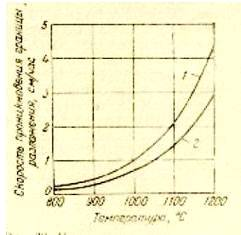
Рис. 1. Зависимость скорости разложения от температуры среды
Кривая 1 характеризует куски мела цилиндрической формы, кривая 2 — куски известняка неправильной формы. Скорость продвижения границы разложения резко повышается с ростом температуры.
Причины образования неактивной извести. При обжиге карбоната кальция образуется некоторое количество неактивной извести, т.е. извести, которая в обычных условиях гашения не реагирует с водой. Неактивная известь при очистке известкового молока попадает в отброс, являющийся потерей, которую, однако, можно значительно уменьшить путём размола и повторного гашения измельченных отбросов.
По результатам химического анализа неактивной извести можно судить о том, что в ней содержится повышенное количество примесей по сравнению с обычной известью. В состав неактивной извести входят продукты, образовавшиеся при взаимодействии СаО с различными веществами при высокой температуре обжига.
Взаимодействие окиси кальция с кремнезёмом.
Кремнезём (SiO 2 ) является постоянным спутником карбонатных пород; он находится в породе в виде отдельных включений или равномерно распределён в ней по всей массе. Содержание SiO2 в известняке и меле, применяемых на содовых заводах, обычно не превышает 3,0 — 3,5%.
Чистый кремнезём плавится при температуре 1713 °С. В реакцию с СаО он вступает в твёрдом состоянии уже при 700 — 800 °С. Реакция взаимодействия протекает тем быстрее и полнее, чем равномернее распределён SiO 2 в известняке и чем выше температура в зоне обжига.
В результате взаимодействия окиси кальция с кремнезёмом образуется главным образом двухкальциевый силикат с температурой плавления 2130°С
СаО + SiО 2 = 2СаО* SiО2 (3.2.6)
Двухкальциевый силикат существует в нескольких формах; переход из одной формы в другую сопровождается рассыпанием материала.
Силикаты кальция являются весьма тугоплавкими соединениями; при температуре 1300 °С они не образуют плава, но способствуют расплавлению других соединений, растворяясь при этом в образовавшемся плаве.
Окись кальция, связанная с кремнезёмом, представляет собой безвозвратные потери; в производстве соды такая известь не может быть использована.
Взаимодействие окиси кальция с окислами железа и алюминия. Окислы железа и алюминия, как и SiО 2 , являются непременными спутниками карбонатных пород. Окись железа часто обусловливает жёлтую или бурую окраску природного карбоната кальция. Окислы железа и алюминия входят также в состав золы топлива и шамота.
При взаимодействии СаО с окисью железа могут образовываться ферриты: СаО*Fe 2 O3 с температурой плавления 1225 °С и двухкальциевые 2СаО*Fe2 O3 с температурой плавления 1300 °С. Такие температуры характерны для зоны обжига и поэтому в присутствии окиси железа возможно образование плавов в печи (так называемых «козлов»).
Ферриты кальция, отличаясь легкоплавкостью, способствуют понижению температуры плавления других соединений.
Большое влияние оказывает окись железа на стойкость футеровки; при высоких температурах стойкость шамота к окислам железа невелика.
Окись алюминия, или глинозём (Аl 2 O3 ), образует с окисью кальция моноалюминат кальция СаО*Аl2 O3 , который постепенно переходит в трёхкальциевый алюминат 3 СаО*Аl2 O3 (температура плавления 1530 °С).
Это соединение обволакивет зёрна окиси кальция нереакционной плёнкой, превращая активную известь в неактивную.
Влияние карбоната магния
При диссоциации природного карбоната кальция разлагается также карбонат магния MgCO 3 , всегда содержащийся в известняке и меле.
Образующаяся окись магния менее активна, чем окись кальция, поэтому она не вступает во взаимодействие с другими примесями.
MgCO 3 = MgO + CO2 ↑ — 28 ккал. (3.2.7)
Затраты тепла на разложение карбоната магния меньше, чем для карбоната кальция.
3 Описание технологической схемы производства извести и известкового молока.
Станция обжига известняка является одной из первых стадий технологической схемы получения кальцинированной соды.
Карбонатное сырьё подаётся в цех известковых печей в вагонетках воздушно-канатной дороги.
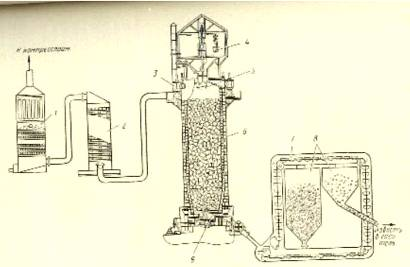
Рис.2 Технологическая схема производства извести и известкового молока
В каждую вагонетку при помощи специального дозатора добавляют отвешенное количество топлива. После этого шихта загружается в печь 1 (рис 1).
При сгорании топлива выделяется тепло, необходимое для разложения карбоната кальция. Полученная известь при помощи выгрузного механизма подаётся на кольцевой ковшовой транспортёр 2, который доставляет её в бункер 3. Один из бункеров служит для хранения извести, из второго бункера расходуются известь на приготовление известкового молока. Известь можно подавать на гашение ковшовым транспортёром и из запасного бункера. В гаситель извести 4, кроме извести, поступает также из напорного бака 9 подогретая вода и из бака 8 — слабое известковое молоко.
Для отделения непогасившихся кусков извести полученное известковое молоко поступает на шестигранное сито 5. После такой предварительной грубой очистки известковое молоко поступает на вибрационный грохот 6, где отделяются куски недопала и перепала, называемые мелкими отбросами. Так как отбросы обычно увлекают за собой некоторую часть активной извести, их тщательно промывают водой; полученное при этом слабое известковое молоко собирают в сборник 8 и направляют обратно в гаситель извести. Очищенное известковое молоко поступает в сборник 7.Образующийся в известковых печах газ отсасывают при помощи компрессоров и направляют для очистки сначала в промыватель 10, а затем в электрофильтр 11.
4 Характеристика используемых химических реакторов
Производство извести из известняка осуществляется путем термического разложения известняка (обжигом).
Обжиг известняка может производится в печах различной конструкции: шахтных, вращающихся, механических полочных и кипящего слоя.
Вращающиеся печи для обжига извести позволяют получать мягкообожженную известь высокого качества из известняка и мягких карбонатных пород (мела, туфа, ракушечника) в виде мелких кусков. Вращающиеся печи допускают возможность полной механизации и автоматизации процесса обжига. Наконец, в них можно применять все виды топлива — пылевидное твердое, жидкое и газообразное. Расход условного топлива во вращающихся печах значителен и достигает 25 — 30% массы извести, или 6700 — 8400 кДж на 1 кг.
Недостатки вращающихся печей — большой расход металла на 1 т мощности, повышенные капиталовложения и значительный расход электроэнергии.
Для обжига извести применяют вращающиеся печи длиной 30 — 100 м, диаметром 2 — 4 м, с углом наклона 3 — 4˚ и частотой вращения 0,5 — 1,2 об/мин. Удельная суточная производительность их достигает 500 — 700 кг/м 3 в расчете на полный объем обжигательного барабана.
Обжиг известняка в кипящем слое по технико-экономическим показателям характеризуется высоким съемом и повышенным расходом топлива — 4600 — 5480 кДж на 1 кг извести. Обжиг материала в условиях кипящего слоя высотой до 1-1,2 м длится 10-15 мин. Работа этих печей легко поддаётся полной автоматизации. Применение в известковой промышленности установок для обжига карбонатных пород в кипящем слое позволяет рационально использовать большие количества мелких фракций сырья, образующихся обычно на карьерах, а также на заводах, оборудованных шахтными печами и даже вращающимися печами.
Недостатком этих установок является повышенный расход топлива и электроэнергии.
Обжиг измельченного известняка в механических полочных печах (во взвешенном состоянии) в опытном порядке осуществляют в циклонных топках. В них тонкоизмельченные частички карбонатного сырья увлекаются потоком раскаленных газов и обжигаются. Осаждается обожженная известь из газового потока в пылеосадительных устройствах.
Наибольшее распространение получили шахтные печи, представляющие собой полый цилиндр, имеющий наружный стальной кожух толщиной около 1 см и внутреннюю огнеупорную кладку, вертикально установленный на фундаменте. Эти печи характеризуются непрерывностью действия, пониженным расходом топлива и электроэнергии, а так же простотой в эксплуатации. Строительство их требует относительно небольших капиталовложений.
В зависимости от вида применяющегося топлива и способа его сжигания различают шахтные печи, работающие на короткопламенном твёрдом топливе, вводимом обычно в печь вместе с обжигаемым материалом; т.к. известняк и кустовое топливо при этом загружают в шахту перемежающимися слоями, то иногда такой способ обжига называют пересыпным, а сами печи — пересыпными; на любом твердом топливе, газифицируемом или сжигаемом в выносных потоках, размещаемых непосредственно у печи; на жидком топливе; на газовом топливе, натуральном или искусственном.
Расход условного топлива в этих печах примерно 13-16% массы обожжённой извести или 3800-4700 кДж на 1 кг.
Недостатки шахтных печей: известь загрязняется золой и остатками не сгоревшего топлива. Возможно так же образование значительного количества пережога вследствие соприкосновения раскалённых кусков антрацита или кокса с обжигаемым материалом. Это особенно заметно при нарушении теплового режима и чрезмерным форсированием печей за счёт высоких температур обжига.
Выбор типа печи для обжига извести определяется производительностью завода, физико-механическими свойствами и химическим составом известняка, видом топлива и требуемым качеством извести.
В данной курсовой работе для производства оксида кальция из известняка путем обжига была выбрана вертикальная шахтная пересыпная печь. Отличающаяся от других печей экономичностью, большой производительностью и высоким тепловым коэффициентом полезного действия (70-80%).Высокий тепловой коэффициент полезного действия печи (для тепла, затраченного на реакцию разложения известняка) обеспечивается следующими основными факторами:
- противотоком газовой и твердой фаз, обеспечивающим хороший рекуперативный эффект (с отходящим газом теряется 5-8% тепла, с выгружаемой известью — 3-4%);
- хорошей теплоизоляцией высокотемпературных зон (в окружающую среду теряется ~ 3% тепла);
- малой влажностью сырья (на испарение влаги затрачивается только около 0,5% тепла);
- Степень обжига, т.е.
степень превращения CaCO 3 в CaO ,составляет 92-94%.
Печь диаметром 6,2 м высотой 22,6 м обеспечивает получение 300-310 т/сутки стандартной (85% CaO) извести.
Конструкция известково-обжигательной печи.
Печь состоит из трёх основных частей — шахты, загрузочного и разгрузочного механизмов.
Вертикальная кирпичная шахта известковых печей может иметь различные размеры. Встречаются печи с внутренним диаметром шахты от 2,3 до 8 м и высотой от 12,3 до 36,6 м. С увеличением диаметра печи растёт её производительность, которую характеризуют величиной съёма извести с 1 м 2 внутреннего сечения шахты. Увеличение диаметра печи связано, однако, с трудностью равномерного распределения по её сечению шихты и воздуха. Увеличение высоты печи снижает потери тепла с уходящими известью и газом, что уменьшает расход топлива и увеличивает концентрацию СО2 в газе. С другой стороны с увеличением высоты печи растёт сопротивление слоя шихты, а, следовательно, расход энергии на подачу воздуха. Растут также расходы на подъём карбонатного сырья и топлива.
Современная форма печей составляет диаметром шахты 6,2 и высотой 22,6 м. Форма шахты цилиндрическая.
Внутри шахта выложена огнеупорным кирпичом 4 (шамотным или хромомагнезитовым).
Шамотный кирпич содержит около 40% Аl 2 O3 и 60% SiO2 . Его огнеупорность (или температура размягчения) лежит в пределах 1580 — 1770 °С. Начало его деформации под нагрузкой 2 кг/см2 наблюдается уже в пределах температур 1190 — 1500 °С. Поэтому при температурах в зоне обжига выше 1200 °С может оплавиться футеровка. Хромомагнезитовый кирпич имеет огнеупорность 2000 °С и под нагрузкой 2 кг/см2 температуру начала деформации 1450 — 1680 °С, т.е. он значительно надёжнее и может находиться в работе между капитальными ремонтами дольше, чем шамотный кирпич.
Огнеупорный кирпич, предназначенный для футеровки известковых печей, следует хранить в крытых складах и оберегать от повреждений. Попадание влаги на шамот ухудшает его качество. Повреждённый кирпич быстрее выходит из строя. Кладка печи ведётся на связывающем материале — шамотном порошке, просеянном через сито с отверстиями не более 1 мм и смешанном с водой до концентрации сметаны. Нельзя допускать попадания в шамотный порошок известковой пыли, так как при обжиге это может вызвать образование плава в стыках между кирпичами и и разрушение футеровки.
Наружная часть шахты выложена обыкновенным красным кирпичом 3, между кладками из огнеупорного 4 и красного кирпича оставлен зазор 2 шириной 25 мм, заполненной теплоизоляционной прослойкой или дроблёным шамотом, в который также нельзя допускать попадания извести, чтобы не образовывались легкоплавкие соединения. Благодаря зазору огнеупорная кладка может свободно расширяться при нагревании, что предохраняет её от образования трещин. Шахту обычно окружает стальной кожух толщиной 12 мм. Между кожухом и кладкой печи также оставлен зазор шириной 60 мм, заполненный битым шамотом. Зазоры играют также роль теплоизоляции. Дроблёный шамот препятствует перемешиванию воздуха в зазорах путём конвекции, снижая тем самым интенсивность теплопередачи.
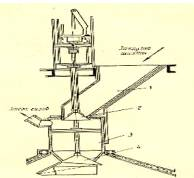
Шахта печи опирается на чугунное кольцо, расположенное на восьми опорных колоннах 1, которые стоят на бетонном фундаменте 9 и принимают на себя всю нагрузку. Сверху шахта закрыта железобетонным сводом, к которому крепится загрузочное устройство 5, способствующее равномерному распределению шихты по сечению печи. Шихта состоит из кусков различной величины. Скопление мелких кусков создаёт более высокое сопротивление прохождению газа, чем крупных. Для равномерного распределения в объёме печи поступающего воздуха надо, чтобы сопротивление шихты было одинаковым. Для приближения к этому требованию надо по возможности равномерно распределять куски различного размера. Необходимо также, чтобы верхний уровень загружаемого материала был близок к горизонтальному. Выполнение этих требований и обеспечивает загрузочное устройство 5. Кроме того, оно должно предохранять от проникновения печного газа, содержащего вредную окись углерода, в рабочее помещение во время загрузки шихты.
Шихта из вагонеток, поступивших в отделение известковых печей по воздушно-канатной дороге, высыпается в загрузочную воронку 1, которая снизу прикрывается конусным затвором 2, предохраняющим от проникновения печного газа в рабочее помещение. Во время опускания конусного затвора при помощи специального пневматического устройства шихта из загрузочной воронки попадает в промежуточный бункер 3, который также закрыт снизу конусным затвором 4, называемым распределительным конусом. Основание этого конуса срезано таким образом, что линия среза образует спиральную линию. С укороченной стороны распределительного конуса прикреплён изогнутый стальной лист — отбойник 1. При опускании конуса шихта из промежуточного бункера попадает на поверхность конуса. Скатывающиеся по его длинной стороне куски попадают ближе к периферии печи, а скатывающиеся по укороченной стороне отбрасываются отбойником ближе к центру печи. Различная длина образующей конуса и наличие отбойника позволяет разбрасывать шихты по всему сечению печи. Чтобы падающая с распределительного конуса шихта шире разбрасывалась по сечению печи, расстояние между конусом и уровнем шихты в печи поддерживают около 1,5 — 2,5 м. Кроме того, равномерное распределение шихты по сечению печи обеспечивается автоматическим вращением распределительного конуса на угол 60° при каждом его опускании.
При загрузке шихты, когда промежуточный бункер снизу открыт, в него попадает газ из печи. Чтобы предотвратить дальнейшее его проникновение в рабочее помещение при опускании верхнего конуса, газ из промежуточного бункера отсасывается специальным вентилятором. Наличие двух конусных затворов и отсасывание газа надёжно предохраняет рабочее помещение от проникновения печного газа.
Стремление избежать при загрузке в печь известняка и кокса разделения различных по размеру кусков на отдельные фракции привело к созданию конструкции загрузочного устройства с вращающейся воронкой. Вагонетки с шихтой разгружают обычно с одной стороны загрузочной воронки. При этом более крупные куски откатываются дальше от места разгрузки, чем мелкие, т.е. происходит разделение кусков на разнородные фракции, и что особенно нежелательно, куски топлива как более мелкие неравномерно распределяются среди кусков карбонатного сырья. Избежать этого можно, если загружать шихту в воронку с нескольких сторон. Для этого загрузочная воронка после опорожнения каждой вагонетки поворачивается на 60° при помощи механизма.
Для выгрузки печь снабжена специальным выгрузным устройством 8. Основное требование предъявляемое к выгрузному устройству, — равномерная выгрузка извести по всей периферии печи, что обеспечивает равномерную работу печи по всему её сечению.
Основная часть выгрузного механизма — улита 5. Она представляет собой винтовую поверхность, образующую конус с вершиной, обращённой кверху. При медленном вращении такого устройства (0,5 — 2 об/ч) известь, находящаяся на наклонной винтовой поверхности, скользит по ней вниз, увлекая за собой лежащие сверху куски. Известь как бы вывинчивается из шахты печи. Благодаря сходству с раковиной улитки, а также из-за медленности вращения механизма, незаметного на глаз, это выгрузное устройство называют «улитой».
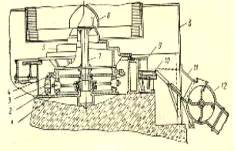
Улита лежит на восьми роликах 2, опираясь на них стальным кольцом, и катится по круговому рельсовому пути 1. Вращается улита при помощи передачи, состоящей из венцовой шестерни 4, обращённой зубьями вниз, и приводной шестерни 3, связанной через систему передач с электромотором. При вращении улиты известь по всей периферии равномерно выгружается на концентрически расположенный неподвижный кольцевой стол 9, с которого по мере накопления ссыпается на находящейся ниже круговой транспортёр 10, проводимый в движение самостоятельным мотором. При его вращении известь сбрасывается в течку 11 при помощи неподвижного ножа, укреплённого над транспортёром у течки. Затем лопастный выгружатель 12, называемый трефелем, выгружает известь на ленточный транспортёр и далее на ковшовый транспортёр.
По оси улиты расположен полый вал 7, предохраняемый сверху от попадания извести колпаком 6. По этому валу под колпак подаётся воздух. Для подачи воздуха имеется специальный вентилятор, способный преодолевать сопротивление шихты 220 — 370 мм вод. ст. Наличие внизу давления нагнетаемого воздуха заставляет герметизировать весь выгрузной механизм, для чего низ печи закрыт кожухом 8.
Газ из печи отсасывается вверху шахты в общий коллектор 6, проходящий вдоль всех печей, откуда поступает на охлаждение и очистку от пыли. Каждая печь имеет выхлопной газоход в атмосферу, через который отводится избыток газа, а также газ, отсасываемый из загрузочного бункера.
5 Характеристика отходов, проблемы их обезвреживания и полезного использования
обжиг известняк печь шахтный
В производстве кальцинированной соды отходами являются: меловая или известняковая мелочь, получаемая при добыче карбонатного сырья, отбросы после гашения извести и приготовления известкового молока и дистиллерная жидкость.
Меловая и известняковая мелочь, образующаяся при добыче карбонатного сырья, может быть использована для получения извести, производства цемента и строительных материалов, а также для других целей. Из меловой мелочи приготовляют молотый мел, применяемый в строительстве.
При выработке каждой тонны соды получается около 8 м 3 дистиллерной жидкости, представляющей собой раствор хлористого кальция и хлористого натрия, загрязненный различными примесями (углекислый кальций, гипс, гашеная известь, песок и др.).
В производстве кальцинированной соды отбросная дистиллерная жидкость накапливается в специальных хранилищах, называемых «белыми морями» и представляющих обвалованные участки площадью 100 и больше гектаров.
Наряду с уменьшением количества отбросной жидкости и путем максимального увеличения коэффициента использования натрия отходы содового производства можно утилизировать следующим образом: получать азотные удобрения и хлористый кальций в виде товарного продукта. При выработке хлористого кальция из отбросной жидкости одновременно получается и поваренная соль, которая может быть использована как товарный продукт или как сырье в производстве соды.
Отходами производства гашеной извести являются углекислый газ (СО 2 ), окись углерода (СО) и известковая пыль. Особое внимание, в частности, необходимо уделять предотвращению появления в помещениях углекислого газа (СО2 ), окиси углерода (СО) и известковой пыли. Повышенная опасность отравления углекислым газом и окисью углерода имеется на загрузочной площадке шахтных и вращающихся печей. Поэтому сырье загружают только с помощью механизмов (скиповых, шахтных и других подъемников), не требующих присутствия на загрузочной площадке людей.
Пыль, содержащая гашеную и особенно негашеную известь, раздражающе действует на органы дыхания, слизистые оболочки и влажную кожу. Поэтому необходимо в местах выделения известковой пыли устраивать отсосы, оборудовать помольные агрегаты эффективными обеспыливающими устройствами, а весь транспорт и бункера герметически закрывать кожухами, крышками и т. д. Известняковая мелочь, образующаяся при добыче карбонатного сырья, может быть использована для получения извести, производства цемента и строительных материалов, а также для других целей. Из меловой мелочи приготовляют молотый мел, применяемый в строительстве.
Таким образом, проблеме ликвидации отходов в производстве соды уделяется большое внимание.
3.6 Технологические расчеты
Исходные данные:
Производительность Q= 210 тонн известняка/сутки =8750 кг/ч известняка
Состав известняка (в %):
CaCO 3 — 92,5
MgCO 3 — 1,5
H 2 O — 1,5
Примеси 4,5 (SiO 2 : Аl2 O3 : Fе2 O3 = 1,2 : 0,8 : 1,0)
Состав кокса (в %)
C 89,0
Зола 8,0
H 2 O 3,0
Коэффициент избытка кислорода α 1,06
Обогащение кислорода до 29 об. %
Степень обжига известняка (%) 93 [2, с.38]
Неполнота сгорания углерода кокса (в %) 1,1 [2]
Относительная влажность воздуха (в %) 75 [4,приложение III, с.478]
Температура поступающего воздуха (в о С) 16 [4,приложение III, с.478]
Температура отходящих газов (в о С) 112
Температура выгружаемой извести (в о С) 50 [1]
Температура поступающего известняка (в о С) 16
Температура поступающего кокса (в о С) 16
Состав воздуха (в % масс.):
О 2 23,1
N 2 +инертные газы 76,9
3.6.1 Расчет материального баланса
I) Горение топлива (в расчете на 1,00 кг кокса)
- Расчет массы веществ в коксе определяем по формуле
W В = mВ *100% / m кокса
m В = WВ * mизв /100%,
где W В — массовый процент вещества в коксе, %;
m В — масса вещества, кг;
m кокса — масса кокса, кг.
m В = WВ * mизв /100%
,00 кг кокса содержит (в кг):
m С = 89*1 / 100 = 0,89 кг С в коксе
m золы = 8*1 / 100 = 0,08 кг золы
m H 2 O = 3*1/ 100 =0,03 кг H2 О
Итого кокса: 1,00 кг
- Масса сгоревшего углерода с учетом степени сгорания составляет
m С сгор.. = mС * ŋ обжига,
где m С — масса углерода в коксе, кг;
ŋ обжига — степень сгорания кокса ,%.
m С сгор. = 0,89*0,989 = 0,88021 кг С сгор.
3. Для того, чтобы узнать сколько сгорает углерода до СО и СО 2 необходимо определить соотношение СО : СО2 в газах по константе равновесия реакции Будуара
СО + О 2 =2 СО2 или СО + ½ О2 = СО2 (3.6.1.)
Для этой реакции константа равновесия запишется (через активности компонентов):
К р = а СО2 / а СО * (а О2 )1/2 или через парциальные давления компонентов
К р = Р СО2 / Р СО * (Р О2 )1/2
К р в зависимости от температуры имеет
К р =( 29791/Т ) + (0,169*10-3 *Т) — (0,324*105 / Т2 ) — 9,495, [6, таблица 41, с.64]
где Т- температура в Кельвинах.
Рассмотрим температуру в диапазоне 1200- 1250 0 С или 1473-1523 К (поскольку температура в зоне обжига составляет 12500 С)
При Т= 1473 К: К р = 9,19*1010 или √ Кр = 3,03*105
При Т=1498 К: К р = 4,27*1010 или √ Кр = 2,07*105
При Т= 1523 К: К р = 2,04*1010 или √ Кр = 1,43*105
Принимаем К р = 2,04*1010 или √ Кр = 1,43*105 (Т=1523 К или 12500 С)
СО + ½ О 2 = СО2
Пусть начальное количество СО и О 2 равны стехиометрическим коэффициентам, то есть n СО,0 =1 моль, n О2,0 =0,5 моль, n СО2,0 = 0.
Обозначим через α- доля прореагировавшего вещества СО 2 , тогда конечные количества СО, О2 и СО2 равны ( моль):СО = n СО,0 — α = 1- α ; n О2 = n О2,0 — 0,5* α =0,5-0,5* α= 0,5(1- α) ; n СО2 = n СО2,0 + α = α
Общее количество молей равно ∑ n =1- α + 0,5-0,5* α + α =1,5-0,5* α = 0,5(3- α)
Мольные доли компонентов равны:
к = n к /∑ n;
принимаем N к =Р к (так как идеальная газовая смесь).
Парциальные давления компонентов равны: Р СО =2* (1- α)/ (3- α); Р О2 =(1- α)/ (3- α); Р СО2 =2* α/(3- α).
Подставляя в К
