Все теории катализа старались ответить на следующие вопросы:
1. Каким образом катализатор меняет реакционную способность реагентов, обеспечивая их превращение в нужном направлении?
2. Как найти катализатор для желаемой реакции?
Ответ на второй вопрос связан с ответом на первый. Современный взгляд на проблему активации имеет в основе химический подход, учитывающий особенности гетерогенного катализа: влияние носителя (коллективные свойства), особенности взаимодействия промежуточных соединений на поверхности гетерогенного катализатора, диффузия адсорбированных молекул в подповерхностные слои катализатора, изменение катализатора под воздействием реакционной среды (реагенты, продукты) и т. д..
Первым четко сформулировал идею «оптимального» взаимодействия между реагентами и катализатором Пьер Сабатье в кн. «Катализ в органической химии». Энергия образования интермедиата должна быть не слишком мала и не слишком велика. Если реакция образования интермедиата эндотермична, а энтропия понижается, то концентрация интермедиата будет очень мала, а следовательно, скорость стадии его превращения также будет низка. Если образование интермедиата будет очень выгодно, то его концентрация будет велика, скорость его дальнейшего превращения также будет низка, поскольку он очень прочный. И энергия активации стадии его превращения будет велика.
Т.к. любой интермедиат в каталитическом процессе – это частица, где субстрат связан с металлом-катализатором, то фактически мы имеем дело координационным соединением (или частью его).
Такому соединению присущи все основные свойства, характеризующие обычные координационные соединения. И поэтому о прочности связи Кт-субстрат, и об активации субстрата можно судить с тех же позиций, которые применимы в координационной химии для связи металл-лиганд, для характеристики изменений лиганда (т.е. его активации).
Координационная связь (связь металл-лиганд).
В “классической” химической связи каждый из двух атомов, участвующих в ее образовании, вносит в ее создание 1 электрон. Координационная связь характеризуется тем, что оба электрона поставляются одним из партнеров. Партнер, поставляющий электроны, называется донором, а принимающий электроны – акцептором. Связывающая и антисвязывающая МО образуются из заполненной орбитали одного и вакантной орбитали другого партнера. Связывающая МО принимает два электрона, а антисвязывающая остается пустой. Образуется молекула, так как эта ситуация является энергетически более выгодной, чем когда два электрона находятся на изолированной орбитали донора (связывающая МО всегда энергетически ниже, чем любая из ее составляющих орбиталей).
Катализаторы. Гомогенный катализ
... катализаторами, но повышает активность катализаторов. Например, применяемый в производстве серной кислоты катализатор V2O5 повышает свою активность в присутствии оксида бария или алюминия. За счет уменьшения энергии активации путем применения катализаторов ... рассчитана по следующему уравнению, связывающему скорость процесса с химическим ... химическая реакция, удаление продукта реакции. В соответствии ...
Центральный атом переходного металла может так же, как лиганды, действовать в качестве донора. Поэтому в качестве валентных орбиталей необходимо рассматривать не только верхние занятые орбитали металла и лигандов, но также низлежащие свободные орбитали. Для атома переходного металла должны приниматься в расчет (n-1)d-, ns- и np-орбитали.
Рассмотрим октаэдрический комплекс [Co(NH 3 )6 ]3+ . Лиганд – молекула аммиака – имеет три стабильные N-H молекулярные σ-орбитали (МО), которые имеют слишком низкую энергию, чтобы принимать участие в связи с металлом; для связывания пригодна орбиталь неподеленной пары электронов на атоме азота.
Рис. 6.12. стр. 134.
Из 6 d-орбиталей металла (в октаэдрическом комплексе) только одна имеет электронную плотность, направленную таким же образом, что и электронная плотность неподеленной электронной пары лиганда. Следовательно, если d-орбиталь свободна, то может образоваться σ-связь (орбиталь неподеленной пары поставляет два электрона).
Рис. 6.13 (а), стр. 135
Разобрать: связь металл-СО
Рис. 6.13 (б), стр. 135
Итак, в координационной химии мы имеем дело с металлом-комплексообразователем (или группой металлов – это уже кластерная химия).
Атомы, окружающие металл-комплексообразователь, называются лигандами. Лиганды образуют внутреннюю координационную сферу.
Центральный атом и окружающие его лиганды называются комплексом. Важно: комплексы не теряют своих свойств при переходе из одной фазы в другую, например, при растворении соединения внутренняя координационная сфера остается без изменений.
Классификация комплексов
Основные понятия и определения.
Комплексы могут быть моноядерными (в составе комплекса – один атом металла-комплексообразователя) и полиядерными (в составе комплекса несколько атомов металла-комплексоообразователя).
Если в полиядерных комплексах атомы металла-комплексообразователя связаны прямым взаимодействием металл-металл, то такие комплексы называются кластерными.
Моноядерный комплекс – K 2 PdCl4
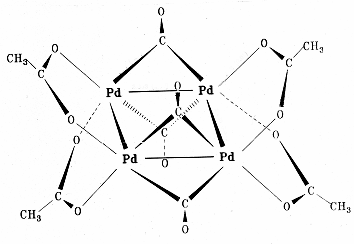
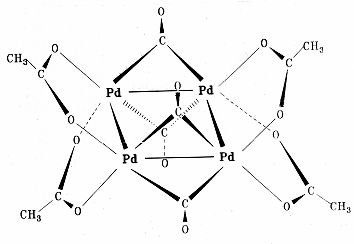
Полиядерный комплекс — [Pd(CH 3 COO)2 ]3
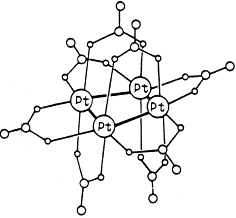
Кластерный комплекс Pt 4 (OCOCH3 )8 :
Комплексы могут быть нейтральными, катионными и анионными.
Нейтральными называются такие комплексы, в которых металл-комплексообразователь и лиганды образуют молекулу целиком.
Примеры: моноядерные: Ni(CO) 4 , Ni(C2 H4 )(PPh3 )2
Полиядерные: Pt 4 (OCOCH3 )8 ,
Сварка и резание металлов
... Контактная сварка а) точечная б) роликовая Газовая сварка металлов Газовая сварка находит широкое применение при сварке деталей малой толщины, чугуна, цветных металлов и сплавов. При газовой сварке металл ... металла, который называется сварочной ванной. После застывания металла по кромкам или дополнительного присадочного металла, введенного в сварочную ванну, образуется сварной шов. Сущность сварки ...
Катионными называются такие комплексы, в которых металл-комплексообразователь входит в состав катиона.
Примеры: моноядерные: [Co(NH 3 )6 ]Cl3
Полиядерные: [Pd 4 (µ-CO)2 (Phen)4 ](OCOCH3 ]4
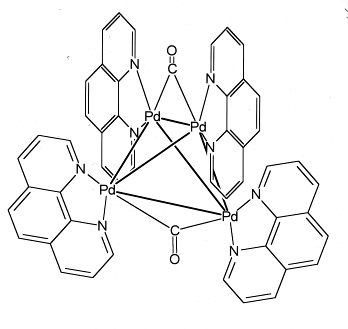
Анионными называются такие комплексы, в которых металл-комплексообразователь входит в состав аниона.
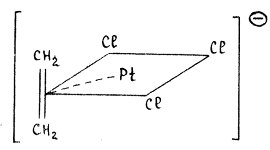
Примеры: K 2 PdCl4 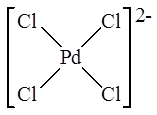 ,
,
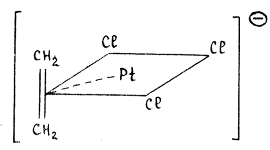
соль Цейзе
ФСО
ФСО в комплексном соединении определяется как средний заряд атомов металла, который они имеют после удаления лигандов.
В классической координационной химии принимается, что у уходящих лигандов (например, таких, как H — , Cl— , O2- , OH— , NH2- , NR2 — , NR2- и т.д.) электронная оболочка атома, связанного с металлом, соответствует оболочке атома ближайшего инертного газа. Лиганды CO, N2 , CO2 , C2 H2 , C2 H4 , PR3 и т.д. удаляются в виде нейтральных молекул. Поэтому для определения ФСО металла в комплексном соединении в первую очередь обращают внимание на заряд лигандов. Так, в карбонилфосфиновых кластерах палладия, имеющих состав Pdx (CO)y (PR3 )z (к этой группе относятся кластеры, различающиеся ядерностью и строением металлоостова, например Pd7 (μ3 -CO)4 (μ-CO)3 (PMe3 )7 ,Pd10 (CO)12 (PBu3 )6 , Pd16 (CO)13 (PEt3 )6 ,Pd59 (CO)32 (PMe3 )21 ,Pd69 (CO)36 (PEt3 )18 ) и карбонильные, и фосфиновые лиганды нейтральны, поэтому все атомы палладия в этих соединениях имеют одинаковую ФСО – ноль. Другой пример: катионный кластер [Pd4 (CO)2 (Phen)4 ]4+ , где
Phen = 1,10-фенантролин (нейтральный лиганд) и СО – тоже нейтральный лиганд. Здесь на 4 атома палладия приходится 4 положительных заряда, т.е. ФСО палладия равна (+1).
Разные виды классификации:
Классификация комплексов по химической специфике лигандов.
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.).
Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫ КОМПЛЕКСОВ
А) гидридные комплексы (например, гидриды рения).
В комплексе рения K 2 ReH9 шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре эого треугольника.
Химизм токсичности металлов
... их хелатов с ЭДТУ, также и на стабильность комплексов металлов с рядом других лигандов, возникающих в биологических средах, в живых объектах. Для осуществления токсического действия имеют большое ... действием разными путями. Например, с селективностью или большим сродством к отдельным химическим группам, таким, как способность многих металлов образовывать ковалентные связи с атомом серы. Это может ...
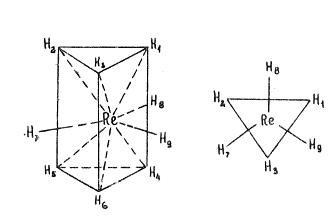
Строение аниона [ReH 9 ]2-
б) галогенидные комплексы:
Например, соединение K 2 PdCl4 является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4 )2- (см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:
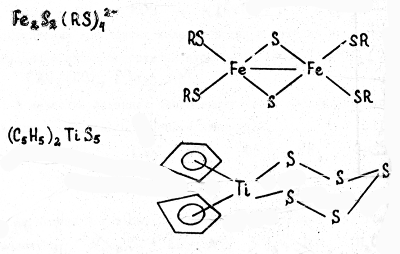
Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н — ) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5 Cr]2 (μ-H) или рения (CO)3 Re(μ-H)3 Re(CO)3 .
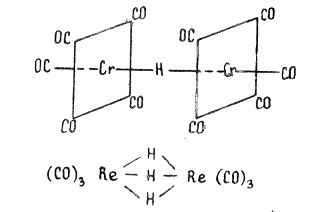
В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
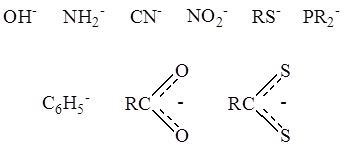
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –
Примером может служить кластерный комплекс платины состава Pt 4 (OCOCH3 )8 :
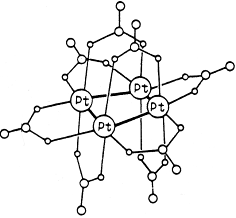
В кластере четыре атома платины образуют квадрат с коротким расстоянием металл-металл. По каждой стороне квадрата координированы по две мостиковых ацетатных группы. В координации каждой ацетатной группы участвуют в одинаковой мере оба карбоксилатных атома кислорода, поставляя для образования донорно-акцепторной связи пару электронов с каждого атома кислорода, а еще один электрон делокализован между этими двумя атомами кислорода.
3. Лигандами могут быть устойчивые двухатомные и многоатомные молекулы:
N 2 , O2 , CO, NO, NH3 , NR3 , H2 O, R2 O, SO2 , CS2 , PR3 , RCN, C6 H6
ПРИМЕРЫ:
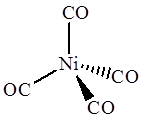
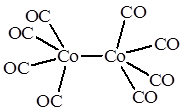
Ni(CO) 4 Co2 (CO)8
В тетракарбониле никеля Ni(CO) 4 атом металла помещен в центр тетраэдра, образуемого 4 атомами углерода карбонильных групп, поэтому комплекс имеет тетраэдрическое строение. В биядерном дикобальтоктакарбониле Co2 (CO)8 каждый атом кобальта имеет квадратно-пирамидальное окружение, причем основание квадратной пирамиды образуют 4 атома углерода карбонильных групп, а вершину этой пирамиды – второй атом кобальта.
Влияние тяжелых металлов на организм человека
... здоровья человека. Однако необходимо помнить, что для организма вреден не только недостаток, но и избыток биогенных элементов, так как при этом нарушается химический гомеостаз. Например, ... Загрязнение окружающей среды тяжелыми металлами имеет прямое отношение ... атомов и ионов. Близкие значения атомных и ионных радиусов, энергий ионизации, координационных чисел, склонность к образованию связей с одними и ...
В сэндвичевых соединениях – дибензолхроме (C 6 H6 )2 Cr и ферроцене (C5 H5 )2 Fe атом металла располагается между двумя плоскими ароматическими молекулами, каждая из которых связана с атомом металла по π-типу:
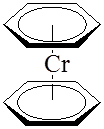
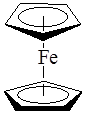
4. Лигандами могут служить молекулы или фрагменты молекул, которые не существуют в свободном состоянии или являются чрезвычайно неустойчивыми (карбены, карбины, нитрены и т.д.)
Карбеновые комплексы:
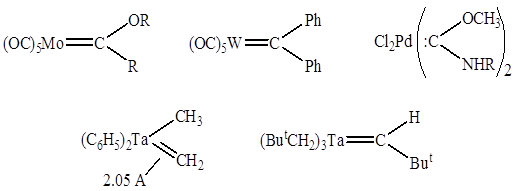
Карбиновые комплексы
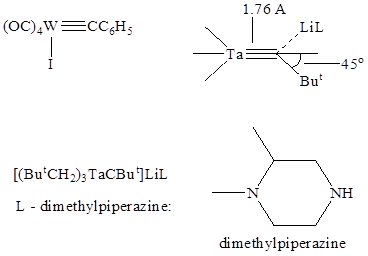
Нитреновые комплексы – это фактически азотсодержащие аналоги карбенов, где нитреновый лиганнд связывается с центральным атомом за счет кратной связи металл-азот, как, например, в комплексе рения:
![]()
Классификация комплексов по специфике электронной конфигурации лигандов.
Этот тип классификации уже в какой-то мере отражает особенности химической связи металл-лиганд.
1. σ-лиганды – лиганды с одной или несколькими неподеленными парами электронов, локализованными на одном донорном атоме. Эти лиганды при взаимодействии с металлами образуют σ-комплексы. Их можно разделить на две группы:
а) лиганды, имеющие одну или несколько неподеленных σ-пар электронов и не имеющие энергетически доступных вакантных орбиталей – F — , H2 O, ROH, NH3 , H— ,
2. π-лиганды – лиганды, донорные пары которых делокализованы на двух или более центрах и являются π-электронными парами. К таким лигандам относятся производные этилена, диенов, ацетилена, бензола и других ациклических и циклических ненасыщенных соединений.
ПРИМЕРЫ
Так, например, в анионе соли K[PtCl 3 (C2 H4 )] атом платины имеет плоско-квадратное окружение, в котором π-координированная молекула этилена занимает одно координационное место:
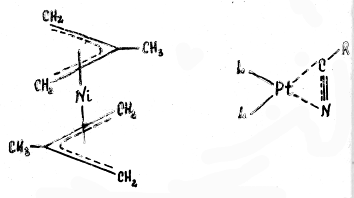
Или, например, в биc-π-аллильном комплексе никеля (см. рис.) каждый аллильный лиганд занимает 3 места в координационной сфере металла
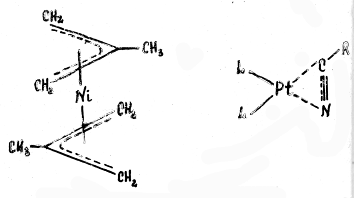
Некоторые лиганды могут выступать в роли и σ-. и π-лигандов.
Методы определения тяжелых металлов в почве
... накапливающихся в почве твердых металлов в организм человека и тем самым избежать их негативного влияния [6]. При определении тяжелых металлов в почвах и почвенных компонентах применяется атомно-абсорбционный анализ почв и различных вытяжек (например, экстрагирование ...
Это лиганды, имеющие вакантные σ- или π-орбитали – Br — , I— , PR3 , R2 S, SnCl3 — . NO, CO, карбены, нитрены.
Так, например, монооксид углерода, который будет подробней рассмотрен ниже, является одновременно лигандом с σ-донорными и π-акцепторными свойствами, причем в разных соединениях, в зависимости от природы металла-комплексоообразователя, от его заряда, от влияния других лигандов, преобладают либо одни, либо другие свойства.