“Наряду с изомерией, связанной со строением углеродного скелета и положением двойной связи, в ряду алкенов имеет место геометрическая или цис-транс-изомерия. Ее существование обусловлено отсутствием свободного вращения атомов, связанных двойной связью.
| CH3
\ |
CH3
/ |
CH3
\ |
H
/ |
| C=C | C=C | ||
| /
H |
\
H |
/
H |
\
CH3 |
цис-изомер транс-изомер
Метильные группы в приведенных примерах могут располагаться как по одну сторону двойной связи (такой изомер называется цис-изомером), так и по разные стороны (такой изомер называется транс-изомером).
Названия упомянутых изомеров происходят от латинского cis — на этой стороне и trans- через, на другой стороне. Превращение изомеров друг в друга невозможно без разрыва двойной связи”.
3. Получение алкенов
1) Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов ) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен).
Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов. Так, крекинг бутана при 600С приводит к смеси водорода, метана, этана и олефинов – этилена, пропилена, псевдобутилена (бутена -2) с соотношением олефинов ≈ 3,5 : 5 : 1,5 соответственно.
2) Все более значительные количества алкенов получают дегидрогенизацией алканов при повышенной температуре с катализатором.
| CH3–CH2–CH2–CH3 ––300C,Cr2O3– | |
| |
CH2=CH–CH2–CH3(бутен-1) + H2
CH3–CH=CH–CH3(бутен-2) + H2 |
3) В лабораторной практике наиболее распространенным способом получения алкенов является дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия).
CH 3 –CH2 –OH(этанол) ––t ,Al2O3 CH2 =CH2 + H2 O
Порядок дегидратации вторичных и третичных спиртов определяется правилом А.М.Зайцева: при образовании воды атом водорода отщепляется от наименее гидрогенизированного соседнего атома углерода, т.е. с наименьшим количеством водородных атомов.
| CH3– | CH–C
I I |
H–CH3(бутанол-2) CH3–CH=CH–CH3(бутен-2) + H2O |
| OH H |
4) Часто алкены получают реакцией дегидрогалогенирования (отщепление галогеноводорода) из галогенопроизводных при действии спиртового раствора щелочи. Направление данной реакции также соответствует правилу Зайцева.
| CH3–CH–CH2–CH3(2-бромбутан) + NaOH(спирт p-p) CH3–CH=CH–CH3 + NaBr + H2O
I Br |
5) Реакция дегалогенирования (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными металлами также приводит к алкенам.
| CH2–CH –CH3(1,2-дибромпропан) + Mg CH2=CH–CH3(пропен) + MgBr2
I I Br Br |
4. Физические свойства алкенов
По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипен я, а также плотность увеличиваются с ростом молекулярной массы. Все олефины легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
5. Химические свойства алкенов
Углеродные атомы в молекуле этилена находятся в состоянии sp 2 — гибридизации, т.е. в гибридизации участвуют одна s- и две p -орбитали.
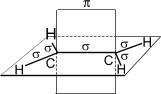
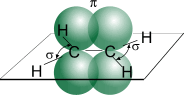
Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp 2 -орбиталями, оси которых находятся в одной плоскости под углом 120º друг к другу, и одной негибридной гантелеобразной p-орбиталью, ось которой расположена под прямым углом к плоскости осей трех sp2 -орбиталей. Одна из трех гибридных орбиталей атома углерода перекрывается с подобной орбиталью другого атома углерода, образуя - связь. Каждая оставшаяся гибридная орбиталь атомов углерода перекрывается с s- орбиталью атомов водорода, приводя к образованию в той же плоскости четырех - связей C–H. Две негибридные p- орбитали атомов углерода взаимно перекрываются и образуют - связь, максимальная плотность которой расположена перпендикулярно плоскости - связей. Следовательно, двойная связь алкенов представляет собой сочетание - и - связей.
- Связь менее прочна, чем - связь, так как p- орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p- орбиталями и s- орбиталями - связи (перекрывание осуществляется по оси орбиталей).
В связи с этим, - связь легко разрывается и переходит в две новые - связи посредством присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ.
Иными словами, для алкенов наиболее типичными являются реакции присоединения.
В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Галогенирование.
H 2 C=CH2 + Br2 BrCH2 –CH2 Br(1,2-дибромэтан)
Приведенная реакция — обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
Гидрирование.
CH 3 –CH=CH2 + H2 ––Ni CH3 –CH2 –CH3 (пропан)
Гидрогалогенирование.
H 2 C=CH2 + HBr CH3 –CH2 Br(бромистый этил)
Присоединение галогеноводородов к пропилену и другим алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи).
|
CH3−CH=CH2 + HCl CH3− |
CH−CH3(2-хлорпропан)
I Cl |
Гидратация.
| OH
I |
||
| CH3− | C=CH2(2-метилпропен-1) + H2O ––H+ CH3− | C−CH3(2-метилпропанол-2) |
| I
CH3 |
I
CH3 |
Сульфатация (O- сульфирование).
| CH2=CH−CH3 + HO−SO2−OH CH3− | CH−O−SO2−OH(изопропилсерная кислота)
I CH3 |
Как видно, направление реакций гидратации и сульфирования также определяется правилом Марковникова.
Окисление.
a) При сжигании на воздухе олефины дают углекислый газ и воду.
H 2 C=CH2 + 3O2 2CO2 + 2H2 O
b) При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера).
Реакция протекает на холоде.
| 3H2C=CH2 + 2KMnO4 + 4H2O 3 | CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH
I I OH OH |
В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь.
c) При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи и образование кислот или кетонов.
| O
II |
O
II |
|
| CH3−CH=CH−CH2−CH3(пентен-2) –[O] CH3− | C (уксусная кислота) + | C−CH2−CH3(пропионовая кислота) |
| I
OH |
I
OH |
| O
II |
|||
| CH3− | C=CH−CH3(2-метилбутен-2) –[O] CH3− | C=O(пропанон-2) + | C−CH3(уксусная кислота) |
| I
CH3 |
I
CH3 |
I
OH |
6. Применение алкенов
, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов.
Номенклатура
В алкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание -ан заменяется на -ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
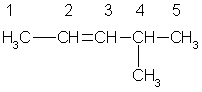
4-метил-2-пентен
Программа для поступающих в вузы (ответы)
Получение уксусной кислоты
Тестовый контроль знаний в школьном курсе химии по теме: «Углеводороды» с экологическим содержанием
Получение алканов, алкенов, алкинов. Важнейшие представители. Применение в промышленности
Реакции a-литиированных циклических нитронов с электрофильными реагентами
Общая и неорганическая химия
Карбоновые кислоты, их производные
Межпредметные связи в курсе школьного предмета химии на предмете углерода и его соединений
Технология пиролиза углеводородного сырья в трубчатых печах
Компьютерные технологии при изучении темы «Молекулярные перегруппировки»
Синтез этилового спирта
Химическая связь. Типы взаимодействия молекул
Основы химии
Оксосоединения (альдегиды и кетоны)
Выделение жирных кислот из растительных масел
Основные теоретические положения органической химии. Насыщенные (предельные) углеводороды
Органические соединения
Оксисоединения
