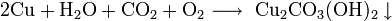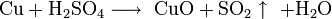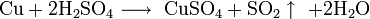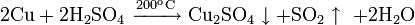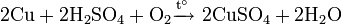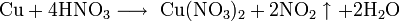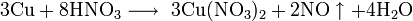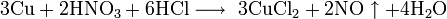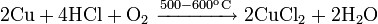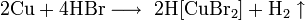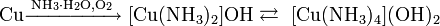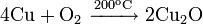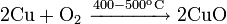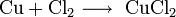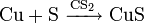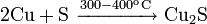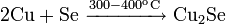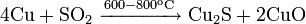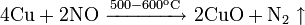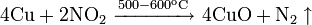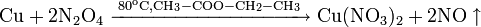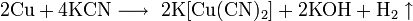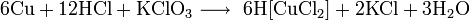— элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum ).
Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
C давних пор широко применяется человеком.
1. История и происхождение названия
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков производят русское слово медь (польск. miedz, чешск. med) от древненемецкого smida (металл) и Schmied (кузнец, англ. Smith).
Конечно, родство корней в данном случае несомненно, однако, оба эти слова произведены от греч. рудник, копь независимо друг от друга. От этого слова произошли и родственные названия — медаль, медальон (франц. medaille).
Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь венера (Venus).
В более древние времена встречается название марс (Mars).
2. Нахождение в природе
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS 2 , также известный как медный колчедан, халькозин Cu2 S и борнит Cu5 FeS4 . Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2 O, азурит Cu3 (CO3 )2 (OH)2 , малахит Cu2 CO3 (OH)2 . Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн [2] . Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3] .
Заимствование иностранных слов в русском языке
... Во-часто, вторых встает вопрос, русским или следует заимствованным считать слово, в котором все иноязычные морфемы, но заимствованы из разных языков или иноязычные и есть, и русские морфемы. Так, ... о так кальках называемых. Калька (франц. calque) - слово выражение или, созданное из исконных языковых элементов, но по иноязычных образцу слов и выражений. Так, русский выглядеть «глагол» возник как ...
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
3. Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра, удельная проводимость при 20 °C 55,5-58 МСм/м [4] ).
Имеет два стабильных изотопа — 63 Cu и 65 Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64 Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
4. Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Хлеб химической промышленности. серная кислота хлеб химической промышленности
... малоактивные металлы, такиекак медь, серебро, золото, с разбавленной серной кислотой не реагируют. Концентрированная серная кислотаявляется сильным ... кислоты нужной концентрации. Применение. Серная кислота – важнейший продуктхимической промышленности. Она находит примерение в производстве минеральныхудобрений, волокон, пластмасс, красителей, взрывчатых веществ, в металлургиипри получении меди, ...
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
4.1. Соединения
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu + и намного более стабильную Cu2+ , которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11 H11 )2 3− , полученных в 1994 году.
Электролитическое рафинирование меди
... большинстве известных соединений медь проявляет степень окисления + 2. Соединения меди (II)-оксид СuО и гидроксид Си(ОН)2 ... медь растворяется легко. Цели курсовой работы: изучить и описать процесс электролитического рафинирования меди, рассмотреть пути его совершенствования, выбрать и ... меди имеет небольшая группа минералов. Таблица 1.1 Минералы меди и её содержание в минерале Источниками получения меди ...
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO 4 ∙5H2 O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2 O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2 Cu3 O7-δ ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
4.2. Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu 2 O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu + (водн.) → Cu2+ (водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl 2 ]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl − (водн.) → [CuCl2 ]− (водн.)
Хлорид меди(I) — белое нерастворимое твёрдое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II).
Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
2CuCl 2 (тв.) → 2CuCl(тв.) + Cl2 (г.)
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl 2 ]− . При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I).
Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3 )2 ]+ . Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
4.3. Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, конц. серной).
Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (напр., использование реактива Фелинга).
4.4. Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Цветные металлы и сплавы
... молибден, селен, уран и т.д. сплав прочность алюминий медь К группе широко применяемых цветных металлов относятся алюминий, титан, магний, медь, свинец, олово. Цветные металлы обладают целым рядом весьма ценных ... не стоек в кислой и щелочной среде, поэтому алюминиевая посуда не используется для маринадов, солений, кисломолочных продуктов. Применяется в качестве раскислителя при производстве ...
4.5. Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
5. Применение
5.1. В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м [4] ), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях ) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[5] .
5.2. Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
5.3. Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [6] , а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
5.4. Сплавы
5.4.1. Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30-40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не принимают термической обработки, и их механические свойства и износостойкость определяются химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900-12000 кгс/мм² ниже, чем у стали).
Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевые сплавы используются для чеканки разменной монеты.
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
5.4.2. Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
5.4.3. Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
5.5. Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa 2 Cu3 O7-δ , который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
5.6. Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [7] .
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
6. Стоимость
На 2011 год стоимость меди составляет около $9000 за тонну. [8]
7. Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
7.1. Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [9] .
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла [9] . Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
7.2. Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [10] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля).
Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[11] . Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)[12] .
7.3. Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
8. Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т [13] [14] . Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [13] , на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[13] . Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн [15] . Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское» [16] . Мировое производство меди в 2007 году составляло [17] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
-
 Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), - США (1,170/1,310),
-
 Перу (1,190/1,220),
Перу (1,190/1,220), -
 КНР (0,946/1,000),
КНР (0,946/1,000), - Австралия (0,870/0,850),
-
 Россия (0,740/0,750),
Россия (0,740/0,750), -
 Индонезия (0,797/0,650),
Индонезия (0,797/0,650), - Канада (0,589/0,590),
-
 Замбия (0,520/0,560),
Замбия (0,520/0,560), - Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
Смотрим также более полный список стран по производству меди.
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
8.1. Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO + (CuOH) 2 CO3
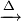 3CO2 + 2Cu + H2 O.
3CO2 + 2Cu + H2 O.
Добычу меди называют [кто? ] прабабушкой металлургии. Её добыча и выплавка были налажены ещё в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.).
Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
8.2. Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование).
Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %).
Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах [18] .
9. Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[19] .
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).
- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными габаритами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[20] .
- Поскольку медь не накапливается в организме, а выводится вместе с продуктами метаболизма, человеку ежедневно необходимо получать в составе диеты ок. 2 мг меди.
Примечания
- Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т.. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз . — ISBN 5—85270—039—8
- Медь самородная в БСЭ — slovari.yandex.ru/dict/bse/article/00046/67000.htm
- Крупнейшие мономинеральные месторождения (рудные районы, бассейны) — uralgold.ru/very_big_f.html
- ↑ 1 2 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- Применение меди — www.magin.ru/primen.html
- ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа. Технические условия — protect.gost.ru/document.aspx?control=7&baseC=6&page=0&month=6&year=2008&search=52318&id=129454
- СП 31-116-2006 Проектирование и устройство кровель из листовой меди — dwg.ru/dnl/3215
- Цена меди — coppertubeus.blogspot.com/
- ↑ 1 2 CHEMICAL FACT SHEETS — www.who.int/water_sanitation_health/dwq/chemicals/coppersum.pdf (англ.) .
- US EPA — www.epa.gov/pesticides/factsheets/copper-alloy-products.htm
- В США наблюдается вспышка инфекции MRSA за пределами госпиталей — www.rol.ru/news/med/news/03/03/07_017.htm
- British Scientist Shares Expertise on Swine Flu Control in Beijing — www.copperinfo.co.uk/news/press-releases/pr762-british-scientist-copper-swine-flu.pdf
- ↑ 1 2 3 Производство меди — www.ecsocman.edu.ru/db/msg/142462.html
- В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии — www.metalinfo.ru/ru/news/12150
- Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года — www.minprom.gov.ru/activity/metal/strateg/2. Минпромэнерго РФ (2009-03-18).
- Металлонвест оплатил лицензию за Удокан — www.metalinfo.ru/ru/news/34394
- MINERAL COMMODITY SUMMARIES 2009 — minerals.usgs.gov/minerals/pubs/mcs/2009/mcs2009.pdf
- Получение меди — melita.com.ua/spravochnik_med.html
- Espinoza Soriano, Waldemar. Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
- Интересные факты о меди и медных трубах — www.stelmarket.ru/teh_inf/26.htm
Литература
[Электронный ресурс]//URL: https://inzhpro.ru/referat/medpo-geologii/
- Данные на начало XX века : Медь — ru.wikisource.org/wiki/ЭСБЕ/Медь // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.).
— СПб. , 1890—1907.
- Фримантл М. Химия в действии. — М .: «Мир», 1991. — Т. 2.
- Р. А. Лидин, В. А. Молочко, Л. Л. Андреева Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
Данный реферат составлен на основе .