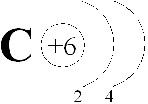
Углерод (лат. Carboneum) С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса 12,011(1).
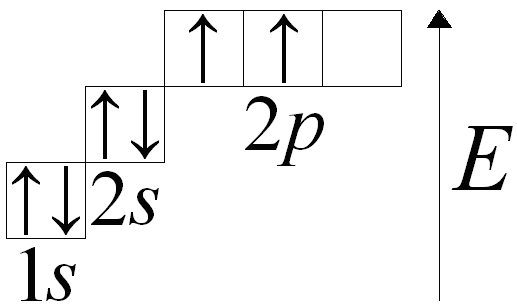
Рассмотрим углерода. На наружном энергетическом уровне атома углерода находятся четыре электрона. Изобразим графически:
1s22s22p2
Углерод был известен с глубокой древности, и имя первооткрывателя этого элемента неизвестно.
В конце XVII в. флорентийские ученые Аверани и Тарджони пытались сплавить несколько мелких алмазов в один крупный и нагрели их с помощью зажигательного стекла солнечными лучами. Алмазы исчезли, сгорев на воздухе. В 1772 г. французский химик А. Лавуазье показал, что при сгорании алмаза образуется СО2. Лишь в 1797 г. английский ученый С. Теннант доказал идентичность природы графита и угля. После сгорания равных количеств угля и алмаза объемы оксида углерода (IV) оказались одинаковыми.
Многообразие соединений углерода, объясняющееся способностью его атомов соединяться друг с другом и атомами других элементов различными способами, обуславливает особое положение углерода среди других элементов.
Глава I. Всё об углероде
1.1. Углерод в природе
Углерод находится в природе, как в свободном состоянии, так и в виде соединений.
Свободный углерод встречается в виде алмаза, графита и карбина.
Алмазы очень редки. Самый большой из известных алмазов – «Куллинан» был найден в 1905 г. в Южной Африке, весил 621,2 г и имел размеры 10Ч6,5Ч5 см. В Алмазном фонде в Москве хранится один из самых больших и красивых алмазов в мире – «Орлов» (37,92 г).
Свое название алмаз получил от греч. «адамас» – непобедимый, несокрушимый. Самые значительные месторождения алмазов находятся в Южной Африке, Бразилии, в Якутии.
Крупные залежи графита находятся в ФРГ, в Шри-Ланке, в Сибири, на Алтае.
Главными углеродсодержащими минералами являются: магнезит МgСО3, кальцит (известковый шпат, известняк, мрамор, мел) СаСО3, доломит СаМg(СО3)2 и др.
Все горючие ископаемые – нефть, газ, торф, каменные и бурые угли, сланцы – построены на углеродной основе. Близки по составу к углероду некоторые ископаемые угли, содержащие до 99% С.
Алмазы и их применение
... метода – создание перенасыщенной углеродом газовой фазы, образующаяся при этом избыточная поверхностная энергия на границе графит – воздух способствует формированию зародышей алмазов. Подобный метод был ... львиная доля добываемых в России алмазов приходится на якутские горнообрабатывающие комбинаты. Кроме того, крупные месторождения алмазов находятся на территории Красновишерского района Пермского ...
На долю углерода приходится 0,1% земной коры.
В виде оксида углерода (IV) СО2 углерод входит в состав атмосферы. В гидросфере растворено большое количество СО2.
1.2. Аллотропные модификации углерода
Элементарный углерод образует три аллотропные модификации: алмаз, графит, карбин.
1. Алмаз – бесцветное, прозрачное кристаллическое вещество, чрезвычайно сильно преломляющее лучи света. Атомы углерода в алмазе находятся в состоянии sр3-гибридизации. В возбуждённом состоянии происходит распаривание валентных электронов в атомах углерода и образование четырёх неспаренных электронов. При образовании химических связей электронные облака приобретают одинаковую вытянутую форму и располагаются в пространстве так, что их оси оказываются направленными к вершинам тетраэдра. При перекрывании вершин этих облаков с облаками других атомов углерода возникают ковалентные связи под углом 109°28′, и образуется атомная кристаллическая решетка, характерная для алмаза.
Каждый атом углерода в алмазе окружён четырьмя другими, расположенными от него в направлениях от центра тетраэдров к вершинам. Расстояние между атомами в тетраэдрах равно 0,154 нм. Прочность всех связей одинакова. Таким образом, атомы в алмазе «упакованы» очень плотно. При 20°С плотность алмаза составляет 3,515 г/см3. Этим объясняется его исключительная твердость. Алмаз плохо проводит электрический ток.
В 1961 г. в Советском Союзе было начато промышленное производство синтетических алмазов из графита.
При промышленном синтезе алмазов используются давления в тысячи МПа и температуры от 1500 до 3000°С. Процесс ведут в присутствии катализаторов, которыми могут служить некоторые металлы, например Ni. Основная масса образующихся алмазов – небольшие кристаллы и алмазная пыль.
Алмаз при нагревании без доступа воздуха выше 1000°С превращается в графит. При 1750°С превращение алмаза в графит происходит быстро.
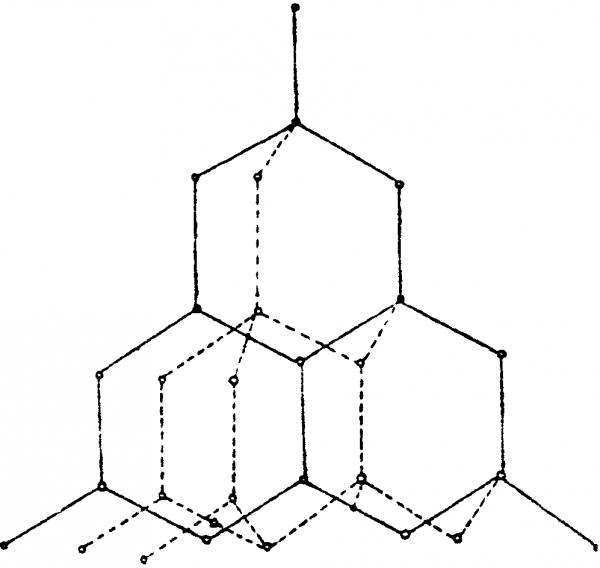
алмаза
2. Графит – серо-чёрное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступающее даже бумаге.
Атомы углерода в кристаллах графита находятся в состоянии sр2-гибридизации: каждый из них образует три ковалентные σ-связи с соседними атомами. Углы между направлениями связей равны 120°. В результате образуется сетка, составленная из правильных шестиугольников. Расстояние между соседними ядрами атомов углерода внутри слоя составляет 0,142 нм. Четвёртый электрон внешнего слоя каждого атома углерода в графите занимает р-орбиталь, не участвующую в гибридизации.
Негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя, и перекрываясь друг с другом, образуют делокализованные σ-связи. Соседние слои в кристалле графита находятся друг от друга на расстоянии 0,335 нм и слабо связаны между собой, в основном силами Ван-дер-Ваальса. Поэтому графит имеет низкую механическую прочность и легко расщепляется на чешуйки, которые сами по себе очень прочны. Связь между слоями атомов углерода в графите частично имеет металлический характер. Этим объясняется тот факт, что графит хорошо проводит электрический ток, но все, же не так хорошо, как металлы.
Межпредметные связи в курсе школьного предмета химии на предмете ...
... с углем, т.е. окисел (оксид) углерода”. 2.2 Строение молекулы углекислого газа 2.2.1 С позиции ВС Молекула оксида углерода (IV) имеет следующее строение: атом углерода переходит в возбужденное состояние, имея ... моментов диполей связей в молекуле углекислого газа Раз каждая из связей углерод-кислород является полярной, поэтому на каждом из атомов кислорода должен быть некоторый отрицательный заряд, ...
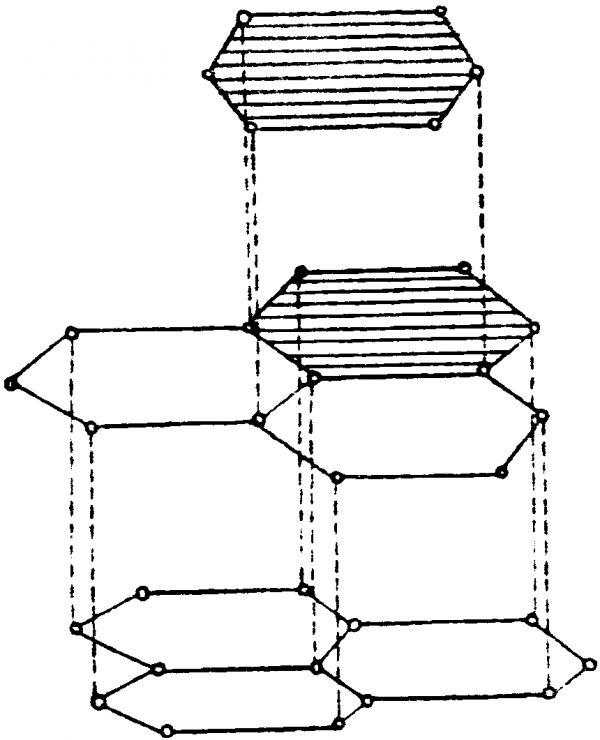
графита
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
3. Карбин – мелкокристаллический порошок чёрного цвета. В его кристаллической углерода соединены чередующимися одинарными и тройными связями в линейные цепочки:
−С≡С−С≡С−С≡С−
Это вещество впервые получено В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым в начале 60-х годов XX века.
Впоследствии было показано, что карбин может существовать в разных формах и содержит как полиацетиленовые, так и поликумуленовые цепочки, в которых углеродные атомы связаны двойными связями:
=С=С=С=С=С=С=
Позднее карбин был найден в природе – в метеоритном веществе.
Карбин обладает полупроводниковыми свойствами, под действием света его проводимость сильно увеличивается. За счёт существования разных типов связи и разных способов укладки цепей из углеродных атомов в кристаллической решетке физические свойства карбина могут меняться в широких пределах. При нагревании без доступа воздуха выше 2000°С карбин устойчив, при температурах около 2300°С наблюдается его переход в графит.
Природный углерод состоит из двух изотопов 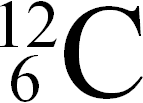 (98,892%) и
(98,892%) и 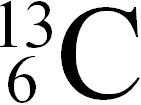 (1,108%).
(1,108%).
Кроме того, в атмосфере обнаружены незначительные примеси радиоактивного изотопа  , который получают искусственным путём.
, который получают искусственным путём.
Раньше считали, что древесный уголь, сажа и кокс близки по составу чистому углероду и отличающиеся по свойствам от алмаза и графита, представляют самостоятельную аллотропную модификацию углерода («аморфный углерод»).
Однако было установлено, что эти вещества состоят из мельчайших кристаллических частиц, в которых атомы углерода связаны так же, как в графите.
4. Уголь – тонко измельчённый графит. Образуется при термическом разложении углеродсодержащих соединений без доступа воздуха. Угли существенно различаются по свойствам в зависимости от вещества, из которого они получены и способа получения. Они всегда содержат примеси, влияющие на их свойства. Наиболее важные сорта угля – кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха.
Атмосферный воздух
... пище. Без пищи человек может прожить 5 недель, без воды – 5 дней, без воздуха – 5 минут. Воздух необходим всему живому на Земле. Атмосфера оберегает человечество от ... и органические (хлорированные углеводороды, например ДДТ, трихлорэтилен, хлороформ); Соединения углерода неорганические (оксид углерода CO, диоксид углерода CO2 , углеводороды) и органические (спирты, фенол, крезол, простые ...
Древесный уголь образуется при нагревании дерева без доступа воздуха.
Сажа – очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) при ограниченном доступе воздуха.
Активные угли — пористые промышленные адсорбенты, состоящие в основном из углерода. Адсорбцией называют поглощение поверхностью твёрдых веществ газов и растворённых веществ. Активные угли получают из твердого топлива (торфа, бурого и каменного угля, антрацита), дерева и продуктов его переработки (древесного угля, опилок, отходов бумажного производства), отходов кожевенной промышленности, материалов животного происхождения, например костей. Угли, отличающиеся высокой механической прочностью, производят из скорлупы кокосовых и других орехов, из косточек плодов. Структура углей представлена порами всех размеров, однако адсорбционная ёмкость и скорость адсорбции определяются содержанием микропор в единице массы или объёма гранул. При производстве активного угля вначале исходный материал подвергают термической обработке без доступа воздуха, в результате которой из него удаляется влага и частично смолы. При этом образуется крупнопористая Для получения микропористой активацию производят либо окислением газом или паром, либо обработкой химическими реагентами.
1.3. Химические свойства углерода
При обычных температурах алмаз, графит, уголь химически инертны, но при высоких температурах активность их увеличивается. Как и следует основных форм углерода, уголь вступает в реакции легче, чем графит и тем более алмаз. Графит не только более реакционноспособен, чем алмаз, но и, реагируя с некоторыми веществами, может образовывать такие продукты, каких не образует алмаз.
1. В качестве окислителя углерод реагирует с некоторыми металлами при высоких температурах, образуя карбиды:
ЗС + 4Аl = Аl4С3 (карбид алюминия).
2. С водородом уголь и графит образуют углеводороды. Простейший представитель – метан СН4 – может быть получен в присутствии катализатора Ni при высокой температуре (600-1000°С):
С + 2Н2 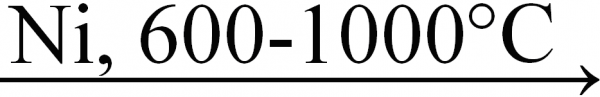 СН4.
СН4.
3. При взаимодействии с кислородом углерод проявляет восстановительные свойства. При полном сгорании углерода любой аллотропной модификации образуется оксид углерода (IV):
С + О2 = СО2.
При неполном сгорании образуется оксид углерода (II) СО:
С + О2 = 2СО.
Обе реакции экзотермичны.
4. Особенно ярко восстановительные свойства угля проявляются при взаимодействии с оксидами металлов (цинка, меди, свинца и др.), например:
С + 2CuO = СО2↑ + 2Cu,
С + 2ZnO = СО2↑ + 2Zn.
На этих реакциях основан важнейший процесс металлургии – выплавка металлов из руд.
В иных случаях, например при взаимодействии с оксидом кальция, образуются карбиды:
СаО + ЗС = СаС2 + СО↑.
5. Уголь окисляется горячими концентрированными серной и азотной кислотами:
Совершенствование технологии использования продувочных газов ...
... азот, углекислый газ, благородные газы, ... аммиака используется азотводородная смесь. Аппаратурное оформление процесса определяется в основном источником водорода. Существует несколько основных вариантов получения синтез-газа, то есть смеси водорода и оксидов углерода: ... работы является увеличении доли переработки сырья и разработка технологии получения новых продуктов процесса синтеза аммиака. ...
С + 2Н2SO4 = СO2↑ + 2SO2↑ + 2Н2О,
конц.
ЗС + 4НNО3 = ЗСО2↑ + 4NO↑ + 2Н2О.
конц.
Любые формы углерода устойчивы по отношению к щелочам!
1.4. Применение углерода
Алмазы используются для обработки различных твердых материалов, для резки, шлифования, сверления и гравировки стекла, для бурения горных пород. Алмазы после шлифования и огранки превращаются в бриллианты, используемые в качестве украшений.
Графит – ценнейший материал для современной промышленности. Из графита изготавливают литейные формы, плавильные тигли и другие огнеупорные изделия. Благодаря высокой химической устойчивости графит применяется для изготовления труб и аппаратов, выложенных изнутри графитовыми плитами. Значительные количества графита используют в электротехнической промышленности, например при изготовлении электродов. Графит используется для изготовления карандашей и некоторых красок, в качестве смазочного материала. Очень чистый графит используют в ядерных реакторах для замедления нейтронов.
Линейный полимер углерода – карбин – привлекает внимание учёных как перспективный материал для изготовления полупроводников, которые могут работать при высоких температурах, и сверхпрочных волокон.
Древесный уголь используется в металлургической промышленности, в кузнечном деле.
Кокс применяется в качестве восстановителя при выплавке металлов из руд.
Сажа применяется в качестве наполнителя резин для повышения прочности, поэтому автомобильные шины – чёрного цвета. Используют сажу и как компонент печатных красок, туши, крема для обуви.
Активные угли используются для очистки, извлечения и разделения различных веществ. Активные угли применяются в качестве наполнителей противогазов и как сорбирующее средство в медицине.
Глава II. Неорганические соединения углерода
Углерод образует два оксида – оксид углерода (II) СО и оксид углерода (IV) СO2.
Оксид углерода (II) СО – бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин, лишая тем самым возможности гемоглобин переносить кислород.
При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива, вот почему так опасно преждевременное закрывание дымоходов.
Оксид углерода (II) относят, как вы уже знаете, к несолеобразующим оксидам, так как, будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами с образованием соли и воды, однако этого не наблюдается.
2СО + О2 = 2СО2.
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т.е. восстанавливать металлы из их оксидов.
Fe2О3 + ЗСО = 2Fe + ЗСО2.
Именно это свойство оксида углерода (II) используют в металлургии при выплавке чугуна.
Оксид углерода (IV) СО2 – широко известный под названием углекислый газ – бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа.
Чистка отходящих газов от оксидов азота в химических производствах
... л/моль – молярный объем газа при н.у. Согласно приведенному составу газа на очистку и его окисленности (80 % NO 2 от общего количества оксидов азота), в 1000 м3 газа содержится: NO: или NO ... воздуха и нитрозных газов. После турбины 4 газ с содержанием оксидов азота не болем 0,01 % (об.) выбрасывается в атмосферу. 4. Нормы технологического режима Процесс очистки отходящих газов в производстве азотной ...
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую в промышленности прессуют, – это известный вам «сухой лед», который применяют для хранения пищевых продуктов. Вы уже знаете, что твердый углекислый газ имеет молекулярную решетку, способен к возгонке.
Углекислый газ СО2 – это типичный кислотный оксид: взаимодействует со щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой.
Он не горит и не поддерживает горения и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи.
СО2 + 2Mg = 2MgO + С.
Углекислый газ получают, действуя на соли угольной кислоты – карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты.
СаСО3 + 2НСl = СаСl2 + Н20 + С02↑.
В промышленности углекислый газ получают обжигом известняка:
СаСО3 = СаО + С02↑.
Углекислый газ, кроме уже названной области применения, используют также для изготовления шипучих напитков и для получения соды.
угольная кислота
карбонаты,
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
СаСO3 + Н2O + СO2 = Са(НСO3)2.
временная жесткость
Са(НСO3)2 = СаСO3↓ + Н20 + С02↑.
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников, а в природе в результате этой реакции формируются в пещерах свисающие вниз причудливые сталактиты, которым снизу вырастают сталагмиты.
постоянную жесткость.
Na2CО3, которая переводит эти ионы Са2+ в осадок, например:
СаСl2 + Na2CO3 = CaCO3↓ + 2NaCl.
Соду можно использовать и для устранения временной жесткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющегося углекислого газа.
Эта реакция является качественной реакцией на соли угольной кислоты.
Заключение
Вся земная жизнь основана на углероде. Каждая молекула живого организма основе углеродного скелета. Атомы углерода постоянно мигрируют из одной части биосферы (узкой оболочки Земли, где существует жизнь) в другую. На примере круговорота углерода в природе можно проследить в динамике картину жизни на нашей планете.
Основные запасы углерода на Земле находятся в виде содержащегося в атмосфере и растворенного в Мировом океане диоксида углерода, то есть углекислого газа (CO2).
Снижение углекислого газа в атмосфере
... делался вывод, что чем больше в атмосфере таких газов, особенно углекислого газа, тем теплее воздух над Землей и тем теплее поверхность самой Земли. 1.1Снижение концентрации СО2 в атмосфере., Диоксид углерода (CO 2 Ни одна ...
Рассмотрим сначала молекулы углекислого газа, находящиеся в атмосфере. Растения поглощают эти молекулы, затем в процессе фотосинтеза атом углерода превращается в разнообразные органические соединения и таким образом включается растений. Далее возможно несколько вариантов:
- Углерод может оставаться в растениях, пока растения не погибнут. Тогда их молекулы пойдут в пищу редуцентам (организмам, которые питаются мертвым органическим веществом и при этом разрушают его до простых неорганических соединений), таким как грибы и термиты. В конце концов углерод вернется в атмосферу в качестве CO2;
- Растения могут быть съедены травоядными животными. В этом случае углерод либо вернется в атмосферу (в процессе дыхания животных и при их разложении после смерти), либо травоядные животные будут съедены плотоядными (и тогда углерод опять же вернется в атмосферу теми же путями);
- растения могут погибнуть и оказаться под землей. Тогда в конечном итоге они превратятся в ископаемое топливо – например, в уголь.
В случае же растворения исходной молекулы CO2 в морской воде также возможно несколько вариантов:
- углекислый газ может просто вернуться в атмосферу (этот вид взаимного газообмена между Мировым океаном и атмосферой происходит постоянно);
- углерод может войти в ткани морских растений или животных. Тогда он будет постепенно накапливаться в виде отложений на дне Мирового океана и в конце концов превратится в известняк или из отложений вновь перейдет в морскую воду.
Если углерод вошел в состав осадочных отложений или ископаемого топлива, он изымается из атмосферы. На протяжении существования Земли изъятый таким образом углерод замещался углекислым газом, попадавшим в атмосферу при вулканических извержениях и других геотермальных процессах. В современных условиях к этим природным факторам добавляются также выбросы при сжигании человеком ископаемого топлива. В связи с влиянием CO2 на парниковый эффект исследование круговорота углерода стало важной задачей для ученых, занимающихся изучением атмосферы.
Составной частью этих поисков является установление количества CO2, находящегося в тканях растений (например, в только что посаженном лесу) – ученые называют это стоком углерода. Поскольку правительства разных стран пытаются достичь международного соглашения по ограничению выбросов CO2, вопрос сбалансированного соотношения стоков и выбросов углерода в отдельных государствах стал главным яблоком раздора для промышленных ученые сомневаются, что накопление углекислого газа в атмосфере можно остановить одними лесопосадками.
Углерод постоянно циркулирует в земной биосфере по замкнутым взаимосвязанным путям. В настоящее время к природным процессам добавляются последствия сжигания ископаемого топлива.
Литература:
[Электронный ресурс]//URL: https://inzhpro.ru/referat/kislorodnyie-soedineniya-ugleroda/
Ахметов Н.С. Химия 9 класс: учеб. для общеобразоват. учеб. заведений. – 2-е изд. – М.: Просвещение, 1999. – 175 с.: ил.
Габриелян О.С. Химия 9 класс: учеб. для общеобразоват. учеб. заведений. – 4-е изд. – М.: Дрофа, 2001. – 224 с.: ил.
Габриелян О.С. Химия 8-9 классы: метод. пособие. – 4-е изд. – М.: Дрофа, 2001. – 128 с.
Ерошин Д.П., Шишкин Е.А. Методика решения задач по химии: учеб. пособие. – М.: Просвещение, 1989. – 176 с.: ил.
Кременчугская М. Химия: Справочник школьника. – М.: Филол. общ-во «СЛОВО»: ООО «Изд-во АСТ», 2001. – 478 с.
Загрязнение атмосферы (2)
... выбросами промышленных предприятий. Ежегодно этого газа поступает в атмосферу не менее 250 млн. т. Оксид углерода ... уровень загрязнения воздуха вносят предприятия черной и цветной металлургии, химии ... атмосферу от химических предприятий, производящих соляную кислоту, хлоросодержащие пестициды, органические красители, гидролизный спирт, хлорную известь, соду. В атмосфере встречаются как примесь молекулы ...
Крицман В.А. Книга для чтения по неорганической химии. – М.: Просвещение, 1986. – 273 с.
