Массовые числа природных изотопов
107, 109
Электронная структура атома меди
К L-М 4s2 4p6 4d10 5s1
Электронная структура атома меди и катиона Ag + для 4d и 5s-орбиталей
![]()
Ag
![]()
Ag +
ИСТОРИЧЕСКАЯ СПРАВКА
Серебро является одним из тех металлов, которые привлекли внимание человека еще в древние времена. История серебра тесно связана с алхимией, поскольку уже в те времена был разработан метод купелирования серебра.
За 2500 лет до н. э. в Древнем Египте носили украшения и чеканили монеты из серебра, считая, что оно дороже золота. В X в. было показано, что между серебром и медью существом аналогия, и медь рассматривалась как серебро, окрашенное в красный цвет. В 1250 г. Винсент Бове высказал предположи что серебро образуется из ртути при действии серы.
В средние века кобалдом называли руды, которые служили для получения металла со свойствами, отличными от уже известного серебра. Позднее было показано, что из этих минералов добывается сплав серебро — кобальт, и различие в свойствах определялось присутствием кобальта. В XVI в. Парацельс получил хлорид серебра из элементов а Бойль определил его состав. Шееле изучал действие света на хлорид серебра, а открытие фотографии привлекло внимание и кдругим галогенидам серебра. В 1663 г. Глазер предложил нитрат серебра в качестве прижигающего средства. С конца XIX в. комплексные цианиды серебра используются в гальванопластике.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Серебро является редким металлом, его содержание в земной коре равно 110 -5 вес.%. В природе серебро встречается как самородное, так и в виде соединений — сульфидов, селенатов, теллуратов или галогенидов в различных минералах.
Серебро встречается также в метеоритах и содержится в морской воде.
Серебро в виде самородков встречается в природе реже, чем самородная медь или золото, и часто это бывают сплавы с золотом, медью (медьсодержащее серебро), сурьмой (сурьмусодержащие серебро), ртутью и платиной. Образование самородного серебра связано с действием воды или водорода на сульфид серебра (соответственно на аргентит).
Металлическое серебро представляет собой гранецентрированные кубические кристаллы серебристо-белого цвета, часто покрыты черным налетом. Залежи самородного серебра находятся в России, Норвегии, Канаде, Чили, ФРГ и других странах. Наиболее важными минералами серебра являются следующие:
-
Кантпит, (Ag 2 S), серые ромбические кристаллы, устойчивые при температуре ниже +179°С. Обе модификации природного сульфида серебра содержат 87,1% Ag, имеют плотность 7,2—7,4 г/см3 и твердость 2—2,5 единицы по шкале Мооса.
-
Аргентит, (Ag 2 S), серые кубические кристаллы, устойчивые при температуре выше +179°С. Аргентит — основной источник серебра. В природе он сопутствует самородному серебру, кераргиту (AgCl), церусситу (РbС03 ), арсенидам и антимонидам серебра; его залежи часто находятся рядом с сульфидами свинца, цинка и меди.Такие руды находятся в Норвегии, Мексике, Перу, СССР, Чили.
-
Галенит (AgS), добываемый в Румынии, Франции, содержит серебро.
-
Прустит (Ag 3 AsS3 или 3Ag2 S -As2 S3 ), содержит 65,4% серебра.
-
Пираргерит (Ag 3 SbS3 или 3Ag2 S -Sb2 S3 ), содержит 68,4% серебра.
-
Стефанит (8(Ag, Cu) 2 S-Sb2 S3 ), содержит 62,1—74,9% Ag
При окислении аргентита (акантита) Ag 2 S образуется сульфат серебра Ag2 SO4 , который будучи частично растворим, вымывается водой. Когда на пути вод, одержащих сульфат серебра, встречается сульфат железа(II), выделяется свободное серебро, а если встречаются хлориды (т.е. ионы Сl— ), то образуется кераргирит:
Ag 2 SO4 + 2FeSO4 — 2Ag + Fe2 (SO4 )3
Ag 2 SO4 + 2NaCl = 2AgCl + Na2 SO4
Если воды, содержащие сульфид серебра, встречают сульфиды других элементов, то образуются скопления двойных сульфидов подобно встречающимся смесям серебро — мышьяк, серебро — сурьма, серебро — медь, серебро — свинец, серебро — германий.
ПЕРЕРАБОТКА СЕРЕБРЯНЫХ РУД И ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО СЕРЕБРА
Примерно 80% от общего мирового количества добываемого серебра получается как побочный продукт переработки комплексных сульфидов тяжелых цветных металлов, содержащих сульфид серебра (аргентит) Ag 2 S. При пирометаллургической переработке полиметаллических сульфидов свинца, меди, цинка, серебра последнее извлекается вместе с основным металлом в виде серебро содержащих свинца, меди или цинка.
Для обогащения серебросодержащего свинца серебром применяют процесс Паркеса или Паттинсона.
По процессу Паркеса серебросодержащий свинец плавят вместе с металлическим цинком. При охлаждении тройного сплава свинец — серебро — цинк ниже 400° отделяется нижний слой состоящий из жидкого свинца, который содержит небольшое количество цинка и серебра, и верхний твердый слой, состоящий из смешанных кристаллов цинк — серебро с небольшим количеством свинца. Образование смешанных кристаллов цинк — серебро основывается на более высокой растворимости серебра в цинке, чем в свинце, и на разделении при охлаждении серебросодержащего цинка и свинца на два слоя. При отгонке цинка (точка кипения которого 907°) из сплава свинец — цинк — серебро остается свинец. который содержит 8—12% серебра и служит для получения сырого серебра путем купелирования. Из тройного сплава свинец- цинк — серебро цинк может быть удален в виде Na 2 Zn02 плавлением с Na2 C03 .
По процессу Паттинсона расплавленный серебросодержащий свинец медленно охлаждается. Свинец, который кристаллизуй первым, отделяется до тех пор, пока расплав не достигнет состава эвтектики с содержанием 2,25% серебра. Эвтектика затвердевает при 304° и служит затем для получения сырого серебра методом купелирования.
При купелировании свинец, содержащий 2,25—12% серебра, плавится в купелях в печи, куда подают воздух или кислород и поверхность расплавленного металла. Окись свинца (свинцовый глет) РЬО вместе с окислами мышьяка, сурьмы, цинка и меди, образовавшимися при полном окислении серебросодержащего свинца (с большим содержанием серебра), удаляют с поверхности сырого серебра ,который содержит примерно 95% Ag.
Отделение серебра от серебросодержащего свинца возможно также электролитическим путем, применяя аноды из серебросодержащего свинца, а в качестве электролита — гексафторокремневую кислоту H 2 [SiF6 ] с гексафторосиликатом свинца Pb[SiF6 ]. При электролизе свинец осаждается на катоде, а серебро вместе с золотом, платиной и платиновыми металлами переходят в анодный шлам. Аналогично при электролитическом рафинировании серебросодержащей меди, которую используют в качестве анодов (применяя при этом разбавленную серную кислоту как электролит), на катоде электролитически осаждают медь, а серебро и золото месте с платиновыми металлами также переводят в анодный шлам.
Извлечение серебра, золота и платиновых металлов из анодного шлама легко осуществляется химическим путем. В отличие от золота и платиновых металлов серебро легко растворяется азотной кислоте.
Из нитрата серебра AgNO 3 металлическое серебро можно осадить сульфатом железа(II), металлическим цинком, формальдегидом в аммиачной среде или нитратом марганца(II) в щелочной :
3AgNO 3 + 3FeSO4 = 3Ag + Fe(NO3 )3 + Fe2 (SO4 )3
2AgNO 3 + Zn = 2Ag + Zn(NO3 )2
2[AgNH 3 )2 ]OH + HCHO = 2Ag + 3NH3 + HCOONH4 + H2 O
2AgNO 3 + Mn(NO3 )2 + 4NaОН = 2Ag + MnO2 + 4NaNO3 + 2H2 O
Примерно 20% мирового количества серебра получают переработкой собственно серебряных руд и рекуперацией серебренных изделий пли серебряного лома.
Измельченную, размолотую и обогащенную (в случае низкого содержания серебра) серебряную руду перерабатывают методами цианирования, амальгамирования, хлорирования и др.
В случае переработки методом цианирования тонко измельченную руду (природное серебро, аргентит или кераргирит) смешивают с 0,4%-ным раствором NaCN и перемешивают струей воздуха водном растворе цианида натрия в присутствии кислорода воздухасеребро и аргентит растворяются медленнее, чем керарпирит
2Ag + 4NaCN + H 2 0 + 1 /2 02 = 2Na[Ag(CN)2 ] + 2NaOH
Ag 2 S + 5NaCN + H2 0 + 1 /2 02 = 2Na[Ag(CN)2 ] + 2NaOH + NaSGN
AgCl + 2NaCN =Na[Ag(CN) 2 ] + NaCl
Сульфид серебра Ag 2 S растворяется в тетрацианоцинкате(II) натрия по реакции
Ag 2 S + Na2 [Zn(CN)4 ] = 2Na[Ag(CN)2 ] + ZnS
Количество взятого для переработки серебряных руд цианида натрия больше теоретически необходимого, поскольку серебренные руды часто содержат соединения меди, железа и цинка, которые также реагируют с цианидом натрия.
Цианирование осуществляется в деревянных чанах диаметром 10-12 м.
Из растворов комплексных цианидов серебра серебро может быть осаждено в виде металла тонко измельченным металлическим цинком или алюминием. Осаждение металлического серебра из растворов комплексных цианидов серебра металлическим цинком или алюминием осуществляется по уравнениям
2Na[Ag(CN) 2 ] + Zn = 2Ag + Xa2 [Zn(CX)4 ]
3Na[Ag(CN) 2 ] + Al + 4NaOH + 2H2 O = 3Ag + Ха[А1(ОН)4 (Н2 O)2 ]+6NaCN
Сырое серебро плавится, отливается в виде брусков и затем рафинируется электролитическим или химическим методом.
Можно также извлечь комплексный анион [Ag(CN) 2 ] с помощью анионообменных смол. Применяют анионообменные сульфинированные смолы R2 S04 (предварительно обработанные 5%-ным водным раствором серной кислоты).
Реакцию ионного обмена в процессе извлечения анионов [Ag(CN)2 ] с помощью анионообменных смол (предпочтительно в виде пористых анионитов) можно представить следующим образом:
R 2 S04 + 2[Ag(CN)2 ]— -> 2R[Ag(CN)2 ] + SO2-
Чтобы реакция обмена протекала создают кислую среду (рН — 3,5).
Комплексные цианиды вымывают из анионообменной смолы селективным элюентом, например 2 н. раствором цианида калия или натрия.
Процесс амальгамирования применяют к рудам, содержащим самородное серебро, аргентит или кераргирит, он основывается на образовании амальгамы серебра.
Для амальгамирования тонко измельченные серебряные руды обрабатывают небольшим количеством воды и ртутью (1 вес. ч ртути на 6 вес. ч. серебра).
Сульфид серебра Ag 2 S под действием хлорида меди(1) (который образуется при восстановлении хлорида меди(II) ртутью) превращается в хлорид серебра:
Ag 2 S + 2CuGl = 2AgCl + Cu2 S 2CuCl2 + 2Hg = 2CuCl + Hg2 Cl2
Последний под действием ртути и хлорида меди(1) восстанавливается до металлического серебра, которое образует амальгаму с ртутью:
2AgCl + 2Hg = 2Ag+ Hg 2 Cl2
AgCl + CuCl = Ag + CuCl 2
Амальгаму серебра фильтруют под давлением. При отгонке ртути остается сырое серебро, которое очищают химическим или электрохимическим способом.
При прокаливании смеси сульфида серебра и хлорида натрия (+500…600°С) в окислительной атмосфере образуется хлорид серебра:
Ag 2 S + 2NaСl + 2O2 = 2AgCl + Na2 SO4
Для извлечения серебра из AgCl пли из Na[AgCl 2 ] применяют амальгамирование, осаждение металлического серебра медью и осаждение сульфида серебра из соединения Na2 [Ag2 (S2 03 )2 ]
AgCl — NaCl = Na[AgCl 2 ]
Na[AgCl 2 ] + Cu = Ag + Na[CuCl2 ]
2AgCl + 2Na 2 S2 O3 = Na2 [Ag2 .(S2 O3 )2 ] + 2NaCl
Na 2 [Ag2 (S2 O3 ) ]+Na2 S = Ag2 S + 2Na2 S2 O3
Сульфид серебра Ag 2 S затем перерабатывают с целью полученияэлементарного серебра.
РАФИНИРОВАНИЕ СЕРЕБРА
Сырое серебро можно рафинировать химическим или электролитическим путем.
В химическом процессе сырое металлическое серебро растворяют в азотной кислоте, очищенный перекристаллизацией нитрат серебра обрабатывают аммиаком, превращая его в гидроокись диамминосеребра; последнюю восстанавливают сульфитом аммония (берут точно рассчитанное количество) при +70°C до чистого металла серебро плавят над негашеной известью в токе водорода затем в вакууме:
3Ag +4HNO 3 = 3AgNO3 + NО + 2Н2 O
AgNO 3 + ЗNН4 ОН = [Ag(XH3 )2 ]OH + NН4 NO3 + 2H2 O
2[Ag(NH 3 )2 ]OH + (NH4 )2 SO3 + ЗН2 O = 2Ag + (NH4 )2 SO4 + 4NH4 OH
При электролитическом рафинировании применяют аноды из сырого серебра, а в качестве электролита берут раствор нитрата серебра. По мере пропускания постоянного тока через электролит чистое серебро электролитически осаждается на катодах, а металлы активные, чем серебро, переходят (из анодов) в раствор ионов. При этом золото, платина и платиновые металлы остаются в анодном шламе.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Серебро проявляет большее сходство с палладием (за которым он следует в периодической системе), чем с рубидием (с которым он находится рядом в I группе периодической системы и в том же пятом периоде).
Расположение серебра в побочной подгруппе I группы периодической системы определяется электронной структурой атома которая аналогична электронной структуре атома рубидия. Большое различие в химических свойствах серебра и рубидия определяется разной степенью заполненности электронами 4й-орбитали. Атом серебра отличается от атома палладия наличием одного электрона на 5й-орбитали.
По большинству физических и химических свойств серебро приближается к меди и золоту. В подгруппе меди серебро (средний элемент) обладает наиболее низкими температурами плавления и кипения и максимальным значением коэффициента расширения, максимальной тепло- и электропроводностью.
Физико-химические свойства серебра в значительной степени зависят от его чистоты.
Металлическое серебро в компактном полированном виде (бруски, трубки, проволока, пластинки, листы) представляет собой белый блестящий металл, обладающий большой отражательной способностью по отношению к инфракрасным и видимым лучами и более слабой — к ультрафиолетовым лучам. Серебро в виде тонких листочков (они кажутся синими или фиолетовыми в проходящем свете) обладает электрическими и оптическими свойствами, отличными от свойств металлического серебра в слитках.
Коллоидные растворы серебра окрашены в розовый (до коричневого) цвет и могут быть получены восстановлением суспензий Ag 2 O водородом при +50°C (или другими восстановителями, например сахаром, окисью углерода, цитратом железа(II), цитратом аммония. хлоридом олова(II), пирогаллолом, фенолом, фосфором в эфире, фосфорноватистой кислотой, формальдегидом, гидразином, фенилгидразином и др.), а также путем создания электрической дуги в воде между двумя серебряными электродами. Длястабилизации коллоидных растворов серебра применяют белки, желатину, гуммиарабик, агар-агар и другие органические вещества, играющие роль защитных коллоидов.
Белковое коллоидное серебро (протаргол и колларгол) применяется как фармацевтический препарат.
В нейтральных или слабо щелочных растворах гидрозоль серебра ведет себя как отрицательный коллоид, а в слабо кислых растворах — как положительный.
Коллоидное серебро является энергичным восстановителем по отношению к Fe 2 Cl6 , HgCl2 , KMn04 , разбавленной HN03 , обладает хорошей адсорбционной способностью (по отношению к кислороду, водороду, метану, этану и др.), является катализатором и сильным бактерицидом (до появления антибиотиков применялся при обработке слизистых оболочек) и служит для лечения некоторых трудно излечиваемых кожных болезней. Вода, хранящаяся в серебряных сосудах, стерилизуется и не портится длительное время благодаря наличию иона Ag+ , образующегося в результате контакта воды со стенками посуды.
Металлическое серебро обладает кубической гранецентрированной решеткой с плотностью 10,50 г/см 3 при +20°C, температура плавления +960,5°C, температура кипения +2177°C (пары желтовато-синие); оно диамагнитно, является очень хорошим проводником тепла и электричества (удельное сопротивление при +20°C равно 1,59 мком/см). В числе физико-механических свойств следует отметить пластичность, относительную мягкость (твердость 2,5—3 балла по шкале Мооса), ковкость и тягучесть (легко протягивается и прокатывается), малую прочность. Серебро образует сплавы типа твердых растворов с золотом с палладием и интерметаллические соединения с элементами Li, Mg, Ca, Sr, Ba, Zn, Cd, Hg, Al, Ga, In, Tl, Pr, Sn, Zr, Th, P, Sb, S, Se, а также сплавы типа эвтектик с элементами Bi, Ge, Ni, Pb, Si, Na, Tl
При легировании устраняются основные недостатки серебра, такие, как мягкость, низкая механическая прочность и высокая реакционная способность по отношению к сере и сульфидам. Некоторые газы, например водород, кислород, окись и двуокись углерода, растворяются в серебре, причем растворимость их пропорциональна квадратному корню от давления. Растворимость кислорода в серебре максимальна при +400…450°C (когда 1 объем серебра поглощает до 5 объемов кислорода).
Рекомендуется избегать охлаждения серебра, насыщенного кислородом, поскольку выделение этого газа из охлаждаемого серебра может сопровождаться взрывом. При поглощении кислорода или водорода серебро становится хрупким.
Азот и инертные газы с трудом растворяются в серебре при температуре выше -78°C.
С химической точки зрения серебро достаточно инертно, оно не проявляет способности к ионизации и легко вытесняется из соединения более активными металлами или водородом.
Под действием влаги и света галогены легко взаимодействуют с металлическим серебром образуя соответствующие галогениды.
Соляная и бромистоводородная кислоты в концентрированных растворах медленно реагируют с серебром:
2Ag + 4НСl = 2H[AgCl 2 ] + Н2
2Ag + 4НВr = 2H[AgBr 2 ] + Н2
Кислород взаимодействует с нагретым до 168° металлическим серебром при разных давлениях с образованием Ag 2 O. Озон при +225°С в присутствии влаги (или перекиси водорода) действует на металлическое серебро, образуя высшие окислы серебра.
Сера, реагируя с нагретым до +179°С с металлическим серебром, образует черный сульфид серебра Ag 2 S. Сероводород в присутствии кислорода воздуха и воды взаимодействует с металлическим серебром при комнатной температуре по уравнению
2Ag + H 2 S +1 /2 O2 — Ag2 S + H2 O
Металлическое серебро растворяется в H 2 SO4 (60° Be) при нагревании, в разб. HN03 на холоду и в растворах цианидов щелочных металлов в присутствии воздуха (кислорода или другого окислителя):
2Ag + 2H 2 SO4 = Ag2 SO4 + SO2 + 2H2 O
3Ag + 4HNO 3 + 3AgNO3 + NO + 2H2 O
2Ag + 4NaCN + H 2 O + l /2 O2 = 2Na[Ag(CN)2 ] + 2NaOH
Cелен, теллур, фосфор, мышьяк и углерод реагируют с металлическим серебром при нагревании с образованием Ag 2 Se, Ag2 Te, Ag3 P, Ag3 As, Ag4 C. Азот непосредственно не взаимодействует с серебром.
Органические кислоты и расплавленные щелочи пли соли щелочных металлов не реагируют с металлическим серебром. Хлорид натрия в концентрированных растворах и в присутствии кислорода воздуха медленно взаимодействует с серебром с образованием хлорида серебра.
В солянокислом растворе серебро восстанавливает некоторые соли металлов, такие, как CuCl 2 , HgCL2 , FeI2 . VOC12 .
ПРИМЕНЕНИЕ
В химической промышленности применяются аппараты из серебра (для получения ледяной уксусной кислоты, фенола), лабораторная посуда (тигли или лодочки, в которых плавятся чистые щелочи или соли щелочных металлов, оказывающие разъедающее действие на большинство других металлов), лабораторные инструменты (шпатели, щипцы, сита и др.).
Серебро и его соединения применяются в качестве катализаторов в реакциях обмена водород — дейтерий, детонации смеси воздух — ацетилен, при сжигании окиси углерода, окислении спиртов в альдегиды кислоты и др.
В пищевой промышленности применяются серебряные аппараты в которых приготовляют фруктовые соки и другие напитки. В медицине известен ряд фармацевтических препаратов, содержащих коллоидное серебро.
Металлическое серебро служит для изготовления высококачественных оптических зеркал путем термического испарения. Бруски (или электролитический порошок) серебра служат положительными электродами в аккумуляторах, в которых отрицательными электродами являются пластинки из окиси цинка, электролит — едкое кали.
Существенную долю серебра потребляет электротехническая промышленность для серебрения медных проводников и при использовании высокочастотных волноводов. Серебро используется при производстве транзисторов, микросхем и других радиоэлектронных компонентов.
Сплавы серебра широко применяются для изготовления монет, зубных пломб, мостов и протезов, столовой посуды, в холодильной химической промышленности.
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА)
Известны соединения, в которых серебро одно-, двух- и трех- валентно. В отличие от устойчивых соединений одновалентного серебра соединения двух- и трехвалентного серебра немногочисленны и мало устойчивы.
Соединения одновалентного серебра
Известны многочисленные устойчивые соединения (простые и .координационные) одновалентного серебра. Ион одновалентного серебра Ag + с радиусом 1.55 диамагнитен, бесцветен, гидратирован, легко поляризуется, является окислителем (легко восстанавливается различными восстановителями до металлического серебра) и играет роль катализатора в реакции окисления иона марганца (II) анионом: S2 02- 8 .
Большинство соединений серебра (I) плохо растворимо в воде. Нитрат, перхлорат, хлорат, фторид растворяются в воде, а ацетат и сульфат серебра растворимы частично. Соли серебра (I) белые или слегка желтоватые (когда аннон соли бесцветен).
Вследствие деформируемости электронных оболочек иона серебра(I) некоторые его соединения с бесцветными анионами окрашены.
Многие из соединений серебра (I) окрашиваются в серый под действием солнечного света, что обусловлено процессом восстановления до металлического серебра.
У солей серебра(I) мало выражена склонность к гидролизу .При нагревании солей серебра со смесью карбоната натрия и угля образуется металлическое серебро:
2AgNO 3 + Na2 CO3 + 4С = 2Ag + 2NaNO2 + 5CO
Известны многочисленные координационные соединения серебра(I), в которых координационное число серебра равно 2, 3 и 4.
Неорганические соединения, Окись серебра
2AgNO 3 + 2КОН = Ag2 O + 2KNO3 + Н2 O
Окись серебра представляет собой диамагнитный кристаллический порошок (кубические кристаллы) коричнево-черного цвета с плотностью 7,1 — 7,4 г/см 3 , который медленно чернеет на свету высвобождая кислород, и разлагается на элементы при нагреваний до +200°C:
Ag 2 O=2Ag + ?O2
Водород, окись углерода, перекись водорода и многие металлы восстанавливают окись серебра в водной суспензии до металлического серебра:
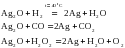
При окислении Ag 2 O озоном образуется окись серебра(II) Окись серебра (I) растворяется в плавиковой и азотной кислотах в солях аммония, в растворах цианидов щелочных металлов, в аммиаке и т. д.
Ag 2 O + 2HF = 2AgF + Н2 O
Ag 2 O + 2HNO3 = 2AgNO3
Ag 2 O + 2(NH4 )2 CO3 = [Ag(NH3 )2 ]2 CO3 + 2H2 O +CO2
Ag 2 O + 4KCN + H2 O = K[Ag(CN)2 ] + 2KOH
Ag 2 O + 4NH4 OH = 2[Ag(NH3 )2 ]OH + 3H2 O или
Ag 2 O + 4NH3 + H2 O = 2[Ag(NH3 )2 ]OH
При хранении гидроокись диамминсеребра [Ag (NH 3 )2 ]OH (которая является растворимым основанием с окислительными cсвойствами) превращается в способный взрываться имид серебра;
2[Ag(NH 3 )2 ]OH = Ag2 NH + 3NH3 + 2H2 O
Растворы хлоридов щелочных металлов превращают окись серебра(I) в хлорид серебра(I), а при действии избытка HgI 2 нa Ag2 O образуется Ag2 [HgI4 ].
Окись серебра — энергичный окислитель по отношению ксоединениям хрома(III), альдегидам и галогенопроизводным углеводородов:
5Ag 2 O + Cr2 О3 = 2Ag2 CrO4 + 6Ag
3Ag 2 O + 2Cr(OH)3 + 4NaOH = 2Na2 GrO4 + 6Ag + 5H2 O
Окисление галогенопроизводных углеводородов приводит кобразованию спиртов, а окисление альдегидов — соответствующих кислот.
Растворы сульфидов щелочных металлов и водные суспензии сульфидов тяжелых металлов превращают окись Ag 2 O в сульфид Ag2 S.
Суспензии окиси серебра применяются в медицине как антисептическое средство. Смесь, состоящая из окиси серебра с легко восстанавливающимися окислами (например, меди или марганца).
является хорошим катализатором окисления окиси углерода кислородом воздуха при обычной температуре. Смесь состава 5% Ag 3 O, 15%Сo2 Оз, 30% СuО и 50% МnO2 , названная «гопкалитом», служит для зарядки противогазов в качестве защитного слоя против окиси углерода.
Гидроокись серебра,
Соединение AgOH обладает амфотерными свойствами, легко поглощает двуокись углерода из воздуха и при нагревании с Na 2 S образует аргентаты эмпирических формул Ag2 O
- 3Na2 O и Ag2 O
- 3Na2 O.
Основные свойства гидроокиси серебра усиливаются в присутствии аммиака вследствие образования гидроокиси диамминсеребра [Ag (NH 3 )2 ]OH.
Фторид серебра,
2Ag + F 2 = 2AgF + 97,4 ккал
Ag 2 CO3 + 2HF = 2AgF + H2 O + CO2
Ag 2 O + 2HF = 2AgF + H2 O
Ag[BF 4 ] = AgF + BF3
Выделение кристаллов AgF из водного раствора осуществляется путем концентрирования в вакууме в темноте.
Соединение AgF представляет собой расплывающиеся на воздухе бесцветные гранецентрированные кубические кристаллы с плотностью 5,85 г/см 3 и температурой плавления +435°C; фторид серебра плохо растворим в спирте, легко растворим в воде (в отличие от остальных галогенидов серебра) и в аммиаке; его нельзя хранить в стеклянной посуде, поскольку он разрушает стекло.
Под действием паров воды и водорода при нагревании фторид серебра восстанавливается до металлического серебра:
2Ag+ Н 2 O = 2Ag + 2HF + ?O2
2AgF + Н 2 = 2Ag + 2HF
Ультрафиолетовые лучи вызывают превращение фторида серебра в полуфторид Ag 2 F. Водный раствор фторида серебра служит для дезинфекции питьевой воды.
Известны кристаллогидраты AgF •nH 2 О (где п — 1, 2, 4) и фторокислоты H[AgF2 l, H2 [AgF3 ], H3 [AgF].
Моногидрат AgF
- Н 2 О осаждается в виде светло-желтых кубических кристаллов при упаривании в вакууме раствора безводного AgF в воде.
Дигидрат AgF
- 2H 2 0, представляющий собой твердые бесцветные призматические кристаллы с температурой плавления +42°C, выпадает из концентрированных растворов AgF.
Из раствора, полученного растворением Ag 2 O в 20%-ной плавиковой кислоте, выпадают кристаллы AgF
— 4Н2 0. При охлаждении раствора AgF в плавиковой кислоте осаждаются бесцветные кристаллы H3 [AgF4 ], которые при 0°C в токе воздуха превращаются в белые кристаллы H[AgF2 ].
Хлорид серебра,
Соединение AgCl представляет собой диамагнитные белые кубические гранецептрированные кристаллы с т. пл. +455°C и т. кип. +1554°C. Хлорид серебра растворяется в растворах хлоридов (NaCl, KС1, NH 4 C1, СаС12 , MnCl2 ).
цианидов, тиосульфатов, нитратов щелочных металлов и аммиаке с образованием растворимых и бесцветных координационных соединений
AgCl + КСl = K[AgCl 2 ]
AgCl + 2Na 2 S2 O3 + Na3 [Ag(S2 03 )2 ] + NaCl
AgCl + 2KCN = K[Ag(CN) 2 ] + KCl
AgCl + 2NH 3 = [Ag(NH3 )2 ]Cl
Под действием света хлорид серебра восстанавливается (окрашиваясь в фиолетовый, а затем в черный цвет) с высвобождением ребра и хлора:
AgCl = Ag + 1 /2 Cl2
На этой реакции основывается применение хлорида серебра в фотопленках.
Бромид серебра,
AgNO 3 + KBr = AgBr + KNO3
Ag + 1 /2 Br2 = AgBr + 27,4 ккал
Соединение AgBr может существовать либо в коллоидной форме либо в виде диамагнитных желтых кубических гранецентрированных кристаллов с плотностью 6,47 г/см 3 , т. пл. +434°C и т. кип. +15370 C. Бромид серебра плохо растворим в воде и растворяется в аммиаке тпосульфатах щелочных металлов и в конц. H2 SO4 при нагревании:
AgBr + 2NH 4 OH = [Ag(NH3 )2 ]Br + 2H2 O
2AgBr + H 2 SO4 = Ag2 SO4 + 2HBr
AgBr + 2Na 2 S2 O3 -> Na3 [Ag(S2 O3 )2 ] + NaBr
Бромид серебра более чувствителен к свету, чем хлорид серебра, и иод действием света разлагается на элементы:
AgBr = Ag + 1 /2 Br2
Бромистое серебро восстанавливается цинком в кислой среде или металлами (такими, как свинец или медь) при нагревании а также сплавлением с безводным карбонатом натрия:
2AgBr +Na 2 CO3 = 2Ag + 2NaBr + СO2
На холоду AgBr поглощает аммиак, причем могут образовываться различные аддукты: AgBr
- NH 3 , 2AgBr
- 3NH3 , AgBr
- 3NH3
Бромид серебра применяется для изготовления фотопленок и в качестве катализатора при получении монокарбоновых жирных кислот или олефинов с помощью реактива Гриньяра.
Иодид серебра,
AgNO 3 + HI = Agl + HNO3
Ag + V 2 I2 = Agl + 29,3 ккал
AgNO 3 + KI = Agl + KNO3
Ag + HI = Agl + l /2 H2
Иодид серебра может существовать либо в виде прозрачных лучепреломляющих лимонно-желтых гексагональных призматических кристаллов, либо в виде двулучепреломляющих красных октаэдров.
AgNO 3 + KCN = AgCN+KNO3
Цианид серебра
AgCN + 2NH 4 OH = [Ag(NH3 )2 ]CN +2H2 O
AgCN + KCN = K[Ag(СN) 2 ]
Уксусная кислота и сероводород взаимодействуют с дициано-аргентатами Me 1 [Ag(CN)2 ] по уравнениям
K[Ag(CN) 2 ] + HNO3 = AgCN + KNO3 + HCN
2K[Ag(CN) 2 ] + 2H2 S = Ag2 S + K2 S + 4HCN
При обработке K[Ag(CN) 2 ] нитратом серебра образуется дицианоаргентат серебра Ag[Ag(CN)2 ], представляющий собой димерную форму моноцианида серебра.
Известны цианоаргентаты типов Me 1 2 [Ag(CN)3 ] и Me1 2 [Ag(CN)4 ].
Оксалат серебра, Периодаты серебра, Координационные соединения
Большинство простых соединений одновалентного серебра с неорганическими и органическими реагентами образуют координационные соединения. Благодаря образованию координационных соединений многие плохо растворимые в воде соединения серебра превращаются в легко растворимые. Серебро может иметь координационные числа 2, 3, 4 и 6.
Известны многочисленные координационные соединения у которых вокруг центрального иона серебра скоординированы нейтральные молекулы аммиака или аминов (моно- или диметиламин, пиридин, этилендиампн. анилин и т.д.).
При действии аммиака или различных органических аминов на окись, гидроокись, нитрат, сульфат, карбонат серебра образуются соединения с комплексным катионом, например [Ag(NH 3 )2 ]+ , [AgEnK ]+ , [AgEn2 ]+ , [AgPy]+ , [AgPy2 ]+ .
Устойчивость комплексных катионов серебра ниже устойчивости соответствующих катионов меди(II).
При растворении галогенидов серебра (AgCl, AgBr, AgI) в растворах галогенидов, псевдогалогенидов или тиосульфатов щёлочных металлов образуются растворимые в воде координационные соединения, содержащие комплексные анионы, например [AgCl 2 ]— , [AgCl3 ]2- , [AgCl4 ]3- , Ag Br3 ]2- и т.д.
n-Диметиламинобензилиденродамин образует с концентрированными растворами солей серебра фиолетовый осадок.
С разбавленными растворами солей серебра диметиламинобензил-иденродамин не образует осадка, а только окрашивает раствор в интенсивно фиолетовый цвет.
Соединения двухвалентного серебра
Известно немного соединений двухвалентного серебра. Для них характерна низкая устойчивость и способность разлагаться водой с выделением кислорода.
Неорганические соединения
Окись серебра,AgO, получают действием озона на металличекое серебро или на Ag 2 O, AgNO3 или Ag2 SO4 , обработкой раствора AgNO3 раствором K2 S2 O8 , обработкой щелочной суспензии Ag2 O перманганатом калия, анодным окислением металлического серебра с использованием в качестве электролита разбавленного раствора H2 SO4 или NaOH.
Ag 2 O +О3 = 2AgO +O2
2AgNO 3 + K2 S2 O8 + 4KOH = 2AgO + 2K2 SO4 + 2KNO3 + 2H2 O
Ag 2 O + 2KMnO4 + 2КОН = 2AgO + 2K2 MnO4 +H2 O
Обработка K 2 S2 O8 соединений серебра в слабо кислой cpeде и в присутствии пиридина приводит к образованию оранжевого кристаллического осадка [AgPy]S2 O8 .
Окись серебра, Фторид серебра,
Ag + F 2 = AgF2 + 84,5 кал
Фторид серебра представляет собой парамагнитный коричневочерный порошок с т. пл. +690°C. Он разлагается под действием воды или влажного воздуха и обладает окислительным действием по отношению к иодидам, спирту, солям хрома(III) и марганца (II)
6AgF 2 + ЗН2 O = 6AgF + 6HF + O3
Сульфид серебра,AgS, образуется в виде коричневого осадка при обработке раствора AgNO 3 в беизоилпропиле раствором серы в сероуглероде.
Нитрат серебра , Ag(NO3 )2 , получают окислением Ag(NO3 )2 озоном. Это бесцветные кристаллы, разлагающиеся водой:
4Ag(NO 3 )2 + 2Н2 O = 4AgNO3 + 4HNO3 + O2
Координационные соединения
Известен ряд координационных соединений двухвалентного серебра типов [Ag(G 5 H5 N)4 ]X2 и [AgAm2 ]X2 (где Am == фенантролин C12 H8 N2 , дипиридил C10 H8 N2 и X = NO— 3 , СlO— 3 , ClO— 4 )
Соединения трехвалентного серебра
Известно небольшое число соединений трехвалентного (ребра, например Ag 2 O3 ,K6 H[Ag(IO6 )2 ] •10 H2 O, K7 [Ag(IO6 )2 ], Na7 H2 [Ag(TeO6 )2 ] •14H2 O и др.
Окись серебра , Ag2 O3 , образуется в смеси с окисью серебра(II) — анодном окислении серебра или при действии фтора (пли пероcульфата) на соль серебра(I).
Черная кристаллическая смесь Ag2 O3 AgO неустойчива, обладает окислительными свойствами и при легком нагревании превращается в AgO.
Диортопериодатоаргеитаты(III),Me I 6 H[Ag(IO6 )2 ]•nH2 O,являются диамагнитными солями оранжевого цвета c кристаллами красивой формы; их рассматривают как производные — гипотетической кислоты H7 [Ag(IO6 )2 ]. При окислении смеси водных растворов AgNO3 , К5 IO6 и КОН надсернокислым калием K2 S2 O8 образуется коричневый раствор, из которого при концентрировании путем медленного испарения выпадают оранжевые кристаллы K6 H[Ag(IO6 )2 ] •10Н2 O, а при быстром упариваииии — K7 [Ag(IO6 )2 ] •КОН •8Н2 O. Обработка соединения K6 H[Ag(IO6 )2 ] карбонатом натрия приводит к осаждению оранжево-желтых кристаллов Na5 KH[Ag(IO6 )7] •16Н2 O.
Диортотеллураргентаты Me + 6 H3 [Ag(TeO6 )2]•nH2 O Me+ 7 H2 [Ag(TeO6 )2 ]•nН2 O представляют собой красиво кристаллизующиеся желтые диамагнитные соли — производные гипотической кислоты H9 [Ag(TeO6 )2 ].
Окисление водного раствора смеси Ag 2 S04 , Na2 CO3 и ТеO2 пероксосульфатом калия K2 S2 O5 приводит к образованию коричневого раствора, из которого при концентрировании путем изотеримического испарения осаждаются желтые кристаллы Na6 H3 [Ag(Te06 )2 ] •18Н2 0. При использовании больших количеств корбаната натрия выпадают кристаллыNa7 H2 [Ag(Te06 )2 ]•14Н2
СПИСОК ЛИТЕРАТУРЫ
[Электронный ресурс]//URL: https://inzhpro.ru/referat/istoriya-otkryitiya-serebra/
