Как известно, абсолютно все вещества в природе обладают собственным агрегатным состоянием, наиболее распространенным из которых является газ. Составляющие его элементы – молекулы и атомы – находятся друг от друга на большом расстоянии. При этом они расположены в свободном постоянном движении. Эта особенность указывает на то, что взаимодействие элементарных частиц осуществляется только в момент сближения, внезапно увеличивая скорость сталкивающихся атомов и их величину. Именно этим свойством газообразное состояние любого вещества отличается от жидкого и твердого.
Законы, определяющие характеристики и поведение такого вещества, проще всего сформулировать и исследовать на примере состояния, в котором наблюдается низкая плотность молекул и атомов низкая.
Данное явление получило в физике название «идеальный газ», предполагающее максимальное расстояние между частицами, которое превышает радиус взаимодействия межмолекулярных сил.
default/handbook/article/relatedWorks.twig
Для него обязательно должны существовать такие условия:
- достаточно маленькие размеры молекул;
- отсутствие силы взаимодействия между элементами;
- столкновения должны происходят как столкновения упругих шариков.
Само определение “физика” дало возможность современной науке выстроить универсальную молекулярно-кинетическую гипотезу, выводы которой находят экспериментальной подтверждение во многих сферах. По такому различаются газы классические и квантовые.
Классические и квантовые газы: особенности и различие
Характеристики классических газов находят отражение в законах и методах статистической физики. Движение элементарных частиц в этом газе не зависит друг от друга, а оказываемое давление на стенку приравнивается сумме внутренних импульсов, которые при очередном столкновении передаются конкретным молекулами за определенный период времени. Их начальная энергия же в общем составляет объединенную элементами систему.
Работа газа в этом случае всегда рассчитывается посредством уравнения Клапейрона $p = nkT$. Наиболее ярким примером такого явления выступают законы, которые были ранее выведены известными физиками-теоретиками Бойль-Мариоттом и Гей-Люссаком. Если идеальный газ самостоятельно понижает температуру или увеличивает плотность движущихся частиц до определенного показателя, следовательно, повышаются его волновые свойства. Происходит трансформация газа в квантовое состояние, при котором длина волн молекул и атомов сравнима с первостепенным расстоянием между ними. Здесь выделяют два типа идеального газа: в виде учений Бозе и Эйнштейна, где элементы одного вида имеют целочисленный спин; а также статистику Ферми и Дирака, предполагающую наличие частиц, имеющих полуцелый спин.
Электрический ток в газах (2)
... ток. рекомбинации Нагревание газа до высокой температуры не является единственные способом ионизации молекул или атомов газа. Нейтральные атомы или молекулы газа могут ионизироваться также ... этого поля делается достаточно большой, то может произойти пробой, т.е. молния, ударяющая в Землю. При этом молния ... Применение коронного разряда. Счетчики элементарных частиц При попадании в счетчик быс
Эти физические величину способны стать больше только при увеличении плотности. В такой ситуации частицы обладают максимальным энергетическим потенциалом. С этой точки зрения необходимо рассматривать теорию строения звезд: в тех из них, в которых начальная плотность выше 1—10 кг/см3, работает закон электронов. А где указанный параметр превышает 109 кг/см3, физическое вещество постепенно превращается в нейроны.
В металлах применение теории, при которой классический газ трансформируется в квантовый, позволяет точно объяснить большую часть металлических характеристик состояния вещества: чем плотнее элементарные частицы, тем система ближе к идеалу. При явно выраженных низких температурах разнообразных тел в жидких и твердых состояниях хаотичное движение молекул возможно изучать, как работу идеального газа, который представлен слабыми возбуждениями. В этих случаях наблюдается вклад в энергию вещества, который добавляют частицы.
Зависимость плотности газа от температуры
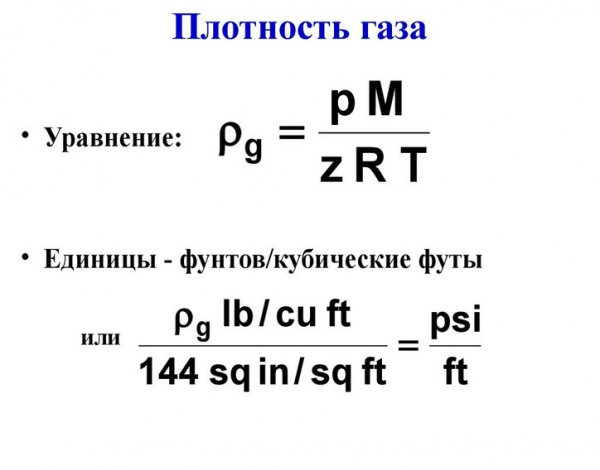
Рисунок 1. Плотность газа. Автор24 — интернет-биржа студенческих работ
Плотность газа считается одной из важнейших особенностей его свойств. Говоря о данной величине, ученые в основном имеют в виду плотность тел при нормальных условиях (то есть при температуре примерно 0° С и давлении не более 760 мм рт. ст.).
Кроме того, зачастую пользуются относительной плотностью идеального газа, которая предполагает правильное соотношение давления веществ к плотности воздуха при аналогичных условиях.
Таким образом, относительная плотность газа не зависит от условий, в которых он расположен, так как согласно гипотезам газового состояния, объемы всех элементов меняются при изменениях температуры и давления одинаково.
Что же на самом деле происходит с плотностью некоторой массы исследуемого объекта, если температура увеличивается, а давление остается прежним? Здесь необходимо вспомнить, что плотность любого физического вещества равна массе тела, деленной на его объем. Так как масса газа всегда постоянна, то при нагревании плотность будет уменьшаться во столько раз, во сколько увеличился сам объем.
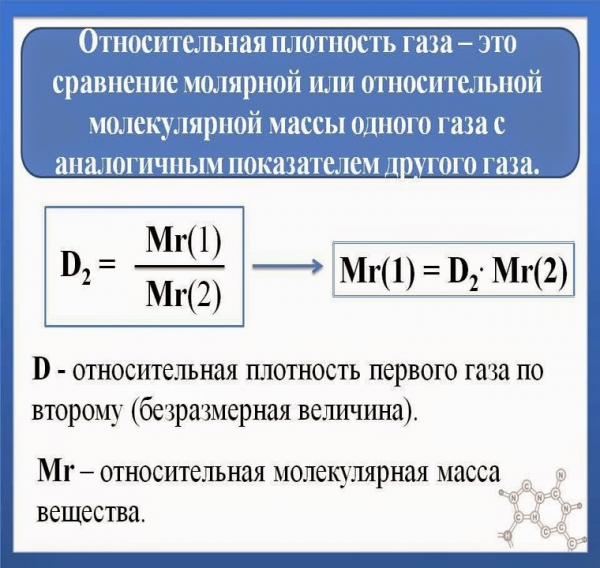
Рисунок 2. Относительная плотность газа. Автор24 — интернет-биржа студенческих работ
Объем газа прямо пропорционален абсолютной и начальной температуре, если давление остается неизменным. Следовательно, данная величина при постоянном давлении абсолютной температуре.
Теплоемкость газов

Рисунок 3. Тепловые процессы в газах. Автор24 — интернет-биржа студенческих работ
Представим, что у нас есть 1 г газа. Сколько необходимо сообщить теплоты для того, чтобы его температура возросла на 1°С? На этот вопрос, как показывает практика, невозможно предоставить однозначный ответ. Все зависит от того, в каких условиях осуществляется нагревание газа. Если объем его в результате не меняется, то для нагревания элементов нужно определенное количество теплоты; при этом автоматически увеличивается давление самого газа.
Низкотемпературная сепарация газа на Уренгойском месторождении
... но и глубокие знания свойств природных газов, процессов их промысловой обработки, поэтому рассматриваемая тема проекта — низкотемпературная сепарация газа на УКПГ, является актуальной при по ... природных газов газоконденсатных залежей. Реализация низкотемпературных процессов без энергоемких источников охлаждения может быть осуществлена за счет расширения газа, что обусловлено значительным давлением в ...
Если же нагревание происходит так, что начальное давление его остается неизменным, то следует использовать большее количество теплоты, при которой объем газа увеличится в несколько раз. Наконец, возможны и другие случаи, когда при нагревании меняются и давление, и объем: при этом потребуется такое количество теплоты, которое зависит от того, в какой степени происходят эти преобразования. Согласно сказанному, газ может иметь самые различные удельные теплоемкости, находящиеся в зависимости от условий нагревания.
Обычно выделяют две из всех этих удельных теплоемкостей:
- удельную теплоемкость при неизменном объеме ($C_v$);
- удельную теплоемкость при постоянном давлении ($C_p$).
Для определения $C_v$ необходимо нагревать газ, который помещен в замкнутый сосуд. Расширением самого предмета при нагревании можно иногда пренебречь. При определении $C_p$ желательно нагревать газ, находящийся в цилиндре, закрытый поршнем, нагрузка на который остается в любых условиях неизменной.
Теплоемкость при стабильном давлении $C_p$ значительно больше, чем теплоемкость при постоянном объеме $C_v$.
Действительно, при медленном нагревании 1 г вещества на 1° при неизменном объеме подводимая теплота направлена на увеличение внутреннего энергетического потенциала. Для нагревания же на 1° аналогичной массы газа при постоянном давлении необходимо сообщить ему определенное количество тепла, за счет которого увеличивается и внутренняя энергия газа, и совершится работа, непосредственно связанная с расширением газа.
