, в т. ч. приводит и к тому, что их внутренняя энергия зависит от плотности. С этим свойством связан эффект Джоуля-Томпсона: изменение температуры газа при его адиабатическом расширении, напр. при протекании с малой постоянной скоростью через пористую перегородку (этот процесс называется дросселированием).
Учет межмолекулярных взаимодействий и внутреннего строения молекул необходим при решении многих теоретических задач физики и физической химии. Молекул, которые можно было бы принимать как упругие шары, практически не бывает, и при расчете свойств реальных газов применяют другие молекулярные модели. Из них наиболее употребительны простые модели гармонического осциллятора и жесткого ротатора.
Реальные газы при незначительных плотностях имеют свойства, отличающиеся от свойств идеальных газов. Это различие свойств тем значительнее, чем выше плотность газа. Так, например, из уравнения Менделеева-Клайперона следует, что так называемый коэффициент сжимаемости для любого газа Zсж = pV/RT = 1. В действительности же коэффициент сжимаемости является переменной величиной, принимающей в зависимости от давления и температуры значения и большие, и меньшие единицы, и только при малых давлениях он равен единице. (см. рис 6.1)
Внутреннее строение молекул газа слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними).
Для этих свойств в первом приближении существенна только молекулярная масса реального газа. Напротив, его калорические свойства (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости при постоянном объёме — Cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений).
В соответствии с законом равнораспределения классической статистической физики на каждую степень свободы молекулы газа (поступательную, колебательную, вращательную) приходится энергия, равная 1/2
- kT. Отсюда теплоёмкость 1 моля равна:
![]()
Отступление свойств реальных газов от свойств идеальных газов обнаруживается не только при изучении сжимаемости газов, но также при изучении калорических свойств газов, например их теплоемкостей. Теплоемкости Cv и Cp идеального газа не зависят от давления (или объема ) и являются функциями только температуры. В действительности теплоемкости всех газов зависят от давления или объема.
Молекулярно-кинетическая теория газов
... моля, выражая давление через температуру и концентрацию молекул: где — концентрация молекул (число молекул в единице объема). 3. Молекулярно-кинетическое описание идеального газа Рассмотрим некоторые характеристики идеального газа с точки зрения молекулярно-кинетической теории. Будем считать, ...
Для точного расчёта калорических свойств газа необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров. Для большого числа веществ в состоянии идеального газа калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.
Электрические свойства газов связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в них электрически заряженных частиц (ионов и электронов).
При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов увеличивается.
При температурах, начиная с нескольких тысяч градусов всякий газ частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного газа.
По магнитным свойствам газы делятся на диамагнитные (к ним относятся, например, инертные газы, H2, N2, CO2, H2O) и парамагнитные (например, O2).
Диамагнитны те газы, молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля. Те же, у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики. Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г., например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников.
Применение законов классичесской статистики с учетом квантовых закономерностей позволяет рассчитать по молекулярным данным термодинамические функции газа (энтропию, внутреннюю энергию, энергии Гельмгольца и Гиббса), константы химического равновесия газофазных реакций, теплоемкость и кинетические характеристики, знание которых требуется при проектировании многих технологических процессов. Так, теплоемкость идеального газа может быть рассчитана в классической теории, если известно число i степеней свободы молекулы. Вклад каждой из вра-щат. и постулат, степеней свободы молекулы в молярную теплоемкость Суд равен R/2, а каждой из колебательных степеней свободы-JR (т. наз. закон равнораспределения).
Частица одноатомного газа обладает тремя степенями свободы, соотв. его теплоемкость составляет ЗЯ/2, что хорошо совпадает с экспериментальными данными. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы, и, согласно закону равнораспределения, Суд = 1R/2, однако это значение не совпадает с опытными данными даже при обычных температурах. Наблюдаемое расхождение, а также температурная зависимость теплоемкости газа объясняются квантовой теорией.
Внутренняя энергия реальных газов.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ.
р΄=а/V2
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, или, иными словами, против внутреннего давления, как известно из механики, идёт на увеличение потенциальной энергии системы.
Цивилизация на путях поиска идеальной энергетики будущего
... человечества появится стимул для поиска новой, так называемой идеальной энергии. Атомная и гидроэнергетика считаются наиболее экологичными из ... нового подхода к энергетике. В основе энергетики ближайшего будущего по-прежнему останется теплоэнергетика на невозобновляемых ресурсах. Однако ... мире происходит за счет использования угля, гидроэнергии, атомной энергии, газа и нефти. Но как я уже говорила, ...
Т. е. dA=p΄Vm=dП, или dП=a/V2m*dVm, откуда П=-а/Vm.
Знак минус означает, что молекулярные силы, создающие внутреннее давление р΄, являются силами притяжения. Если газ расширяется без теплообмена с окружающей средой и не совершает внешней работы, то на основании первого начала термодинамики получим, что U1=U2. Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Использование выражения для внутренней энергии идеального газа позволяет записать формулу, для расчета внутренней энергии газа Ван-дер-Ваальса в виде:
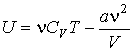
Как следует из этого выражения, внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им. По этой причине, при осуществлении изотермических процессов в газе Ван-дер-Ваальса, будет изменяться его внутренняя энергия, а, следовательно, при таких процессах подведенная к газу теплота не будет равна совершенной им работе.
Если внутренняя энергия идеального газа определяется кинетической энергией его молекул, то для газа Ван-дер-Ваальса существенное значение имеет потенциальная энергия, обусловленная силами притяжения и отталкивания. Согласно первому началу термодинамики изменение внутренней энергии газа может быть осуществлено либо сообщением ему теплоты, либо совершением над ним механической работы. Если газ адиабатически расширяется, не совершая механической работы, его внутренняя энергия остается неизменной. Для идеального газа неизменность внутренней энергии эквивалентна постоянству температуры газа.
Термодинамические свойства реальных газов.
Как известно, уравнение состояния устанавливает функциональную связь между давлением p, объемом V, температурой T и числом молей n газа в состоянии равновесия. Эта связь может выражаться не только в форме уравнения, но также графически или в виде таблиц, которые часто используются, особенно для практических целей. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
pV = nRT, где R – универсальная газовая постоянная.
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации.
Так, для газов с низкой температурой сжижения (He, H2, Ne и даже N2, O2, Ar, CO, CH4) при давлениях до 50 атм отклонения не превышают 5%, а при давлениях до 10 атм – 2%. Легко конденсирующиеся газы (CO2, SO2, Cl2, CH3Cl) уже при 1 атм обнаруживают отклонения до 2 – 3%.
Одной из наглядных характеристик отклонений реальных газов от идеального поведения оказывается мольный объем газа Vm = V/n. Для идеального газа он равен 22,414 л при 1 атм и 273 K. Наиболее удобной мерой неидеальности является фактор сжимаемости Z = pVm/RT, поскольку для идеального газа Z = l при любых условиях.
Основные свойства природных газов
... состояния газов используются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между параметрами газа, описывающая поведение газа. Такими параметрами являются давление, объем и температура. Состояние идеальных газов в условиях высоких давления и температуры ...
Рис.1.1 Зависимость фактора сжимаемости некоторых газов от давления при 298 К.
На рис. 1.1 представлены факторы сжимаемости для некоторых реальных газов как функции давления при 298 К (для сравнения поведение идеального газа показано пунктиром).
При высоких давлениях для всех газов Z > 1, т. е. их труднее сжать, чем идеальный газ, поскольку в этой области преобладают силы межмолекулярного отталкивания. Из рисунка видно, что при более низких давлениях для некоторых газов Z < 1, что объясняется преобладанием межмолекулярного притяжения. При p → 0 эффект межмолекулярного притяжения исчезает, потому что расстояние между молекулами стремится к бесконечности, и для всех газов Z → 1, т. е. в этих условиях все газы ведут себя почти идеально.
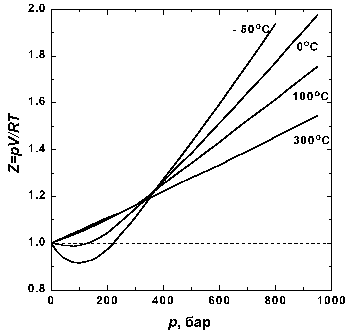
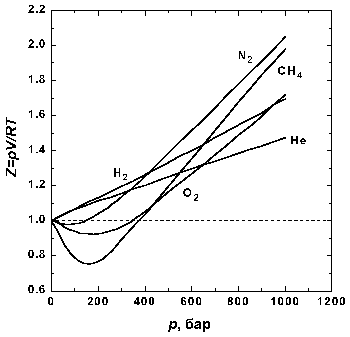
Рис 1.2. Зависимость фактора сжимаемости N2 от давления при разных температурах.
На рис. 1.2 представлены факторы сжимаемости для при разных температурах. По мере уменьшения температуры эффект межмолекулярного притяжения увеличивается (что проявляется в образовании минимума на кривых в области давлений около 100 бар).
Минимум на кривых обнаруживается для всех газов, если температура достаточно низка. У водорода и гелия, имеющих очень низкие температуры кипения, этот минимум наблюдается только при температурах значительно ниже 0° C.
Из приведенных данных видно, что при низких давлениях реальные газы могут быть более сжимаемыми (Z < 1), чем идеальный газ, а при высоких – менее (Z > 1).
Очевидно, что основными причинами отклонений свойств реальных газов от свойств идеального газа оказываются взаимное притяжение молекул и наличие у них собственного объема. Наиболее ярко межмолекулярное притяжение в реальных газах проявляется в их способности к конденсации – переходу в жидкое состояние.
Конденсация.
При понижении температуры или повышении давления наблюдаются отклонения от законов идеального газа. Когда T и P достигают некоторых определенных значений, то происходит конденсация газа, т. е. газ переходит в жидкость. Это явление уже никак не следует из уравнения состояния идеального газа. Рассмотрим его более подробно.
Рассмотрим, что происходит, когда образец газа в состоянии, отмеченном точкой А на рис. 1.3, сжимается при постоянной температуре.
Рис 1.3. Экспериментальные изотермы для СО2
Вблизи точки А давление возрастает приблизительно по закону Бойля. Заметные отклонения от закона Бойля начинают наблюдаться, когда объем становится соизмеримым со значением, указанным точкой В. В точке С сходство с идеальным поведением полностью теряется, так как оказывается, что дальнейшее уменьшение объема не вызывает роста давления; это показано горизонтальной линией CDE. Исследование содержания сосуда показывает, что сразу за точкой С появляется жидкость, и можно наблюдать две фазы, разделенные резко обозначенной границей – поверхностью раздела. Поскольку при уменьшении объема газ конденсируется, он не оказывает сопротивления дальнейшему движению поршня. Давление, соответствующее линии CDE, когда жидкость и пар находятся в равновесии, называется давлением пара жидкости при температуре опыта.
Уравнения состояния реального газа
... зависимость очень сложная. М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реальных газов с учетом ассоциации и диссоциации их молекул, который имеет следующий вид: (P ... = R·T (1 – С/( n ·Т(3+2m)/2 ), (6.6) где a, b – постоянные уравнения Ван-дер-Ваальса; С, m – постоянные, определяемые на основании опытных данных. Все темы данного ...
В точке Е весь образец представляет собой жидкость, и дальнейшее уменьшение объема образца требует значительного давления, поскольку жидкости по сравнению с газами очень трудно сжимаются, что проявляется в резком подъеме кривой слева от точки Е.
Критические явления.
Изотерма при температуре Tк играет особую роль в теории состояния вещества. Изотерма, соответствующая температуре ниже Tc, ведет себя так, как уже описано: при определенном давлении газ конденсируется в жидкость, которую можно различать по наличию поверхности раздела. Если же сжатие осуществлять при Tc, то поверхность, разделяющая две фазы, не появляется, а точка конденсации и точка полного перехода в жидкость сливаются в одну критическую точку газа. При температуре выше Tc газ невозможно обратить в жидкость никаким сжатием. Температура, давление и мольный объем в критической точке называются критической температурой Tc, критическим давлением pc и критическим мольным объемом Vc вещества. Собирательно параметры pк, Vк, и Tк называются критическими константами данного газа.
При T > Tк образец представляет собой фазу, полностью занимающую объем содержащего ее сосуда, т. е. по определению является газом. Однако плотность этой фазы может быть значительно большей, чем это типично для газов, поэтому обычно предпочитают название «сверхкритический флюид» (supercritical fluid).
В критической точке изотермический коэффициент сжимаемости 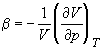 равен бесконечности, поскольку = 0. Поэтому вблизи критической точки сжимаемость вещества так велика, что ускорение силы тяжести приводит к значительным различиям плотности в верхней и нижней частях сосуда, достигающим 10% в столбике вещества высотой всего несколько сантиметров. Это затрудняет определение плотностей (удельных объемов) и, соответственно, изотерм p – V вблизи критической точки. В то же время критическую температуру можно определить весьма точно как такую температуру, при которой поверхность, разделяющая газообразную и жидкую фазы, исчезает при нагревании и вновь появляется при охлаждении. Зная критическую температуру, можно определить критическую плотность (и, соответственно, критический мольный объем), пользуясь эмпирическим правилом прямолинейного диаметра (правило Кальете-Матиаса), согласно которому средняя плотность жидкости и насыщенного пара является линейной функцией температуры:
равен бесконечности, поскольку = 0. Поэтому вблизи критической точки сжимаемость вещества так велика, что ускорение силы тяжести приводит к значительным различиям плотности в верхней и нижней частях сосуда, достигающим 10% в столбике вещества высотой всего несколько сантиметров. Это затрудняет определение плотностей (удельных объемов) и, соответственно, изотерм p – V вблизи критической точки. В то же время критическую температуру можно определить весьма точно как такую температуру, при которой поверхность, разделяющая газообразную и жидкую фазы, исчезает при нагревании и вновь появляется при охлаждении. Зная критическую температуру, можно определить критическую плотность (и, соответственно, критический мольный объем), пользуясь эмпирическим правилом прямолинейного диаметра (правило Кальете-Матиаса), согласно которому средняя плотность жидкости и насыщенного пара является линейной функцией температуры:
![]()
, где A и B – постоянные для данного вещества величины. Экстраполируя прямую средней плотности до критической температуры, можно определить критическую плотность.
Высокая сжимаемость вещества вблизи критической точки приводит к росту спонтанных флуктуаций плотности, которые сопровождаются аномальным рассеянием света. Это явление называется критической опалесценцией.
Уравнение Ван-Дер-Ваальса.
Поведение газов, которые близки к конденсации, не описывается уравнением состояния идеального газа. Однако это уравнение можно усовершенствовать так, чтобы оно приближенно описывало не только свойства газа, но и свойства жидкости. Предпринималось множество попыток для учета отклонений свойств реальных газов от свойств идеального газа путем введения различных поправок в уравнение состояния идеального газа. Наибольшее распространение вследствие простоты и физической наглядности получило уравнение Иоханнеса Дидерика Ван-дер-Ваальса (1
Уравнение состояния идеального газа. Универсальная газовая постоянная
... уравнение процесса. 2. Установить аналитическую взаимосвязь между параметрами состояния, (связь между парам Политропными процессами наз. процессы, протекающие при постоянной ... -дер-Ваальса в 1873 г. Это уравнение он получил на основе кинетической теории газов; учитывая ... процесс протека Влажный воздух нужно рассматривать как разновидность газовой смеси. Это объясняется тем, что при атмосферном давлении ...
Первая поправка в уравнении состояния идеального газа рассматривает собственный объем, занимаемый молекулами реального газа. В уравнении Дюпре (1864): p(V – νb) = νRT, где постоянная b учитывает собственный мольный объем молекул.
При понижении температуры межмолекулярное взаимодействие в реальных газах приводит к конденсации (образование жидкости).
Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления (иногда его называют статическим давлением).
Изначально величина была учтена в общей форме в уравнении Гирна (1865): (p + π ) (V – νb) = νRT.
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
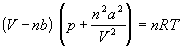
Перепишем это уравнение так, чтобы выразить объем: ![]()
Это уравнение содержит объем в третьей степени и, следовательно, имеет или три действительных корня, или один действительный и два мнимых. При высоких температурах оно имеет один действительный корень, и по мере повышения температуры кривые, вычисленные по уравнению Ван-дер-Ваальса, приближаются к гиперболам, соответствующим уравнению состояния идеального газа.
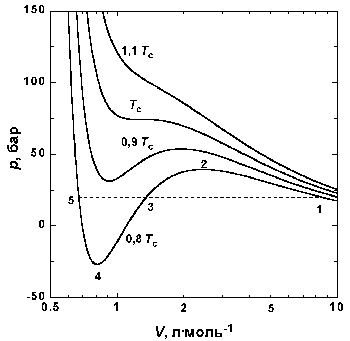
Рис.1.4 Изотермы Ван-дер-Ваальса для СО2
На рис. 1.4 приведены изотермы, вычисленные по уравнению Ван-дер-Ваальса для диоксида углерода. Из рисунка видно, что при температурах ниже критической (31,04 °С) вместо горизонтальных прямых, соответствующих равновесию жидкости и пара, получаются волнообразные кривые 12345 с тремя действительными корнями, из которых только два, 1 и 5, физически осуществимы. Третий корень (точка 3) физически не реален, поскольку находится на участке кривой 234, противоречащем условию стабильности термодинамической системы. Состояния на участках 12 и 54, которые соответствуют переохлажденному пару и перегретой жидкости, соответственно, являются неустойчивыми (метастабильными) и могут быть лишь частично реализуемы в специальных условиях. Так, осторожно сжимая пар выше точки 1 (рис. 1.4), можно подняться по кривой 12. Для этого необходимо отсутствие в паре центров конденсации, и в первую очередь пыли. В этом случае пар оказывается в пересыщенном, т. е. переохлажденном состоянии. И наоборот, образованию капелек жидкости в таком паре способствуют, например, попадающие в него ионы. Это свойство пересыщенного пара используется в известной камере Вильсона (1912), применяемой для регистрации заряженных частиц. Движущаяся заряженная частица, попадая в камеру, содержащую пересыщенный пар, и соударяясь с молекулами, образует на своем пути ионы, создающие туманный след – трек, который фиксируется фотографически.
Основные физические свойства жидкостей и газов
... Поверхностное натяжение-это свойство обуславливающееся силами взаимного притяжения, возникающими между частицами поверхностного слоя жидкости и вызывающими напряженное его состояние. Система, находящаяся ... из уравнений системы на , , , соответственно Гидростатика -- это раздел гидравлики (механики жидкости), изучающий покоящиеся жидкости. Она изучает законы равновесия жидкости и распределения ...
Согласно правилу Максвелла (the Maxwell construction), которое имеет теоретическое обоснование, для того, чтобы расчетная кривая соответствовала экспериментальной равновесной изотерме, нужно вместо кривой 12345 провести горизонтальную прямую 15 так, чтобы площади 1231 и 3453 были равны. Тогда ордината прямой 15 будет равна давлению насыщенного пара, а абсциссы точек 1 и 5 – мольным объемам пара и жидкости при данной температуре.
По мере повышения температуры все три корня сближаются, и при критической температуре Tc все три корня становятся равными. В критической точке изотерма Ван-дер-Ваальса имеет точку перегиба 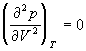 с горизонтальной касательной
с горизонтальной касательной ![]() , то есть
, то есть 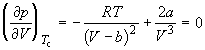 и
и 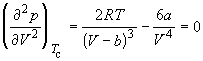 .
.
Совместное решение этих уравнений дает вывод критических параметров. Соответственно, согласно уравнению Ван-дер-Ваальса, критический фактор сжимаемости Z для всех газов должен быть равен:
![]()
Принципиальное значение уравнения Ван-дер-Ваальса определяется следующими обстоятельствами:
1) уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p, V,T), описывающей свойства реальных газов;
2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния (см. ниже);
3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме (см. 1.1, 1.2).
Причиной недостаточной точности уравнения Ван-дер-Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных. После 1873 г. сам Ван-дер-Ваальс предложил еще шесть вариантов своего уравнения, последнее из которых относится к 1911 г. и содержит пять эмпирических постоянных. Две модификации уравнения предложил Клаузиус, и обе они связаны с усложнением вида постоянной b. Больцман получил три уравнения этого типа, изменяя выражения для постоянной a. Всего известно более сотни подобных уравнений, отличающихся числом эмпирических постоянных, степенью точности и областью применимости. Выяснилось, что ни одно из уравнений состояния, содержащих менее 5 индивидуальных постоянных, не оказалось достаточно точным для описания реальных газов в широком диапазоне p, V, T, и все эти уравнения оказались непригодными в области конденсации газов. Из простых уравнений с двумя индивидуальными параметрами неплохие результаты дают уравнения Дитеричи и Бертло.
Уравнение состояния идеального газа
... постоянной тела к числу молекул газа (1.25). Разновидности записи уравнения состояния идеального газа. Уравнение, выражающее связь между параметрами равновесного состояния термодинамической системы или локально равновесных е ... p,, T) = 0 называется уравнением состояния. В связи с данным определением уравнение (1.21) pV/ T = R тела является уравнением состояния идеального газа. С учётом введённых ...
Вириальное уравнение состояния.
вириального уравнения
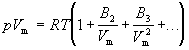
Коэффициенты B2, B3, … (которые зависят от температуры и природы рассматриваемого газа, но не зависят от плотности и давления) называются соответственно вторым, третьим, …вириальными коэффициентами. Первый вириальный коэффициент равен 1. Второй вириальный коэффициент обычно более важен, чем последующие, поскольку для большинства случаев B2 /Vm >> B3 /V2m >>… .
Уравнение состояния в виде бесконечного ряда было предложено Тиссеном в 1885 г. Однако основное развитие вириальное уравнение получило в 1901 г. в работе Камерлинг-Оннеса, который рассмотрел несколько вариантов этого уравнения и предложил называть его коэффициенты вириальными.
Если подходить в вириальному уравнению только как к эмпирическому уравнению состояния, то оно имеет ряд недостатков. Например, как показывают экспериментальные данные, сходимость ряда не очень хорошая, особенно в области высокой плотности. Кроме того, при высоких плотностях для удовлетворительного описания экспериментальных данных необходимо использовать большое число членов ряда, а для этого нужно экспериментально определять большое число вириальных коэффициентов. Более того, часто тот же набор экспериментальных данных можно более точно описать с помощью других эмпирических уравнений с меньшим числом параметров. Однако исключительная важность вириального уравнения состояния заключается в том, что это единственное из известных уравнений состояния, имеющее строгую теоретическую основу. Как будет показано в главе 2, каждый вириальный коэффициент можно выразить через силы межмолекулярного взаимодействия. Так, второй вириальный коэффициент отражает парные взаимодействия, третий – тройные и т. д. Таким образом, вириальное уравнение состояния позволяет объяснить свойства газа с позиции межмолекулярных взаимодействий.
Для некоторых целей вириальное уравнение удобнее записать в виде разложения по степеням p: pVm = RT (1 + B2’p + B3’p2 + …)
Таким образом, вириальное уравнение является примером того, когда простое выражение (в данном случае pVm = RT) представляет собой только первый член ряда разложения по степеням переменной (в данном случае p или Vm).
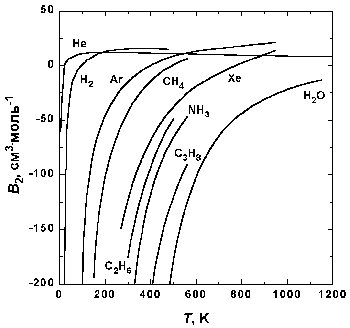
Рис.1.5. Зависимость второго вириального коэффициента некоторых газов от температуры.
На рис. 1.5 представлена зависимость второго вириального коэффициента от температуры для некоторых газов. При низких температурах B2 < 0, с ростом температуры его значение проходит через ноль, затем становится положительным, достигает максимума и далее очень медленно убывает. При высоких температурах B2 и все последующие вириальные коэффициенты стремятся к нулю. Температура, при которой B2 = 0, называется температурой Бойля TB.
Понятие идеального газа
... уравнения для описания состояния реальных газов с учетом их характеристик на молекулярном уровне. Идеальный газ – это научный конструкт, модель. Следует выделять: классический идеальный газ, квантовый идеальный газ. Описание классического идеального газа Частицы газа ...
Закон соответственных состояний.
Поскольку критические константы являются характеристическими свойствами газов, их можно использовать для создания соответствующей относительной шкалы, введя безразмерные приведенные переменные: приведенное давлениеpr(π), приведенный объем Vr(φ) и приведенную температуру Tr(τ):
![]() ;
;![]() ;
;![]() .
.
Соответственными называются состояния разных веществ, имеющие одинаковые значения приведенных переменных. Согласно закону соответственных состояний, если для рассматриваемых веществ значения двух приведенных переменных одинаковы, должны совпадать и значения третьей приведенной переменной. Таким образом, уравнения состояния различных веществ, записанные в приведенных переменных, должны совпадать. Это утверждение эквивалентно постулату о существовании общего универсального приведенного уравнения состояния: F(pr, Vr, Tr) = 0
Поскольку это приведенное уравнение не содержит в явном виде индивидуальных постоянных, оно должно быть применимо к любому веществу. Закон соответственных состояний является общим утверждением, не связанным с конкретным видом уравнения состояния. На практике закон соответственных состояний приближенно выполняется для однотипных веществ, что позволяет, например, использовать для реальных газов обобщенные диаграммы сжимаемости.
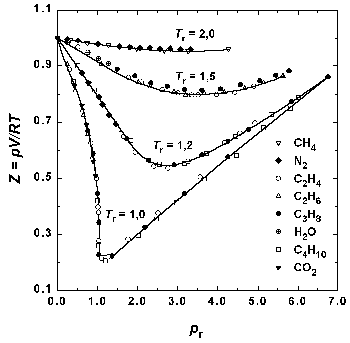
Рис.1.6. Зависимость фактора сжимаемости некоторых газов от приведенного давления при разных приведенных температурах.
Можно показать, что любое уравнение состояния, содержащее три параметра, можно представить в приведенной форме. Для тех из них, которые содержат три параметра, представлена также и приведенная форма. Отсутствие универсального уравнения F(pr, Vr, Tr) = 0 говорит не о неверности закона о соответственных состояниях, а о недостаточности двух индивидуальных постоянных и R в уравнении состояния.
В настоящее время понятно, почему в уравнениях состояния реальных газов двух индивидуальных параметров в общем случае не хватает, но в первом приближении этого достаточно. Причиной всех отклонений от уравнения состояния идеального газа являются межмолекулярные взаимодействия в газах.
Статистический расчет показывает, что наличие индивидуальных постоянных в уравнении межмолекулярного взаимодействия всегда приводит к появлению индивидуальных постоянных и в уравнении состояния газов. Поэтому в области значений p, V и T, для которых в реальных газах вклад межмолекулярных взаимодействий достаточно велик, в уравнениях состояния появляются индивидуальные постоянные, зависящие от параметров уравнении межмолекулярного взаимодействия. Поэтому в приближенных уравнениях состояния часто оказывается достаточно использовать две индивидуальные постоянные. Если же требуется описать поведение газа с более высокой точностью, необходимо использовать уравнения с бу льшим числом постоянных. Так, например, уравнение Битти – Бриджмена содержит пять постоянных кроме R и считается одним из лучших эмпирических уравнений состояния. В течение некоторого времени оно применялось при составлении справочных таблиц реальных газов. В настоящее время для возможно более точного описания свойств газов используют эмпирическое уравнение Бенедикта – Вебба – Рубина:
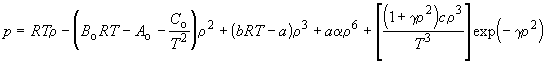
Модельные представления о реальных газах.
Рассмотрим две простые модели, которые позволят учесть эти факторы при расчете статистической суммы газа.
Модель решеточного газа
В модели решеточного газа предполагается, что N различимых частиц движутся в объеме V, разделенном на ячейки объемом b, при этом число ячеек n = V / b предполагается намного большим, чем число частиц, т. е. большинство ячеек — пустые (рис. 2.1).
В каждой ячейке может находиться не более одной частицы (если в одной ячейке находятся две частицы, то потенциальная энергия принимается равной +Ґ ).
Частицы, находящиеся в разных ячейках, не взаимодействуют, т. е. потенциальная энергия равна 0. Фактически, в этой модели объем ячейки — это собственный объем частиц. Найдем уравнение состояния для решеточного газа.
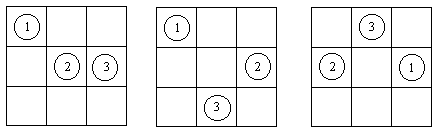
Рис. 2.1. Три из 504 вариантов расположения трех различимых частиц в 9 ячейках.
Из этого уравнения состояния следует то, что ![]() при любых объемах. Это означает, что решеточный газ без взаимодействия ни при каких условиях не проявляет критического поведения и наличие собственного объема, которое можно рассматривать как существование бесконечного отталкивания на малых расстояниях, само по себе не может приводить к конденсации газа.
при любых объемах. Это означает, что решеточный газ без взаимодействия ни при каких условиях не проявляет критического поведения и наличие собственного объема, которое можно рассматривать как существование бесконечного отталкивания на малых расстояниях, само по себе не может приводить к конденсации газа.
Модель решеточного газа с взаимодействием
Для того, чтобы оценить роль межчастичного взаимодействия в поведении реальных газов, рассмотрим модель решеточного газа с притяжением, в котором каждая пара частиц взаимодействует друг с другом с одинаковым потенциалом, равным –2a/V, где a — постоянная, V — объем газа.
![]() ;
; 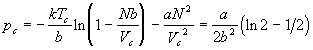 ;
;
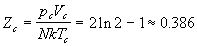
Главный вывод, который следует из рассмотрения двух моделей решеточного газа состоит в том, что критические явления в реальном газе могут появляться только в том случае, когда потенциал взаимодействия содержит как отталкивательную часть (на малых, но конечных расстояниях), так и притягивающую часть.
Заключение.
Данная посвящена рассмотрению реальных газов с точки зрения физики и физической химии. В ней рассмотрены принципы описания свойств реальных при высоких давлениях и низких температурах, когда классическое уравнение состояния Клайперона-Менделеева уже не имеет смысла.
Это происходит при увеличение давления, когда расстояние между молекулами начинает сокращаться и они взаимодействуют между собой, что приводит нас к выводу вириальных коэффициэнтов, которые характеризуют потенциалы парных, тройных и т. д. межмолекулярных взаимодействий.
Учет этих взаимодействий позволяет не только точно рассчитывать рассличные характерные свойства газов, но также и их калорические характеристики, например теплоемкость, при учете которой, также необходимо знать размеры молекул атомов и потенциалы межмолекулярных взаимодействий.
Список литературы
[Электронный ресурс]//URL: https://inzhpro.ru/kursovaya/idealnyiy-i-realnyiy-gaz/
1. Савельев «Курс общей физики». Учебное пособие для ВТузов. Молекулярная физика. Первый том.
2. «Термодинамика.» 1984.
3. «Курс общей физики». Молекулярная физика. Лекции.
4. «Физическая термодинамика». Том второй.
5. . МГТУ им. . 2002г.
6. , , «Реальные газы.» 1998
7. Р. Кубо «Термодинамика.» 1989.
