Аммиак жидкий Аммиачная вода
NH 3
NH 3
82
16,1 – 20,1
2,8
7,1
Аммонийные
Сульфат аммония
(NH 4 )2 SO4
19,9 – 21,0
17,9
1,1
Нитратные
Нитрат натрия
Нитрат кальция
NaNO 3
Ca(NO 3 )2
11,0 – 16,0
18,0 – 11,0
—
—
—
—
Амидные
Карбамид
CO(NH 2 )2
46,0 – 46,1
2,1
27,1
Карбамидоформ-альдегидные
Карбаминоформ
NH 2 CONHCH2
33,0 – 42,0
—
—
Аммиакаты
Азотная часть комплексных минеральных удобрений
—
—
20,0 – 30,0
—
—
—
—
19,3
В приведенных данных прослеживается тенденция снижения производства сульфата и нитрата аммония и увеличения производства карбамида, жидких азотных удобрений и минеральных удобрений, содержащих, наряду с другими элементами, азот (комплексных минеральных удобрений).
Ниже рассматривается технология производства наиболее распространенных азотных удобрений – нитрата аммония и карбамида, на долю которых приходится свыше 60% общего выпуска азотных удобрений.
1.2 Производство нитрата аммония
1.2.1 Свойства нитрата аммония
Нитрат аммония (аммонийная селитра) NH 4 NO3 – кристаллическое вещество с температурой плавления 169,6ºС, хорошо растворимое в воде. Растворимость при 20ºС равна 0,621 мас. долей, при 160ºС – 0,992 мас. долей. Нитрат аммония сильно гигроскопичен и легко поглощает влагу из атмосферы, в зависимости от температуры может существовать в пяти кристаллических модификациях, различающихся плотностью и структурой кристаллов. Вследствие высокой растворимости в воде, гигроскопичности и полиморфных превращений, сопровождающихся выделением тепла, нитрат аммония легко слеживается. Для уменьшения слеживаемости, которая затрудняет использование продукта, в промышленности используют следующие меры:
- перед складированием полученный продукт охлаждают до температуры ниже 32ºС, так как именно в интервале от 32,3ºС до -17ºС нитрат аммония находится в стабильной ромбической модификации;
гранулированном
кондиционирующие
Нитрат аммония в твердом состоянии или в виде высококонцентрированного раствора (плава) при нагревании выше 180 — 200 ºС разлагается:
NH 4 NO3 = N2 O + 2H2 O – DH, гдеDH = 36,8 кДж.
При быстром нагревании в замкнутом пространстве до 400 — 100ºС или инициировании нитрат аммония разлагается со взрывом по уравнению
NH 4 NO3 = N2 + 2H2 O + 0,1O2 – 118 кДж.
Разложение ускоряется в присутствии минеральных кислот и органических веществ. На этом основано использование нитрата аммония в качестве компонента аммонийно-селитровых взрывчатых веществ – аммонитов (смеси с органическими веществами), аммотолов (смеси со взрывчатыми веществами) и аммоналов (смеси, содержащие аллюминий).
Нитрат аммония является безбалластным азотным удобрением и содержит 34,8% азота, из них 17,4% — в аммиачной (NH 4 + ) и 17,4% — в нитратной (NO3 — ) форме. Поэтому стоимость транспортировки содержащегося в нем азота значительно ниже, чем при перевозке других балластных удобрений (например, сульфата аммония).
1.2.2 Физико-химические основы процесса синтеза
Производство нитрата аммония основано на реакции нейтрализации азотной кислоты газообразным аммиаком с последующим упариванием полученного раствора нитрата аммония.
Нейтрализация.
HNO 3 + NH3 = NH4 NO3 – DH.
Реакция идет в диффузионной области, и ее скорость лимитируется диффузией аммиака из газа к поверхности жидкости. Количество тепла, выделяющегося при нейтрализации, складывается из теплового эффекта реакции и теплоты растворения образовавшегося нитрата аммония в воде:
Q å = Q1 – (Q2 + Q3 ),
| где | Q 1 | – | тепловой эффект реакции нейтрализации 100% азотной кислоты с образованием твердого нитрата аммония; |
| Q 2 | – | теплота разбавления азотной кислоты; | |
| Q 3 | – | теплота растворения нитрата аммония. |
Таким образом, тепловой эффект процесса зависит от концентрации азотной кислоты, взятой для нейтрализации.
Подогрев компонентов (азотной кислоты и газообразного аммиака) улучшает перемешивание системы, ускоряет процесс нейтрализации и повышает концентрацию раствора нитрата аммония.
Упаривание раствора нитрата аммония.
С ростом концентрации азотной кислоты возрастает концентрация образующегося раствора нитрата аммония и увеличивается масса выделяющегося сокового пара.
Для испарения воды и концентрирования раствора нитрата аммония можно использовать как внешнее тепло, подводимое к системе, так и теплоту нейтрализации, выделяющуюся в самом процессе (рис. 1.1.).
Qподв
![]()
H2 O(пар) NH4 NO3 + H2 O NH4 NO3
![]() DH реакц
DH реакц
Рисунок 1.1 — Использование тепла при упаривании раствора
Использование теплоты нейтрализации для упаривания раствора позволяет:
- снизить затрату внешнего тепла;
- обеспечить за счет отвода тепла из системы оптимальный температурный режим процесса нейтрализации и избежать опасных перегревов;
- исключить применение сложных охладительных устройств.
При использовании азотной кислоты концентрацией 60 – 61 % и температуре процесса около 70ºС оказывается возможным за счет использования теплоты нейтрализации выпарить основную массу воды, вводимой с азотной кислотой, и получить высококонцентрированный раствор и даже плав нитрата аммония.
В соответствии с принципом использования тепла все существующие варианты технологического процесса производства нитрата аммония делятся на две группы:
1 Без упаривания раствора
Q = DH; Q подв = 0.
2 С упариванием раствора
Q = DH + Q подв .
При этом в зависимости от концентрации азотной кислоты последующее упаривание раствора нитрата аммония может производиться:
- при 18% кислоте в 1-й ступени;
- при 10% кислоте в 2-й ступени.
1.2.3 Технологические системы производства
Технологический процесс производства нитрата аммония состоит из следующих основных стадий: нейтрализации азотной кислоты газообразным аммиаком, выпаривание нитрата аммония, кристаллизации и гранулирования плава, охлаждения, классификации и опудривания готового продукта (рис.1.2.).
В настоящее время в связи с освоением производства 18 – 60% азотной кислоты основная масса нитрата аммония производится на установках АС-67, АС-72, АС-72М, мощностью 1360 и 1171 т/сутки с упариванием в одну ступень, а также на установках безупарочного типа (рис.1.3. и 1.4.)
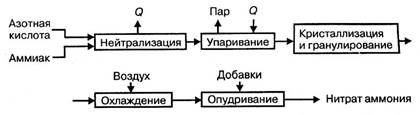
Рисунок 1.2 — Принципиальная схема производства нитрата аммония
Газообразный аммиак из подогревателя 1, обогреваемого конденсатом сокового пара, нагретый до 120 — 160ºС, и азотная кислота из подогревателя 2, обогреваемого соковым паром, при температуре 80 — 90ºС поступают в аппарат ИТН (с использованием теплоты нейтрализации) 3. Для уменьшения потерь аммиака вместе с паром реакцию ведут в избытке кислоты. Раствор нитрата аммония из аппарата ИТН нейтрализуют в донейтрализаторе 4 аммиаком, куда одновременно добавляется кондиционирующая добавка нитрата магния и поступает на упаривание в выпарной аппарат 1. Из него образовавшийся плав нитрата аммония через гидрозатвор-донейтрализатор 6 и сборник плава 7 направляется в напорный бак 8 и из него с помощью виброакустических грануляторов 9 поступает в грануляционную башню 10. В нижнюю часть башни засасывается атмосферный воздух, и подается воздух из аппарата для охлаждения гранул «КС» 12. Образовавшиеся гранулы нитрата аммония из нижней части башни поступают на транспортер 11 и в аппарат кипящего слоя 12 для охлаждения гранул, в который через подогреватель 13 подается сухой воздух. Из аппарата 12 готовый продукт направляется на упаковку. Воздух из верхней части башни 10 поступает в скрубберы 14, орошаемые 20% раствором нитрата аммония, где отмывается от пыли нитрата аммония и выбрасывается в атмосферу. В этих же скрубберах очищаются от непрореагировавшего аммиака и азотной кислоты газы, выходящие из выпарного аппарата и нейтрализатора. Аппарат ИТН, грануляционная башня и комбинированный выпарной аппарат – основные аппараты в технологической схеме АС-72М.
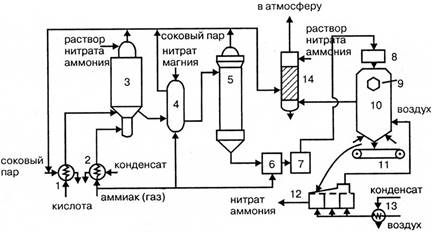
Рисунок 1.3 — Технологическая схема производства АС-72М:
1 – подогреватель аммиака; 2 – подогреватель кислоты; 3 – аппарат ИТН; 4 – донейтрализатор; 1 – выпарной аппарат; 6 – гидрозатвор-донейтрализатор; 7 – сборник плава; 8 – напорный бак; 9 – виброакустический гранулятор; 10 – грануляционная башня; 11 – транспортер; 12 – охладитель гранул «КС»; 13 – подогреватель воздуха; 14 – промывной скруббер
Аппарат ИТН, Комбинированный выпарной аппарат
Грануляционная башня имеет прямоугольное сечение 11х8 м 2 и высоту около 61 м. Через отверстие в нижней части в башню поступает наружный воздух и воздух из охладителя гранул. Поступающий в верхнюю часть башни плав нитрата аммония диспергируется с помощью трех виброакустических грануляторов, в которых струя плава превращается в капли. При падении капель с высоты около 10 м они затвердевают и превращаются в гранулы. Кристаллизация плава с влажностью 0,2% начинается при 167ºС и заканчивается при 140 ºС. Объем воздуха, подаваемого в башне, составляет в зависимости от времени года 300 – 100 м3 /час.
В установках АС – 72М применяется магнезиальная добавка против слеживаемости продукта (нитрат магния).
Поэтому операции обработки гранул ПАВ, предусмотренной в схемах АС – 67 и АС – 72, не требуется.
Принципиальными отличиями технологической схемы производства нитрата аммония безупарочным методом (рис. 1.4.) являются: использование более концентрированной азотной кислоты; проведение процесса нейтрализации при повышенном (0,4МПа) давлении; быстрый контакт нагретых компонентов.
В этих условиях на стадии нейтрализации образуется парожидкостная эмульсия, после разделения которой получают плав концентрацией 98,1%, что позволяет исключить отдельную стадию упаривания раствора.
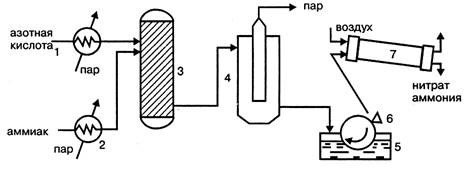
Рисунок 1.4 — Технологическая схема безупарочного метода:
1 – подогреватель азотной кислоты; 2 – подогреватель аммиака; 3 – реактор (нейтрализатор); 4 – сепаратор эмульсии; 1 – барабанный кристаллизатор; 6 – нож; 7 – барабанная сушка.
Нагретые в нагревателях 1 и 2, обогреваемые паром, выходящим из сепаратора, эмульсии 4, азотная кислота и аммиак поступают в нейтрализатор 3, где в результате реакции образуется эмульсия из водного раствора нитрата аммония и водяного пара. Эмульсия разделяется в сепараторе 4 и плав нитрата аммония подается в барабанный кристаллизатор 1, в котором нитрат аммония кристаллизируется на поверхности металлического барабана, охлаждаемого изнутри водой.
Образовавшийся на поверхности барабана слой твердого нитрата аммония толщиной около 1 мм срезается ножом 6 и в виде чешуек поступает для просушивания в барабанную сушилку 7. Подобный продукт в виде чешуек используется для технических целей.
1.3 Производство карбамида
1.3.1 Свойства карбамида
Карбамид (мочевина) – диамид угольной, или амид карбаминовой кислот CO(NH 2 )2 . Генетическая связь производных угольной кислоты может быть выражена следующей схемой:
ОН ОН ОNН 4 NН2
| | | |
C=О C=О C=О C=О
| | | |
ОН NН 2 NН2 NН2
угольная карбаминовая карбамат карбамид
кислота кислота аммония
Карбамид представляет собой твердое кристаллическое вещество с температурой плавления 132,7ºС. Хорошо растворим в воде, этаноле и жидком аммиаке, что используется для получения аммиакатов. При нагревании выше 130 ºС подвергается термической диссоциации с образованием биурета и выделением аммиака:
2CO(NH 2 )2 = H2 N – CO – NH – СО – H2 N + NH3 .
Водные растворы карбамида устойчивы до 80 ºС, при более высокой температуре разлагаются через образование карбоната аммония на аммиак и оксид углерода (IV):
CO(NH 2 )2 + 2H2 O Û (NH4 )2 CO3 Û (NH4 )2 HCO3 + Û
Û CO 2 + H2 O + 2NH3 .
Это исключает возможность длительного нагревания растворов карбамида при атмосферном давлении, например, в процессе выпаривания.
Карбамид – безбалластное высококонцентрированное МУ. Он легко усваивается растениями. Содержание азота в нем в амидной форме составляет 46,6%. По сравнению с нитратом аммония карбамид более богат азотом, меньше слеживается, не взрывоопасен в смесях с органическими веществами и медленнее вымывается из почвы.
1.3.2 Физико-химические основы процесса синтеза
В основе получения карбамида лежит взаимодействие аммиака с оксидом углерода (IV) с последующей дистилляцией продуктов синтеза и переработкой полученных растворов. При синтезе карбамида последовательно протекают две обратимых реакции:
образование карбамата аммония:
2NH 3 + CO2 ÛCO(NH2 )(ONH4 ) – 121,6 кДж (1)
и дегидратации карбамата аммония до карбамида:
CO(NH 2 )(ONH4 )ÛCO(NH2 )2 + H2 O–11,1 кДж (2)
Процесс синтеза описывается суммарным уравнением:
2NH 3 + CO2 = CO(NH2 )2 + H2 O – 110,1кДж.
Он протекает в гетерогенной системе, состоящей из газообразной фазы (аммиак, диоксид углерода, пары воды) и жидкой фазы, включающей расплавленные и растворенные компоненты (аммиак, карбамат аммония, карбонаты аммония, карбамид) и воду.
Скорости реакций 1 и 2 различны. Реакция 1 протекает значительно быстрее реакции 2, поэтому лимитирующей процесс синтеза стадией, от которой и зависит выход продукта, является стадия дегидратации карбамата аммония 2. Состояние равновесия и скорость ее определяются температурой, давлением, соотношением аммиака и диоксида углерода и содержанием воды в реакционной смеси.
Скорость реакции 2 возрастает с увеличением температуры и давления. Так как она протекает с поглощением тепла, то повышение температуры одновременно способствует смещению равновесия вправо и увеличивает степень конверсии карбамата аммония.
Повышение температуры быстро смещает равновесие реакции 1 влево, что приводит к уменьшению концентрации карбамата и, следовательно, к падению скорости реакции 2 конверсии карбамата в карбамид.
Максимальная степень превращения карбамата аммония в карбамид достигается при температуре около 220ºС. При этой температуре продолжительность процесса составляет около 60 минут. При понижении температуры для достижения более высокой степени превращения карбамата в карбамид время процесса существенно увеличивается.
Скорость образования карбамата аммония возрастает пропорционально квадрату давления и при давлении 1 МПа протекает практически мгновенно.
Наибольшее влияние на выход карбамида оказывает избыток аммиака в исходной смеси сверх стехиометрического количества (NH 3 : CO2 – 2 : 1).
Избыток аммиака смещает равновесие реакции 1, а также вследствие своего дегидратирующего действия связывает реакционную воду, удаляя ее из сферы реакции, и смещает вправо равновесие реакции 2. Образование карбамата и его дегидратация до карбамида протекают в жидкой фазе, поэтому в реакторе должны быть созданы условия ее существования. Этому способствует увеличение степени заполнения реактора, что приводит к уменьшению объема газовой фазы, и нагрев реакционной смеси до температуры выше эвтектической точки системы «карбамат-карбамид», равной 98ºС.
Влияние различных факторов на состояние равновесия системы «карбамат-карбамид» можно представить в виде следующей схемы:
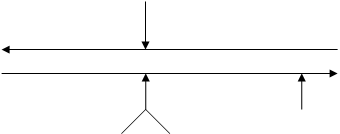 Т (за счет экзотермичности реакции 1)
Т (за счет экзотермичности реакции 1)
сдвиг влево
сдвиг вправо
Р
(за счет ускоре- (за счет подав- NH 3 /CO2
ния наступления ления диссоци- (за счет связывания
равновесия ации карбамата воды в реакции 2)
в реакции 2) в реакции 1)
Оптимальный режим процесса синтеза карбамида должен обеспечить: быстрое и полное протекание реакции 1, протекание реакции 2 не менее, чем на 71%.
Этим условиям отвечают следующие параметры процесса: температура 180 — 200ºС, давление 20 МПа, избыток аммиака 100% сверх стехиометрического количества, то есть мольное отношение NH 3 : CO2 – 4 : 1
1.3.3 Технологическая схема производства
В результате взаимодействия аммиака и оксида углерода (IV) образуется сложная система, состоящая из целевого продукта карбамида, полупродукта карбамата аммония, воды, карбонатов аммония и избытка аммиака. Для выделения из нее твердого карбамида и утилизации не вступивших в реакцию остальных компонентов и карбамата полученный раствор подвергают дистилляции. В процессе дистилляции отгоняется избыток аммиака и воды и происходит разложение карбонатов аммония (аммонийных солей).
В зависимости от того, возвращаются эти продукты в процесс или после отделения карбамида используются в других производствах (например, для получения нитрата аммония), технологические схемы производства карбамида делятся на две группы:
- без возвращения продуктов дистилляции в цикл (разомкнутая схема, без рецикла);
- с возвращением продуктов дистилляции в цикл (замкнутая схема, с рециклом).
В первом случае весь выделившийся при дистилляции аммиак поглощают азотной кислотой для получения нитрата аммония, при этом производство карбамида комбинируется с производством нитрата аммония.
частичный рецикл
На рисунке 1.3. представлена принципиальная схема производства карбамида с полным жидкостным рециклом.
Аммиак Вода
| |
![]()
![]()
![]()
![]() Синтез Дистилляия Упаривание Карбамид
Синтез Дистилляия Упаривание Карбамид
| |
Диоксид Раствор
углерода аммонийных
солей
Рисунок 1.3 — Принципиальная схема с полным рециклом
Наиболее экономична технологическая схема с полным жидкостным рециклом, так как в ней не требуется сжатия возвращаемых в цикл горячих газов (аммиака и диоксида углерода), что может вызвать засорение трубопроводов образующимся твердым карбамидом и их коррозию.
На рис. 1.4 приведена технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава мощностью 90 тыс. тонн в год.
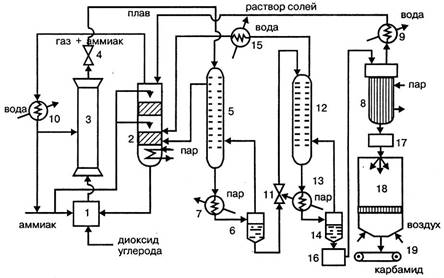
Рисунок 1.4 — Технологическая схема производства карбамида:
1 – смеситель аммиака, диоксида углерода и раствора аммонийных солей, 2 – промывная колонна; 3 – колонна синтеза; 4, 11 – редукторы; 1 – ректификационная колонна I ступени; 6 – сепаратор; 7, 13 – подогреватели; 8 – выпарные аппараты I и II ступеней; 9, 10, 11 – холодильники-конденсаторы; 12 – ректификационная колонна II ступени; 14 – сепаратор II ступени; сборник раствора карбамида; 17 – сборник плава; 18 – грануляционная башня; 19 – транспортер
Оксид углерода (IV), очищенный от примесей и сернистых соединений, сжатый до 20 МПа, и жидкий аммиак под давлением 11 МПа поступают в смеситель 1 при температуре 80 – 100ºС. Сюда же подается раствор аммонийных солей из промывной колонны 2. В смесителе обеспечивается мольное отношение NH 3 :CO2 :H2 O=4,1:1:0,1. Из смесителя смесь, разогревшаяся за сет частичного образования карбамата до 171ºС, направляется в нижнюю часть колонны синтеза 3, где заканчивается образование карбамата аммония, и он превращается на 61% в карбамид. Для обеспечения оптимального теплового режима в колонну дополнительно вводят жидкий аммиак. Из верхней части колонны плав после дросселирования в редукторе 4 подается на двухступенчатую дистилляцию. Агрегат дистилляции каждой ступени состоит из трех аппаратов: ректификационной колонны, подогревателя и сепаратора. Сначала плав поступает в ректификационную колонну 1 первой ступени 1, где давление снижается до 2 МПа. В колонну 1 из сепаратора первой ступени 6 подается противотоком газ. В колонне первой ступени проходит выделение карбамида из реакционной смеси, разложение карбамата аммония и образование из аммиака диоксида углерода и воды водного раствора аммонийных солей. Плав из колонны 1, пройдя подогреватель 7, поступает при температуре 160 ºС в сепаратор первой ступени 6, в котором разделяются жидкая и газообразная фазы. Газы возвращаются в колонну 1 и оттуда в нижнюю часть промывной колонны 2. Верхняя часть промывной колонны орошается жидким аммиаком и аммиачной водой, поступающей в виде конденсата из выпарного аппарата 8 через холодильник-конденсатор 9. В промывной колонне из газа вымывается диоксид углерода и образуется водный раствор аммонийных солей, а газообразный аммиак отводят из верхней части колонны и после сжижения в холодильнике-конденсаторе 10 возвращают в процесс. Водный раствор аммонийных солей перекачивается в смеситель 1 и оттуда в колонну синтеза 3. Раствор карбамида из сепаратора первой ступени 6 дросселируется до давления 0,3 МПа в редукторе II и подается в ректификационную колонну второй ступени 12, откуда поступает в подогреватель 13 и сепаратор 14. В колонне второй ступени происходят дальнейшее разложение карбамата до аммиака и диоксида углерода и образование водного раствора карбоната и бикарбоната аммония. Из нижней части сепаратора 14 выходит 70% раствор карбамида, а из верхней – парогазовая смесь, содержащая аммиак, диоксид углерода и пары воды, которая поступает в нижнюю часть ректификационной колонны 12. Газовая смесь из колонны 12 охлаждается в холодильнике-конденсаторе 11 и в виде раствора аммонийных солей подается в нижнюю часть промывной колонны 2. Раствор карбамида из сепаратора второй ступени 14 собирается в сборнике 16 и подается на упаривание последовательно в вакуум-аппараты первой и второй ступеней при температуре 140ºС и давлении 0,003 МПа. Полученный плав карбамида концентрацией около 0,998 мас. дол. поступает через сборник плава 17 в грануляционную башню 18 и распыляется в ней. Образовавшиеся гранулы при температуре около 70ºС транспортером 19 подают на операции классификации, охлаждения и упаковки. Выход карбамида в расчете на диоксид углерода составляет около 91%.
стриппинг-процесс,
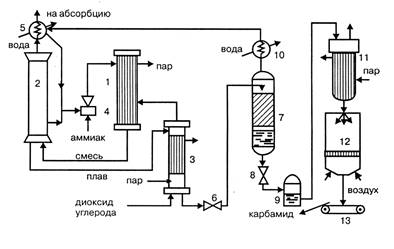
Рисунок 1.1 — Технологическая схема стриппинг-процесса
1 – конденсатор высокого давления; 2 – колонна синтеза; 3 – отдувочная колонна; 4 – инжектор; 1 – скруббер; 6 – редуктор; 7 – ректификационная колонна; 8 – редуктор; 9 – сборник раствора; 10 – холодильник- конденсатор; 11 – выпарной аппарат; 12 – гранулятор; 13 – транспортер
Из конденсатора высокого давления 1 в нижнюю часть колонны синтеза 2 поступают водный раствор карбамата аммония, аммонийных солей, аммиак и диоксид углерода. Образовавшийся плав направляется в отдувочную колонну 3, обогреваемую паром, в которую противотоком поступает под давлением 11 МПа диоксид углерода. Из колонны 3 парогазовая смесь, содержащая свежий диоксид углерода, поступает в конденсатор высокого давления 1, куда через инжектор 4 вводится жидкий аммиак. Он одновременно служит рабочим телом в инжекторе, подающем в конденсатор раствор аммонийных солей из скруббера 1 и часть плава из колонны синтеза. В конденсаторе образуется карбамат, а тепловой эффект реакции используют для выработки пара. Непрореагировавшие в колонне синтеза газы и пары воды поступают в скруббер высокого давления 1, в котором конденсируются и через инжектор 4 направляются в конденсатор высокого давления 1. Водный раствор карбамида, выходящий из отдувочной колонны 3, содержит до 1% карбамата аммония. Для его разложения раствор дросселируют в редукторе 6 до давления 0,3 – 0,6 МПа и направляют в верхнюю часть ректификационной колонны 7. В ней жидкая фаза в виде 70% раствора карбамида стекает вниз и после снижения давления до 0,1 МПа в редукторе 8 собирается в сборнике раствора 9. Водяные пары, выходящие из ректификационной колонны 7, конденсируются в холодильнике-конденсаторе 10, растворяя содержащиеся в них аммиак и диоксид углерода, и полученный раствор аммонийных солей направляется в скруббер 2. Раствор карбамида из сборника 9 поступает в выпарной аппарат 11 и после упаривания в грануляционную башню 12, откуда в виде гранул направляется транспортером 13 на склад.
Стриппинг-процесс производства карбамида позволяет использовать тепловой эффект реакции образования карбамида, упростить технологическую схему, сократить количество оборотной воды и, в целом, является поэтому более экономичным, чем обычный.
Дальнейшее совершенствование производства карбамида заключается в создании интегральных схем, объединяющих производство карбамида, аммиака и нитрата аммония, повышении единичной мощности установок, внедрении технологических схем со стриппинг-процессом.
В заключении в табл.1.2 приведены расходные коэффициенты в производстве нитрата аммония и карбамида.
Таблица 1.2 –
Расходные коэффициенты в производстве азотных удобрений
| Сырье и энергия (на тонну готового продукта) | Производство нитрата аммония в установке АС-72М | Производство карбамида | |
| Полный жидкостный цикл | |||
| Аммиак, т | 0,214 | 0,18 | 0,176 |
| Диоксид углерода, т | — | 0,77 | 0,71 |
| Азотная кислота, т | 0,786 | — | — |
| Вода, м 3 | 0,1 | 100 | 87 |
| Электроэнергия, кВт·ч | 21,1 | 110 | 120 |
| Пар, т | 0,214 | 1,1 | 1,01 |
