Определение поверхностного натяжения растворов. Построение изотермы поверхностного натяжения s= f(с) . Расчет величин адсорбции Г при различных концентрациях вещества. Построение изотермы адсорбции Г= f(с) . Графическое определение постоянных уравнения Ленгмюра (k и Г ¥ ) и расчет толщины адсорбционного слоя d и поверхности, занимаемой одной молекулой q .
Теоретическая часть:
Поверхностная энергия.
Поверхность раздела фаз всегда является источником силового поля вследствие нескомпенсированности молекулярных сил в межфазном поверхностном слое. Для перемещения отдельной молекулы жидкости из объема на поверхность необходимо совершить работу для преодоления этих сил, направленных внутрь фазы с большим межмолекулярным притяжением. Поэтому вопрос образования новой поверхности всегда связан с затратой работы. Эта работа определяет избыток свободной энергии F s на поверхность раздела фаз по сравнению с энергией в объеме. Этот избыток, отнесенный к единице поверхности, называется удельной свободной энергией и обозначается s (Дж/м2 ).
Коллоидные системы, являясь микрогетерогенными системами, имеют большую поверхность раздела фаз S и обладают значительной поверхностной свободной энергией Гельмгольца
А s =s×S (1)
Большая величина А s коллоидных систем определяет ее термодинамическую неустойчивость. Поэтому в коллоидных системах могут протекать процессы, сопровождающиеся уменьшением Аs . Из уравнения (1) следует, что уменьшение Аs может происходить как за счет уменьшения s, так и величины поверхности S. Снижение s происходит за счет адсорбции, концентрации вещества в поверхностном слое, определяемой избыточной по сравнению с объемной фазой количества вещества, приходящейся на единицу поверхности, Г :
![]() (2)
(2)
с 0
Взаимосвязь Г и s определяется уравнением Гиббса:
Газообразное состояние вещества
... газ. Удары молекул о стенки сосуда создают давление, которое численно равно силе ударов, приходящихся на единицу поверхности стенок. Газообразное состояние вещества является наиболее простым по своим свойствам, ... Поэтому действие молекулярных сил выражается только в обмене энергиями при столкновениях. Чем меньше плотность газа, тем больше свободный пробег его молекул и, следовательно, тем меньше ...
![]() (3)
(3)
где c — равновесная концентрация растворенного вещества, моль/л; R — универсальная газовая постоянная (8,31 Дж/моль× К); Т — абсолютная температура.
Другой путь снижения избыточной поверхностной энергии А s — снижение площади поверхности S . Величина S может уменьшаться вследствие явлений слипания коллоидных частиц (коагуляция, структурирование и рекристаллизация).
Этот путь ведет к гибели дисперсной системы.
Из уравнения (3) следует, что определение величины адсорбции сводится к экспериментальному изучению зависимости удельной поверхностной энергии s от концентрации вещества в объемной фазе: ![]() . Величину
. Величину ![]() называют поверхностной активностью. Она характеризует способность вещества изменять удельную поверхностную энергию. Вещества, понижающие s, называются поверхностно-активными веществами (ПАВ); для них g >0, следовательно Г >0 (положительная адсорбция).
называют поверхностной активностью. Она характеризует способность вещества изменять удельную поверхностную энергию. Вещества, понижающие s, называются поверхностно-активными веществами (ПАВ); для них g >0, следовательно Г >0 (положительная адсорбция).
К ПАВ относятся спирты, органические кислоты, сложные эфиры, мыла и т.д. Вещества, понижающие поверхностную энергию, называются поверхностно-инактивными (ПИНАВ); для них g <0 и Г <0 (отрицательная адсорбция).
К ПИНАВ относятся растворы сильных электролитов.
Положительная адсорбция играет огромную роль в природных и промышленных процессах. Она является одной из стадий гетерогенно-каталитических процессов в химической промышленности, с помощью которых в настоящее время получают более 70% химических веществ. Учитывая огромное значение положительное адсорбции часто под адсорбцией понимают именно положительную адсорбцию. Зависимость удельной поверхностной энергии или поверхностного натяжения чистых жидкостей от температуры описывается основным уравнением термодинамики поверхностных явлений — уравнение Гиббса:
![]() (4)
(4)
где S s — избыток энтропии в поверхностном слое; Г i и m i — адсорбция и химический потенциал i -го компонента.
Если n =1 (система жидкость-пар), то
![]() (5)
(5)
Многочисленные исследования показали, что S s постоянна вплоть до критической температуры. Поэтому зависимость s от Т линейна (уравнение Этвеша):
Т с
где Т ¢ с — температура, близкая к критической.
Вспомогательные вещества в технологии лекарственных форм
... распределение суспендированных лекарственных веществ в тритурационных мазях, в расплавленных суппозиторных основ; уменьшается хрупкость таких основ. В то же время эти вспомогательные вещества могут оказывать выраженное влияние на такие важные характеристики лекарственных форм, как ...
В критической точке поверхностное натяжение, как было показано Менделеевым в 1860 г., обращается в ноль. Вместе с ним обращается в ноль и избыток энтропии в поверхностном слое. Зависимость поверхностного натяжения чистой воды от температуры, если температура далека от критической, выражается уравнением:
![]() (7)
(7)
где ![]() — поверхностное натяжение воды при температуре Т; (Дж/м2 ).
— поверхностное натяжение воды при температуре Т; (Дж/м2 ).
Капиллярное давление . Существование избытка свободной энергии у искривленной поверхности приводит к так называемым капиллярным явлениям. Давления в двух объемных фазах, разделенных искривленной поверхностью, оказываются различными. Разность этих давлений, обозначаемая DР , называется капиллярным давлением. В состоянии равновесия капиллярное давление связано с поверхностным натяжением на границе раздела фаз s и ее геометрическими характеристиками (главными радиусами кривизны эллипсаR1 и R2 ) уравнением, выведенном в 1805 г. Лапласом:
D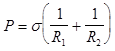 (8)
(8)
R 1 =
D![]() (9)
(9)
Уравнение Лапласа может быть использовано для определения поверхностного натяжения жидкости на границе с газом или другой не смешивающейся с ней жидкостью. Метод определения s основан на измерении максимального давления, необходимого для продавливания пузырька газа через капилляр, опущенный в исследуемую жидкость (рис.1).
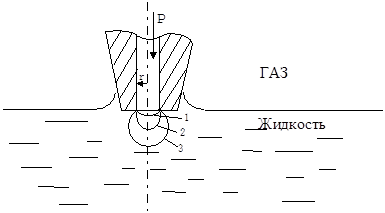
Из рис.1 видно, что сначала происходит уменьшение радиуса пузырька (положение 1-2) до R= r , затем увеличение (положение 2-3).
То есть по мере роста давления изменение радиуса пузырька проходит через минимум. Согласно уравнению Лапласа изменение DР должно происходить через максимум при R= r . При достижении максимального давления Р max пузырек газа становится неустойчивым и быстро отрывается от капилляра. Связь поверхностного натяжения жидкости s с газом с Р max и плотностью жидкости r дается уравнением Кантора:
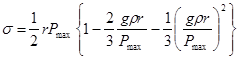 (10)
(10)
Уравнение (10) применимо, когда r <1мм. Для очень тонких капилляров, когда r»0,1мм, уравнение (10) упрощается:
![]() (11)
(11)
Для двух жидкостей с поверхностным натяжением s
- и s» уравнение (11) приобретает вид:
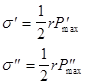 (12)
(12)
Основные физические свойства жидкостей и газов
... неньютоновским жидкостям можно отнести многие пищевые жидкости: кефир, сметана, сгущенное молоко, томатные пасты и т. п. Поверхностное натяжение. Смачивание Поверхностное натяжение-это свойство обуславливающееся силами взаимного притяжения, возникающими между частицами поверхностного слоя жидкости и вызывающими ...
где ![]() — максимальное давление, необходимое для образования пузырька соответственно в жидкости 1 и жидкости 2. Из уравнений (12) следует:
— максимальное давление, необходимое для образования пузырька соответственно в жидкости 1 и жидкости 2. Из уравнений (12) следует:
![]() (13)
(13)
Уравнение (13) позволяет вычислить неизвестное поверхностное натяжение жидкости (s»), зная максимальное давление Р» max для этой жидкости и Р¢max для стандартной жидкости с известным поверхностным натяжением s
- (например воды).
Изотерма адсорбции на границе раздела жидкой и газообразной фаз. Уравнение (3) Гиббса является одним из наиболее фундаментальных уравнений коллоидной химии, справедливого для любой границы раздела фаз. Широкое применение этого уравнения для исследования адсорбции на поверхности жидкости с газом (или паром) обусловлено относительно легким определением s жидкостей. Для твердых тел прямые методы измерения s отсутствуют.
Определив экспериментально зависимость s от с — изотерму поверхностного натяжения, и пользуясь уравнением Гиббса, можно найти значения адсорбции при различных концентрациях, т.е. изотерму адсорбции.
Определение величины Г графическим методом по уравнению Гиббса . На изотерме поверхностного натяжения (рис.2а) выбирают ряд точек, к которым проводят касательные и линии, параллельные оси абсцисс. Так как тангенс угла j есть производная ![]() , и из построения видно, что tg j = — tg a =
, и из построения видно, что tg j = — tg a =![]() , то с учетом уравнения Гиббса (3) получим:
, то с учетом уравнения Гиббса (3) получим:
![]() (14)
(14)
- >
- <—
