Жидкие лекарственные формы наиболее широко применяются в медицинской практике. К ним относятся более 60% всех лекарств, изготовляемых в аптеках. По сравнению с другими лекарственными формами жидкие лекарственные формы имеют ряд преимуществ:
1) при приеме внутрь они всасываются и действуют быстрее, чем твердые лекарственные формы (порошки и др.), которые должны предварительно распасться или раствориться в организме; 2) некоторые лекарственные вещества, вводимые в организм в виде жидких лекарств, при соприкосновении со слизистыми оболочками не проявляют раздражающего или прижигающего действия, наблюдающегося при их приеме в сухом виде (например, бромиды и йодиды натрия, калия, хлоралгидрат и т. п.); 3) мягчительное и обволакивающее действие ряда лекарственных веществ проявляется наиболее полно при их применении в виде жидких лекарств.
Вместе с этим жидкие лекарства по сравнению с сухими имеют и некоторые недостатки. Многие жидкие лекарственные формы изменяются при хранении (недостаточно стойки), обладают значительным объемом, а поэтому менее удобны для транспортировки, требуют большего времени для их изготовления и специальной тары (склянки, пробки и т. п.) для их отпуска. Точность их дозирования при применении меньшая по сравнению с сухими лекарственными формами.
Уже в древности предпринимались попытки вводить лекарственные вещества непосредственно в кровь; однако все они оканчивались весьма печально, так как при этом больные заражались какой-либо новой болезнью. Только во второй половине прошлого столетия, после того как было доказано, что источником большинства заболеваний являются микроорганизмы, и были найдены способы борьбы с ними (стерилизация), появилась возможность вводить растворы лекарственных веществ непосредственно в кровь путем впрыскивания через кожу.
Вначале приготовлением подкожных (внутримышечных, внутривенных и других видов) 1 впрыскиваний, отпускаемых в склянках, занимались сами врачи, потом этим делом занялись в аптеках фармацевты.
В 1885 г. петербургский аптекарь А. В. Пель вместо склянок предложил употреблять стеклянные сосудики, получившие название ампул (Ampulla — сосудик).
После этого растворы, отпускаемые в ампулах для подкожного введения, постепенно нашли широчайшее применение. Так, еще в начале нынешнего столетия самые крупные аптеки изготовляли в день лишь по 20—30 ампул по отдельным рецептам. А уже в 1913—1914 гг. некоторые лаборатории выпускали по нескольку тысяч ампул в месяц.
Технология лекарственных форм (2)
... технологии их используют практически при изготовлении всех лекарственных форм, как основу. По функциональной роли в лекарственной форме различают следующие вспомогательные вещества: - формообразователи - носители лекарственных веществ в лекарственной форме ... гормональные вещества. Некоторые из них удалось выделить в чистом виде (например, адреналин). Ряд гормонов получают синтетически (половые ...
На отечественных заводах химико-фармацевтической промышленности в 1950 г. готовили 240 млн. ампул, в 1957 г. — 803 млн.
В 1965 г. в Советском Союзе выпущено около 2,5 млрд. ампул.
Широкое распространение ампул объясняется тем, что подкожные впрыскивания имеют ряд преимуществ перед другими методами применения лекарств, а именно:
1. быстрое действие лекарственного вещества;
2. неизменяемость лекарственного вещества под влиянием пищи и желудочного сока, как это бывает при внутреннем употреблении;
3. точность и удобство дозировки;
4. возможность введения лекарственного вещества больному, находящемуся в бессознательном состоянии, или когда лекарство нельзя вводить через рот;
5. возможность заготовки больших количеств стерильных растворов в ампулах, что облегчает и ускоряет отпуск их из аптек.
Однако наряду с положительными сторонами растворы в ампулах имеют весьма существенные недостатки:
1) при введении жидкостей через поврежденный покров кожи в кровь легко могут попасть болезнетворные микроорганизмы и их споры, которые, найдя здесь хорошие условия для своего развития, быстро размножаются и могут вызвать инфекцию всего организма;
2) вместе с растворами в кровь легко могут проникнуть механические загрязнения, например волоски, мелкие кусочки стекла, пылинки, нерастворимые осадки и т. д. Эти вещества с потоками крови могут быть занесены в капилляры и вызвать эмболию или расстройство сердечной деятельности;
3) растворенные посторонние примеси, находящиеся в инъекционном растворе даже в ничтожных количествах, могут оказать вредное действие на организм больного;
4) болезненность впрыскивания;
5) возможность ранения сосудов и нервов;
6) необходимость посторонней помощи при впрыскивании и т. д.
Отсюда вытекает требование о весьма высоком качестве инъекционных
жидкостей: они должны быть стерильными, вода и медикаменты, входящие в состав раствора, не должны содержать никаких примесей. Кроме того, стекло для ампул не должно являться источником загрязнений и порчи растворов.
Цель работы:
Задачи:
1. Изучить жидкие лекарственные средства
2. Рассмотреть процесс приготовления инъекционных растворов
РАСТВОРЫ (SOLUTIONES)
Растворами называются прозрачные, однородные, жидкие системы, содержащие два или более веществ.
Растворенное вещество обычно называют solvendum, а растворитель — solvens. В случае растворов твердых веществ или газов в жидкостях растворенным веществом обычно считают растворенное твердое вещество или газ, независимо от их количественного содержания в растворе, а растворителем — жидкость. В случае же растворов жидкостей в жидкостях растворенным веществом принято считать жидкость, содержащуюся в меньшем количестве, или ту, растворимость которой ограничена в данном растворе.
В медицинской практике в виде растворов применяют весьма разнообразные твердые, жидкие и значительно реже — газообразные вещества, растворенные в различных растворителях (воде, спирте, глицерине, маслах и т. п.).
По аптечной фармацевтической технологии : «Лекарственные формы ...
... формы Технология приготовления растворов включает следующие стадии: растворение, фильтрование, упаковку и отпуск. При приготовлении жидких лекарственных форм путем растворения сухих лекарственных веществ следует ... очищенной учитывают процентное содержание лекарственного вещества (или суммы веществ). При растворении одного вещества в воде необходимо рассчитать Смах по формуле (1). Если Смах & ...
Растворы газов в воде (хлористого водорода, аммиака, формальдегида и др.) поступают в аптеки, как правило, в готовом виде и их лишь разбавляют в случае надобности водой или другим растворителем до требуемой концентрации.
Назначаются растворы как для наружного и внутреннего, так и для инъекционного введения.
При растворении может происходить поглощение или выделение энергии (теплота растворения) и наблюдаться некоторое изменение объема.
Изменения температуры и объема обычно незначительны, но в отдельных случаях становятся отчетливо заметными; например, уменьшение объема при смешивании спирта с водой, сильное охлаждение при растворении в воде аммония нитрата или, наоборот, сильное разогревание при растворении гидрата окиси калия.
Особое внимание при приготовлении растворов для впрыскиваний следует обращать на чистоту и стерильность. Все предметы, соприкасающиеся с растворами, должны быть изготовлены из химически стойких стекла или металла. Перед работой их необходимо вымыть и сполоснуть перегнанной водой. Фильтровальные материалы должны быть высшего сорта и не содержать растворимых солей — железа, сульфатов хлоридов и т. п. Медикаменты и растворители должны быть надлежащего качества.
Для растворения применяют фарфоровые или эмалированные баки либо эмалированные реакторы. Во всех случаях используемые емкости не должны загрязнять или химически влиять на приготовляемые растворы. Емкости тщательно моют и споласкивают перегнанной водой, которая служит для приготовления растворов. Затем в указанные аппараты помещают все ингредиенты и при помешивании растворяют их. Для этого лучше применять соответствующие механизированные мешалки. Перемешивать приготовляемые жидкости сжатым воздухом не рекомендуется, так как при этом в раствор можно внести микрофлору и загрязнения; кроме того, кислород воздуха может действовать на медикаменты как окислитель.
Если нужно и если это допустимо, то для ускорения растворения жидкость подогревают. Полученный раствор после охлаждения доводят до нормы добавлением растворителя, а затем фильтруют.
Для удобства отмеривания растворов, вводимых в организм при помощи шприца с иглой, их готовят по весо-объемному принципу, т. е. растворяемые вещества берут по в е с у, а растворителя столько, чтобы получился требуемый объем раствора; например, для 10% раствора берут. 100 г соли, а воды столько, чтобы получился 1 л раствора.
На практике поступают следующим образом: в небольшом количестве инъекционной воды растворяют медикамент, отвешенный в весовых единицах. Раствор, если нужно, охлаждают до комнатной температуры и переливают в мерник, куда добавляют при тщательном перемешивании еще столько воды, чтобы получился определенный объем жидкости, выраженный в миллилитрах или литрах.
В тех случаях, когда по техническим условиям раствор нельзя приготовлять в мерниках, его готовят обычным весовым методом, сохраняя, однако, указанный принцип весо-объемного метода и производя соответствующие расчеты.
Эти расчеты основываются либо на определении удельного веса жидкости, либо на определении увеличения объема растворителя после прибавления и растворения сухих веществ.
Если эти величины определены достаточно точно, то можно легко определить, сколько нужно к отвешенному сухому медикаменту добавить по весу воды, чтобы получить требуемый объем раствора.
Аптечная технология растворов для внутреннего применения (2)
... название микстур- mixturae. Все эти и многие другие проблемы и заставляют нас с особенным вниманием относиться к изготовлению, хранению и отпуску жидких лекарственных форм. Цель: углубить знания по вопросу технологии изготовления растворов для ...
Например, требуется изготовить 40% раствор глюкозы с удельным весом 1,132, т. е. 100 мл весят 113,2 г; глюкозы взято 40 г. Следовательно, воды надо взять 113,2 — 40 = 73,2 г.
В организм можно вводить без особых осложнений не более 2 мл обычных инъекционных растворов. Если же одновременно нужно впрыснуть больше указанного количества, то свойства вводимых жидкостей в той или иной мере должны приближаться к плазме человеческой крови, например по величине осмотического давления, по качественному и количественному составу ионов, по вязкости, по значению рН от 7,2 до 7,4.
Растворы для впрыскиваний должны быть совершенно прозрачны,, за исключением специальных прописей взвесей или эмульсий, и, что особенно важно, они должны быть безусловно свободны от всяких видимых невооруженным глазом посторонних частичек (пыли, волосков, обрывков ваты, фильтровальной бумаги, осколков стекла и пр.), т. е. таких частичек, на присутствие которых в других растворах, настойках или жидкостях, не вводимых парентерально, не обращают внимания. Поэтому методы фильтрования растворов, предназначенных для наполнения ампул, должны отличаться большей тщательностью и фильтровальные материалы должны быть более плотными, чем в других случаях. Аппаратура, трубопроводы и окружающая среда должны быть таковы, чтобы профильтрованные растворы не могли вновь загрязниться.
Обычно растворы для подкожного введения пропускают через фильтры, работающие под давлением или под вакуумом. Размеры их бывают весьма различны и зависят от количества фильтруемой жидкости. ‘По своей конструкции они ничем не отличаются от- обыкновенных фильтров.
Так как растворы, разливаемые в ампулы, не содержат значительного количества взвешенных частиц и осадков, фильтр-прессы и тому подобные фильтры здесь мало применимы.
Фильтр «грибок».
Они работают по следующему принципу: нефильтрованный раствор по трубопроводу / поступает в емкость 2, куда помещен фильтр (грибок) 3, завернутый в два слоя бязи, в слой ваты и в слой бельтинга (фильтрующий материал может быть заменен в зависимости от фильтруемой жидкости).
Фильтр 3 соединен с бутылью 4 или другой емкостью, выдерживающей разность давления.
Для предотвращения попадания профильтрованного раствора в вакуум-линию 6 устанавливают ловушку 5. Обычно в один бак 2 помещают несколько фильтров. По мере наполнения бутыли 4 чистым раствором ее отключают от общей сети вакуума, закупоривают и просматривают на содержание в жидкости физических загрязнений. При этом бутыль с раствором освещается сильным лучом света. Если жидкость окажется чистой, то она поступает в разливочное отделение, если — загрязненной, то ее выливают обратно в бак.
Перед работой через фильтр пропускают столько воды, чтобы из него были удалены все посторонние примеси и механические загрязнения.
Затем приступают к фильтрованию раствора. При этом первую часть, т. е. разбавленный раствор, отделяют от общей массы фильтра. Для очистки фильтра без его разборки, в обратном направлении пропускают пар или дистиллированную воду.
Наполнение ампул производят различными методами. Процесс наполнения ампул под вакуумом происходит почти так же, как и мытье под вакуумом. Ампулы опускают открытыми концами в жидкость и помещают в герметически закрытый аппарат, из которого выкачивают воздух до определенной нормы, устанавливаемой экспериментальным путем, так как от степени разрежения воздуха зависит и степень наполнения.
Методы утилизации отработанных буровых растворов и шлама
... отходов бурения. К последним относят отработанный буровой раствор и буровые сточные воды. Отходы собирают в амбары. Стоки попадают сначала в первую секцию -- шламовый амбар, ... очистки раствора, котором комплектуется буровая установка. Установка предназначалась для обезвреживания шлама, регенерации избыточных объемов бурового раствора, добавочных жидкостей. Буровой раствор, поступающий из скважины, ...
При вакууме 1 am ампулы заполняются полностью, при 0,5 am — наполовину и т. д.
После заполнения ампул их поворачивают открытыми шейками кверху, закрывают аппарат и выкачивают воздух. При этом из шеек (капилляров) высасывается жидкость.
Другой метод удаления жидкости из капилляров состоит в следующем: ампулы, в капиллярах которых осталась жидкость, ставят в шкаф открытыми концами кверху. Шкаф герметически закрывают, а затем в него под давлением подают профильтрованный воздух. При небольшом избыточном давлении жидкость из капилляров продавливается в ампулу. Этот метод имеет преимущество перед первым. После удаления жидкости капилляры ампул запаивают.
Кроме указанных способов, существуют другие автоматические или полуавтоматические способы наполнения ампул.
При небольшом количестве ампул самым простым способом является наполнение их при помощи стеклянной бюретки. Но вследствие малой производительности такие бюреточные способы наполнения ампул для производственных целей непригодны. Их можно использовать только для лабораторных надобностей.
При сравнении всех методов наполнения ампул жидкостями оказывается, что каждый из них имеет свои положительные и отрицательные стороны.
Например, наполнение ампул поодиночке имеет важные преимущества: капилляры остаются чистыми; запаивание их не представляет трудностей в отношении пригорания и прилипания к капиллярам медикамента; растворы в ампулах меньше загрязняются. Кроме того, этот метод наполнения можно объединить с автоматической отрезкой капилляров, отмериванием требуемого количества жидкости, запайкой ампул и т. д., т. е. автоматизировать метод; рабочий только устанавливает пустые ампулы в аппарат, наливает жидкость в резервуар и принимает запаянные ампулы.
Но такие полуавтоматы малопроизводительны. В лучшем случае они, при обслуживании одним рабочим, могут выпустить в час 700—800 ампул емкостью по 1—2 мл. Расход газа при этом составляет около 2 м3, а расход электроэнергии 0,2 л. с.
Кроме того, такие полуавтоматы требуют весьма высокой стандартизации формы и размеров пустых ампул, температуры и конфигурации пламени, определенной скорости работы механизмов и т. д. В противном случае, много ампул будет разбито, плохо запаяно, неправильно наполнено и пр.
При наполнении ампул под вакуумом капилляры могут загрязниться, особенно — густыми и вязкими растворами; растворы в ампулах могут также больше загрязниться, чем при предыдущем способе; автоматизация других процессов ампулирования сложнее (например, запайки ампул).
Но производительность данного метода значительно выше, чем при одиночном способе.
Обмывка капилляров
Для предотвращения такого загрязнения существует несколько методов:
1. сначала наполняют ампулы более концентрированным раствором, а потом прибавляют до требуемой нормы профильтрованную инъекционную воду, омывая ею капилляры;
2. в лабораторных условиях капилляры омывают паром ;
3. на крупных производствах лекарственное вещество, приставшее к стеклу, удаляют при помощи специального пульверизатора в который одновременно подают сжатый воздух и профильтрованную инъекционную воду через краны. Держа за рукоятку пульверизатор, ампульщица направляет струю распыленной воды, образованную посредством распылителя, наконечника и колпачка.
Методы стерилизации медицинских изделий
... ФЗ от 30.03.1999 г. Стерилизация — это полное уничтожение микроорганизмов и их спор. Методы, средства и режимы стерилизации изделий медицинского назначения определены стандартом ОСТ 42 — 21 — 2 — 85. Медицинские изделия, проникающие при манипуляциях ...
Заполненные ампулы переносят в специальные шкафы с двумя дверцами. С противоположной стороны ампулы вынимают для запайки.
В помещениях, служащих для мытья пустых ампул и заполнения их растворами, а также в других смежных помещениях должна соблюдаться идеальная чистота, без чего нельзя избавиться от появления механических загрязнений в ампулах с инъекционными жидкостями.
Быстрота и качество запайки ампул зависят от температуры, формы пламени и легкоплавкости стекла. В лабораторных условиях несколько ампул можно, хотя и медленно, запаять даже на спиртовой горелке.
Обычно для запайки ампул применяют специальные или газовые паяльные горелки, которые дают спокойное, малосветящее, не коптящее пламя, имеющее форму заостренного конуса. Голубой конус, охватывающий внутреннюю часть пламени, имеет более высокую температуру, на самом же конце его температура наивысшая. В этом месте запайка-ампул происходит почти мгновенно.
Процесс запайки можно производить двумя способами: ручным и автоматическим.
Запайка ампул считается удовлетворительной:
1. если на концах шеек не осталось острых, легко отламывающихся кончиков;
2. если на ампулах нет шароподобных вздутий, которые легко бьются;
3. если при сильном встряхивании ампулы не пропускают капельки жидкости.
Для более надежной проверки ампулы нагревают в окрашенном растворе (например, метиленовой сини) и оставляют до полного их охлаждения.
Ампулы, жидкость которых окрасилась, отбрасывают как брак. (Такую проверку обычно производят после стерилизации наполненных и запаянных ампул).
Без надлежащей стерилизации в ампулах с инъекционными жидкостями могут оставаться патогенные микроорганизмы и их споры. При продолжительном хранении таких ампул даже единичные экземпляры микробов или спор могут размножаться до огромных количеств. Если впрыснуть больному препарат, содержащий некоторое количество патогенных микробов или их спор, то последние, найдя в организме человека хорошие условия для своего развития, могут быстро размножиться и явиться причиной новой болезни или даже смерти больного. При этом чем больше было введено болезнетворных микробов и их спор, тем больше опасность заражения больного.
Поэтому все инъекционные растворы должны быть абсолютно стерильными или, во всяком случае, не содержать вегетативных форм патогенных микроорганизмов и их спор.
На процесс стерилизации ампул с указанными жидкостями необходимо обращать сугубо серьезное внимание.
С одной стороны, необходимо уничтожить все вегетативные формы болезнетворных микроорганизмов и их споры, а с другой стороны, эту стерилизацию надо произвести таким образом, чтобы лекарственные вещества, находящиеся в инъекционных растворах, не подверглись химическому разложению и сами растворы не потеряли своих фармакологических свойств.
В зависимости от физико-химических свойств лекарственных веществ стерилизацию, ведут различными способами:
1. при повышенной температуре (физическими методами);
2. механическими методами;
3. химическими методами.
Физические методы стерилизации
Споры бактерий являются более стойкими к высокой температуре. Высокая теплостойкость спор объясняется малым содержанием в них воды, а также плохой теплопроводностью их оболочки. Поэтому некоторые споры выдерживают нагревание в текучем паре при 100° С в течение часа, а в исключительных случаях — в течение многих часов, особенно в вязких средах.
Понятие стерилизации, ее основные методы
... странах - членах СЭВ радиационной стерилизации материалов и изделий медицинского назначения" и "Сводом правил, регламентирующих ... значимыми применениями электронных технологий являются стерилизация изделий для медицины. По ... ампулы, флаконы и необходимую посуду), вспомогательные материалы. Лучшими являются стерилизаторы с ламинарным потоком стерильного воздуха, нагретого до требуемой температуры, ...
Насыщенный пар под давлением, т. е. выше 100°С, убивает микроорганизмы и споры быстрее, чем текучий пар. Однако в смеси пара с воздухом микробы и их споры погибают не так скоро, как в чистом насыщенном водяном паре. Так, в присутствии 20% воздуха в парах при 1 am температура оказывается на 3°С ниже, чем по показаниям манометра.
Сухой воздух (жар) убивает микроорганизмы при более высокой температуре, чем водяной пар. Для вполне надежного обеспложивания требуется нагревание в течение часа в сухом воздухе при температуре 150—180°С.
Низкие температуры действуют на микроорганизмы очень слабо, временно приостанавливая их размножение. При повышении температуры жизнедеятельность микробов восстанавливается. Некоторые споры даже при температуре —190°С несколько месяцев сохраняли способность к прорастанию. Следовательно, низкая температура не может служить обеспложивающим фактором.
В присутствии белков, различных коллоидов, Сахаров и некоторых других веществ микроорганизмы и их споры погибают медленнее. На скорость отмирания микроорганизмов оказывает также влияние реакция стерилизуемой жидкости; в кислой среде бактерии погибают быстрее. Характер и вязкость жидкости также могут влиять в той или иной мере на устойчивость микроорганизмов и их спор; например, в воде они теряют жизнеспособность скорее, чем в концентрированном растворе глюкозы; в водных растворах они погибают быстрее, чем в безводных (масляных), жидком парафине и т. д. Молодые бактериальные клетки и их споры менее устойчивы, чем старые.
В зависимости от термической стойкости раствора стерилизацию производят различными методами и при различных температурных условиях. Фармакопея IX издания рекомендует несколько основных методов.
Стерилизация при температуре 160—170° С в течение 1ч.
Таким способом можно обеспложивать также те неорганические вещества, которые при этом не изменяются, например тальк, окись цинка и др. Порошки, содержащие кристаллизационную воду и органические вещества, не выдерживают такого нагрева без существенных изменений или разложения. Этот метод имеет лишь лабораторное значение.
Прокаливание на огне и проведение через огонь, Стерилизация при повышенной температуре
Устроены эти стерилизаторы по принципу папинова котла. В них можно стерилизовать при температуре 100—120° С и выше. Современные автоклавы оборудуются арматурой для автоматического контроля и регулирования температуры, давления внутри аппарата и продолжительности стерилизации.
Работать с автоклавами нужно весьма внимательно, так как при чрезмерном повышении давления пара аппарат может взорваться, разрушить помещение и нанести травмы работающим.
При продолжительной стерилизации некоторые растворы в ампулах могут разложиться, ампулы разрушиться и потерять содержимое.
Однако метод стерилизации в автоклавах находит широкое применение, так как болезнетворные микроорганизмы и их споры при этом быстро погибают.
Стерилизацию обычно производят насыщенным водяным паром. На небольших предприятиях в автоклав сначала помещают ампулы и наливают воду. Затем закрывают крышку и сразу надевают противоположные барашки, которые постепенно и с одинаковым усилием завинчивают. Воду нагревают до кипения. Образовавшиеся пары поступают в автоклав с примесью воздуха.
На крупных предприятиях пар подается из общезаводских паровых котлов.
Водяные пары всегда бывают смешаны с воздухом, имеющим свое парциальное давление, и вследствие этого показания термометра и показания манометра не всегда сходятся. Например, при 120° С смесь может иметь давление 2,4 ата (1,2 ати).
Чистый же пар при этих же условиях имеет давление 2,0 ата (1,0 ати).
Поэтому из автоклава необходимо до стерилизации выше 100° С удалить весь воздух. Для этого при 100° С продолжают выпускать пар в течение 2—3 мин. Затем вентиль закрывают. Нагревание положенное время продолжают при требуемой температуре или давлении. После этого нагревание автоклава прекращают, и автоклав оставляют стоять (охлаждаться) до тех пор, пока температура внутри него не понизится до 100° С (манометр же будет показывать нуль).
После этого постепенно открывают вентиль. Если же открыть его раньше, то внутри ампул давление будет больше, чем в автоклаве, и стеклянные хрупкие сосудики могут быть разрушены. При этом, если вентиль открыть с опозданием, когда внутри автоклава температура будет значительно ниже 100° С, то в автоклаве будет вакуум, а внутри ампул давление останется относительно высоким. Эта разница давлений тоже может вызвать разрушение стекла (ампул).
Таким образом, при 100° С вентиль закрывают и при этой же температуре его открывают.
Ниже 100° С, после того как давления внутри ампул и внутри автоклава будут почти одинаковыми, все барашки ослабляют, а затем снимают. Еще теплыми простерилизованные ампулы выгружают из автоклава.
Автоклав состоит из камеры , в которую в сеточном биксе помещают стерилизуемые ампулы; кожуха и крышки, на которой находятся предохранительный клапан и манометр. Крышка прикрепляется к корпусу откидными болтами. Для того чтобы между крышкой и корпусом не проходил пар, между ними устанавливают прокладку. Под камерой имеется газовая горелка, газ к которой поступает по трубе через кран. Зажигают газ через запальное окно; продукты горения проходят между камерой и кожухом и выходят через отверстия.
В нижнюю часть камеры через воронку и водомерное стекло наливают воду, которую периодически выливают через кран. Пар, образующийся в нижней части камеры, через трехходовой кран поступает в верхнюю часть камеры и вытесняет из нее воздух через трубу. Через эту же трубу конденсат стекает в канализацию. После вытеснения всего воздуха, что может быть определено по термометру, кран на трубе закрывают и повышают давление до заданной величины (обычно до 1 am).
После окончания стерилизации прекращают нагревание автоклава и поворачивают трехходовой кран таким образом, чтобы из котелка по трубе сконденсировавшаяся жидкость и пары уходили в канализацию или в бак с холодной водой. Для выпуска пара открывают воздушник или приподнимают рычаг предохранительного клапана. Убедившись, что давление внутри камеры равно внешнему, отвинчивают откидные болты, снимают крышку автоклава и вынимают простерилизованные ампулы.
Также применяют в качестве автоклава камеру Крупина.
Перед открытием автоклава после стерилизации необходимо постепенно уравновесить внутреннее давление с внешним. При нарушении этого правила стерилизованные ампулы могут быть разорваны оставшимся внутри них повышенным давлением.
Стерилизация в жидкостях при температуре выше 100°
Описанный метод стерилизации не может найти широкого применения, так как при температуре выше 112° С, т. е. при давлении 0,5 ати, ампулы начинают лопаться, ибо давление внутри них становится большим, чем снаружи. В автоклаве же давление изнутри и снаружи ампул одинаково.
Стерилизация при температуре ниже 100° С -пастеризация. Многие растворы нельзя нагревать даже до 100° С без изменения их основных свойств, но при более низкой температуре они не изменяются.
Известно, что для уничтожения болезнетворных бактерий не всегда нужно прибегать к столь высоким температурам, как 100—120° С; иногда достаточно прогреть раствор в течение 10 мин при 70—80° С или в течение 30 мин при 60—65° С. Такой метод стерилизации называется пастеризацией — по имени французского ученого Постера, впервые применившего его. Однако при этом споры и некоторые виды непатогенных микробов не теряют способности размножаться. Поэтому для стерилизации ампул с растворами данный метод почти не применяется.
Дробная стерилизация, или тиндализация
Практически это осуществляют следующим образом: наполняют сосуд подкрашенной водой, кладут в него запаянные ампулы и нагревают от 30 мин до часа при температуре 60—80° С. При этом надо постоянно перемешивать воду, так как в высоком сосуде разница температур между верхним и нижним слоями может достигать нескольких градусов.
После первой стерилизации ампулы оставляют в течение суток при температуре 25—37° С. Через сутки их снова подогревают и затем опять оставляют на сутки. Так повторяют пять раз, если нагревание шло при 60—
- 65° С в течение одного часа каждый раз. Если температуру доводили до 70—
- 80° С, то при тех же условиях нагревание повторяют три—четыре раза по одному часу, а если нагревание продолжалось всего 30 мин при 60—65° С, — то шесть — семь раз.
Химический способ стерилизации
Ни одно из дезинфицирующих средств в употребляемых концентрациях не гарантирует уничтожения стойких микробов, а только’ приостанавливает их размножение. В то же время эти средства не безразличны для организма, а многие даже ядовиты; поэтому увеличение их концентрации невозможно, а применение в слабых концентрациях иногда не оказывает нужного действия на микроорганизмы и особенно на их споры. Помимо того, многие дезинфицирующие средства могут вступать в химическое взаимодействие с лекарственным веществом; так, например, растворы некоторых алкалоидов образуют с сулемой нерастворимые осадки, фенол с антипирином дает маслянистую жидкость, всплывающую на поверхность, и т. д.
Обеззараживающие средства добавляются к ампулированным растворам только по соответствующей официнальной прописи. При этом на этикетке должно быть указано наименование и количество взятого вещества.
Некоторые нетеплостойкие лекарственные вещества обладают сильными бактерицидными свойствами (уротропин, парааминосалициловая кислота).
Поэтому растворы таких веществ допускаются к применению без стерилизации. Однако для большей предосторожности пустые ампулы, воду и другие вещества, входящие в соприкосновение с приготовляемым раствором, предварительно тщательно стерилизуют. Наполнение ампул и запайку их производят в асептических условиях.
В области химической стерилизации должны быть решены еще многие проблемы.
Механический способ удаления микроорганизмов из растворов
Эти фильтры, или так называемые свечи, имеют вид полых цилиндров; с одного конца они закрыты, а с другого в них сделаны отверстия. Фильтрование можно производить двояко: либо жидкость вводят внутрь фильтра, и она, просачиваясь через стенки, вытекает в стерильный сосуд, либо, наоборот, жидкость отсасывается через стенки внутрь свечи и оттуда вытекает через отверстие. Последний способ удобнее в том отношении, что фильтр легче очистить от приставших к нему загрязнений.
Такие свечи изготовляют из фарфора, а иногда — из инфузорной земли.
Действие свечей тем совершеннее, чем меньше и равномернее их поры. Мельчайшая трещина в фильтре делает его непригодным к употреблению. Контроль целости стенок производится путем накачивания воздуха в свечу, погруженную в воду. Если в каком-либо месте быстро выходят многочисленные пузырьки воздуха, свечой пользоваться нельзя.
Бактерии задерживаются пористыми перегородками не потому, что диаметр капиллярных ходов фильтра меньше, чем поперечник бактерий, а вследствие молекулярного притяжения и прилипания взвешенных тел к внутренним стенкам пор. Этим объясняется так называемое прорастание фильтров при длительном фильтровании, когда микроорганизмы и споры постепенно начинают переходить в фильтрат; этим же объясняется проникновение через фильтры фильтрующихся вирусов и пирогенных веществ. Поэтому свечи необходимо периодически чистить и стерилизовать.
Асептический метод приготовления инъекционных растворов., Стерилизация токами высокой частоты
При стерилизации обычными методами нагревание обусловливается теплопроводностью и протекает постепенно от периферии к центру вещества. На такой прогрев требуется продолжительное время. При стерилизации в поле токов ультравысокой или высокой частоты нагревание происходит без участия теплопроводности, потому что электрические силовые линии проходят через каждую точку тела почти одновременно, вследствие чего нагрев практически осуществляется сразу же как в центре, так и по краям а’мпул — одинаково быстро в маленьких и больших ампулах или даже в значительной массе ампул. При этом имеется возможность сравнительно просто и быстро производить в широких пределах регулировку и контроль режима нагревания. Такой возможности нет при автоклавном методе стерилизации.
Стерилизация инфракрасными лучами
Источником инфракрасных лучей являются любые нагретые тела. Практически для этой цели могут быть использованы специальные зеркальные тепловые лампы накаливания (термоизлучатели), выпускаемые отечественной промышленностью. Эти лампы могут быть использованы для трансформации электрической энергии в лучистую и тепловую, применяемую для стерилизации.
Особенность передачи лучистой энергии заключается в том, что промежуточный слой воздуха между термоизлучателем и облучаемым материалом не нагревается и теплопотери в окружающую среду невелики.
Скорость нагрева ампул с раствором зависит от следующих факторов:
1. плотности лучистой энергии на единицу поверхности;
2. температуры;
3. оптических свойств твердой и жидкой фаз;
4. отражательной и поглотительной способностей ампульного стекла и растворов;
5. диаметра (величины) ампул;
6. количества водяных паров и запыленности воздуха между лампой и нагреваемыми ампулами.
По отношению к инфракрасным лучам различают прозрачные, полупрозрачные и непрозрачные вещества.
Ампулы с растворами лекарственных веществ относятся к полупрозрачным материалам, так как стекло, вода и пары над раствором сильно поглощают инфракрасные лучи. При нагревании инфракрасными лучами лучистая энергия превращается в тепловую во всей толще стекла и прилегающем слое жидкости глубиной около 3 мм, равномерно прогревая весь его объем только путем конвекции.
Для обеспечения равномерного прогрева инфракрасными лучами ампулы с растворами следует располагать на движущейся ленте в один слой.
Стерилизация ультрафиолетовыми лучами
Наибольшим бактерицидным действием обладает ультрафиолетовая радиация, лежащая в пределах длины волн 254—257 ммк (миллимикрон -миллионная часть миллиметра).
Различные типы бактерий в разной степени стойки к ультрафиолетовым излучениям; так, особо стойкими являются споры, многие из которых не теряют своих вегетативных свойств.
Высокая влажность воздуха повышает сопротивляемость бактерий, а в тонком слое воды на стерилизацию требуется примерно в десять раз больше энергии по сравнению с той, которая нужна для гибели тех же микроорганизмов в воздухе. С увеличением толщины слоя воды бактерицидные свойства ультрафиолетовых лучей приближаются к нулю. При погружении бактерицидных ламп в сосуды с молоком достигают весьма незначительных результатов в его стерилизации, и то при условии перемешивания.
Ампульное стекло практически непрозрачно для бактерицидной части ультрафиолетовой радиации.
Из приведенных данных видно, что стерилизация растворов при помощи ультрафиолетовых лучей пока не представляется возможной. Однако этот метод широко применяют для стерилизации воздуха в ампульном цехе при асептическом ампулировании растворов.
Стерилизация ультразвуковыми колебаниями. Ультразвуковые колебания — это колебания с частотой выше воспринимаемой человеческим ухом (более 20 тыс. колебаний в секунду).
Эти колебания вызывают мгновенный разрыв, разрушение и гибель микроорганизмов. Поэтому делались попытки использования ультразвуковых колебаний для стерилизации жидкостей.
Однако применение ультразвука ограничивается воздействием его на лекарственные вещества, возможностью разрыва ультразвуковыми колебаниями химических связей макромолекулы, а также процессами окисления за счет активизации растворенного кислорода и других химико-физических процессов.
Поверхность ампул во время стерилизации загрязняется теми растворами, которые вытекают из разбитых ампул. Если они загрязнены водными растворами, то биксы с горячими ампулами для определения их герметичности погружают в подкрашенную холодную воду. Затем их промывают горячей водой под душем. Ампулы, испачканные масляными растворами, сначала погружают в котел с горячей мыльной водой, потом в горячую чистую воду, после чего их обмывают под душем.
Мокрые ампулы обтирают мягкими полотенцами. При этом дефектные ампулы (пустые, с окрасившимися жидкостями, мутные и т. п.) отбрасывают. Оставшиеся ампулы подвергают тщательному просмотру.
Предпринимались попытки протирку ампул заменить продуванием их теплым воздухом. Однако при такой сушке поверхность ампул покрывается матовым налетом, в результате чего в них трудно заметить механические загрязнения.
Одним из важнейших моментов является просмотр готовых и удаление бракованных ампул: с плохой запайкой, с трещинками или механическими загрязнениями (волосками, осколками стекла, продуктами распада медикаментов и т. д.), с недостаточным количеством раствора и другими изъянами.
Работа эта требует большого навыка и хорошего зрения. Бракераж производят в затемненной комнате при помощи закрытого рефлектора, прикрепленного к штативу. Лампа помещается внутри кожуха, в котором имеется узкая щель, дающая яркий пучок света. В этом свете каждую ампулу встряхивают и несколько раз переворачивают донышком вверх и вниз. При этом элементы загрязнения передвигаются и становятся хорошо заметны на темном или белом фоне.
Стандартных ламп на производстве не применяют. Наилучшие результаты достигаются при применении рефлектора с черным экраном Рижского завода.
Ввиду сильного утомления глаз, беспрерывный просмотр ведут не более четырех часов, после чего работниц, просматривающих ампулы, желательно переводить на другую работу.
Прежде на каждую ампулу наклеивали бумажную этикетку, указывающую название раствора, его концентрацию и наименование изготовившего его завода. Этот метод этикетирования нерационален, потому что бумажная этикетка полностью закрывает ампулу, вследствие чего последующее изменение или порчу раствора трудно заметить.
В настоящее время надписи печатаются на самих ампулах, для чего применяют специальные машины. У нас широко распространена машинка конструкции Симховича; раньше ампулыцица накладывала в нее ампулы вручную. Конструкция этой машинки была изменена М. Е. Кислиным. Вместо ручной подачи ампулы подаются в машинку автоматически; нанесение надписей производится также автоматически.
Ампулы с надписями укладывают в специальные коробки с отдельными гнездышками для каждой.
Затем коробки связывают и упаковывают; на пакеты наклеивают соответствующие этикетки.
Из серии упакованных ампул берут на выдержку некоторое количество их и делят на две части. Одну часть посылают в аналитическую лабораторию для установления правильности химического состава и концентрации раствора, другую отправляют в бактериологическую лабораторию для определения стерильности раствора.
В бактериологической лаборатории содержимое ампул переносят в чашечки Петри со стерильной питательной средой, например агар-агаром, желатином и др. Эти посевы несколько дней выдерживают в термостатах. При отсутствии роста какой-либо культуры жидкость в ампулах считают стерильной, и если раствор составлен правильно, ампулы признаются годными.
За последние годы значительно увеличен объем производства, расширена номенклатура лекарственных средств, освоен выпуск новых эффективных препаратов сложного состава, введены повышенные требования к их качеству. Повышаются требования и к качеству лекарственных форм, приготовляемых в аптеках.
Основной объем рецептуры индивидуального изготовления в аптеках лечебно-профилактических учреждений составляют лекарственные формы для инъекций. В рецептуре хирургических реанимационных и терапевтических отделений он доходит до 70%.
Методическими указаниями по микробиологическому контролю в аптеках предусмотрено исследование инъекционных растворов до их стерилизации, т.е. этими документами не предусмотрена проверка растворов для инъекций, приготовляемых в аптеках, на стерильность.
Организация бактериологического отделения при контрольно-аналитической лаборатории позволяет перейти на посерийное приготовление лекарственных форм для инъекций, с обязательным бактериологическим контролем каждой серии.
Эксперимент посерийного приготовления был проведен в аптеке городской многопрофильной больницы. Больница выполняет государственный эксперимент по интенсификации использования коечного фонда. Это привело к увеличению количества больных, находящихся на лечении, а следовательно, к интенсификации работы аптеки при том же штате.
В состав больницы входит 30 отделений и служб, в том числе отделение интенсивной терапии и анестезиологии, хирургическое, гепатохирургическое, травматологическое, пульмонологическое, урологическое, отделение хронического гемодиализа, кардиохирургическое, операционный блок и др.
Нами были изучены номенклатура и количество выписываемых растворов для инъекций. Средняя ежедневная потребность свыше 1000 флаконов 27 наименований растворов. Используя эти данные, мы разработали и внедрили график работы асептического блока аптеки на неделю (см. таблицу).
График утвержден главным врачом больницы и доведен до сведений отделений. Кроме этого, был разработан ежедневный почасовой график, которым предусмотрено первоочередное приготовление тех растворов, в состав которых входят медикаменты списка Б, а также резервируется время для срочного приготовления необходимых растворов.
Разработанный график позволяет избежать одновременного приготовления растворов различных наименований или одного наименования, но разных концентраций.
Приготовление растворов посерийным методом позволило на 30% сократить затраты рабочего времени фармацевтов при фильтрации, фасовке, укупорке и контроле растворов, а также за счет более рационального использования стерилизаторов паровых с электроподогревом.
Серией считается раствор, приготовляемый в одной емкости. Приготовленная серия подвергается химическому анализу, разливается в стеклянные сосуды для крови из стекла НС-2 или флаконы из дрота стекла НС-1, которые укупориваются резиновыми пробками (марки ИР-21 ил 25 П), проверяются на отсутствие механических загрязнений, окатываются металлическими колпачками, стерилизуются; проводится повторный химический контроль. После этого каждая серия сдается для проведения бактериологического контроля и передается для хранения в материальную комнату. Отпускается этот раствор только после заключения бактериологической лаборатории, т.е. через 7-10 суток. Исходя из вышеизложенного, считаем, что установленный в соответствии с приказом срок годности растворов для инъекций 1 месяц позволяет готовить их при посерийном методе и проведении бактериологического анализа в запас и отпускать по мере надобности в отделения.
1. Был разработан и внедрен график работы асептического блока аптеки на неделю
2. Был разработан ежедневный почасовой график, которым предусмотрено первоочередное приготовление тех растворов, в состав которых входят медикаменты списка Б
3. Приготовление растворов посерийным методом сократило зтараты рабочего времени на 30%
Во время прохождения мною практики по аптечной технологии лекарств в аптеке СОГМА, я узнала, что стерильные растворы в аптеке готовят в первый, третий и пятый дни недели. В среднем, в день готовят 420 флаконов.
По объему выполняемой работы 40 – 70% составляют требования на стерильные лекарственные формы.
Применение в аптеке СОГМА посерийного приготовления лекарственных форм для инъекций привело к увеличению количества выпускаемых лекарственных средств.
Во время приготовления инъекционных растворов необходимо соблюдать конкретные условия, иначе в растворы могут попасть инородные частицы. Это в свою очередь может привести к тяжелым последствиям у больного. В своей курсовой я описала все стадии приготовления инъекционных растворов в условиях аптеки и на заводе.
Таблица 1
График приготовления инъекционных растворов на неделю
|
День приготовления |
Наименование и концентрация растворов |
|
Понедельник |
Раствор глюкозы 5%, 10%, 20%, 40% |
|
Вторник |
Раствор натрия хлорида 0,9% |
|
Среда |
Раствор новокаина 0,25%, 0,5%, 1%, 2%, 5% Раствор спазмолитина 1% Раствор натрия хлорида 10% Раствор калия хлорида 10% Раствор натрия цитрата 5% Жирные масла |
|
Четверг |
Антисептический раствор № 44 Раствор тримекаина 0,25% Раствор метацила 0,5% Раствор амидопирина 4% Раствор димедрола 1% Раствор натрия гидрокарбоната 3%, 5% Раствор кальция хлорида 10% Раствор кислоты аминокапроновой 5% Раствор кислоты глутаминовой 1% Раствор Рингера Раствор калия хлорида 5% |
|
Пятница |
Раствор фурацилина 0,02% Раствор кислоты борной 2% |
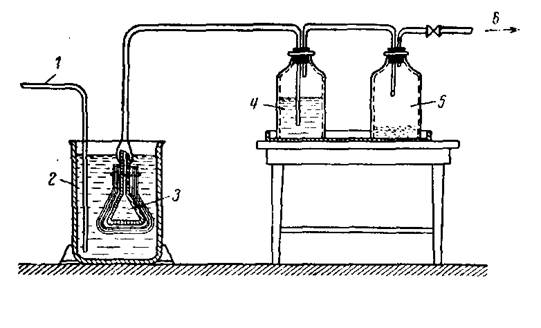
Рис. 1 Схема фильтрования растворов при помощи фильтра «грибок»
1. П.Э. Рзенцвейг, Ю.К. Сандер «Технология лекарств и галеновых препаратов»,Москва, Медицина, 1967.
2. Жарков Л.В. – Фармация, 1983 №4.
3. Интернет
4. Муравьев И.А., Кононищина Н.В. «Инъекционные растворы», Москва, 1987.
5. Неволин Ф.В. «Химия и технология инъекционных растворов» — Москва, 1971.
