Курсовая работа относится к разделу «Химическая термодинамика».
В курсовой работе студенты должны:
1) рассмотреть основные физико-химические свойства предложенных модельных систем;
2) в соответствии с приведенной методикой рассчитать термодинамические характеристики модельных систем, выбранных в качестве альтернативы бензиновому топливу;
3) сравнить полученные данные с термодинамическими характеристиками бензинового топлива;
4) на основании зависимости эксплуатационных свойств топлив от их физико-химических свойств и расчетных термодинамических параметров, а также с точки зрения защиты окружающей среды от вредных выбросов, вызванных сжиганием органического топлива в двигателях внутреннего сгорания, сделать вывод о возможности использования модельной системы в качестве добавки к традиционному воду топлива или в качестве альтернативы моторному топливу.
В качестве модельных систем предложены углеводороды и органические кислородосодержащие соединения, которые могут быть использованы в качестве альтернативного топлива, полученного из сырья не нефтяного происхождения. Они могут полностью заменять топлива, получаемые из нефти, или служить добавками, снижая расход топлива. Разработана технология получения топлив, подобных получаемых из нефти, с использованием каменного угля, горючих сланцев и т.п.
В связи с быстрым ростом автомобильного транспорта существенно обострились проблемы воздействия его на окружающую среду. Наибольшей остроты эти проблемы достигли в загрязнении атмосферного воздуха выхлопными газами.
Практически все перспективные экологически чистые автомобили проектируются под альтернативные виды топлива (не нефтяные).
Альтернативные топлива
| Показатели | Бензин | Этиловый спирт | Метиловый спирт | Природный сжатый газ |
| Т кипения, о С | 35  195 195 |
64,7 | −162 | |
| Т застывания, о С | −60  −60 −60 |
−114 | −97,8 | −182 |
| Теплота сгорания стехиометрической смеси, кДж/м 3 | 3524− | |||
| Октановое число: моторный метод исследовательский метод | 66 − 68 76 − 98 | 100 − 105 110 − 115 |
Альтернативные топлива, применяемые в настоящее время в двигателях внутреннего сгорания, по виду исходного сырья разделяются на три большие группы – нефтяного происхождения и биотоплива, а также газы различного происхождения. Основные виды альтернативных топлив: сжиженные и сжатые горючие газы; спирты и продукты их переработки и смеси с бензином; топливные смеси; искусственное жидкое топливо (например, синтетический бензин); водород, рапс или метиловый эфир рапсового масла и др.
Из множества альтернативных источников наибольшее распространение и применение получило использование газа в сжатом и сжиженном виде. Газовые топлива по своему элементарному составу весьма различны, для них характерно повышенное содержание метана (от 30 до 95% в зависимости от происхождения) и окиси азота, они более устойчивы к детонации, что позволяет повысить степень сжатия.
Альтернативные топлива по своим физико-химическим свойствам не только не уступают, но и по некоторым параметрам превосходят традиционные топлива, в частности по экологическим параметрам (табл. 2).
Таблица 2
| Вид топлива | Выбросы загрязняющих веществ, % | |||
| СО | СН х | NO 2 | SO 2 | |
| ПДК, мг/л | ||||
| 3·10 -2 | 5·10 -3 | 2·10 -2 | ||
| Бензин (углеводороды С 5 Н12 –С11 Н24 , tкип. =150–200 о С | 89,2 | 79,0 | 40,4 | 15,8 |
| Сжиженный газ (С 3 Н8 +С4 Н10 ) tкип. >50 о С, р=1,6 МПа | 2,6 | 1,4 | 0,6 | 0,4 |
Сжатый газ (  98% СН4 ), р=20 МПа 98% СН4 ), р=20 МПа |
4,3 | 3,5 | 2,5 | 1,2 |
Одним из наиболее вероятных альтернативных топлив для двигателей внутреннего сгорания являются спирты (в основном, метиловый – метанол и этиловый – этанол).
Применяются также продукты переработки спиртов и смеси спиртов с бензином. Для спиртовых топлив характерно увеличение содержания кислорода (до 30%), что приводит к уменьшению теоретически необходимого количества воздуха и низшей теплоты сгорания.
Наиболее перспективным топливом для автотранспорта является метанол. Обладая высокой устойчивостью к детонации, он позволяет увеличить КПД двигателя и исключить применение ядовитых антидетонаторов. Однако, по сравнению с бензинами, метанол имеет высокую скрытую теплоту испарения (1100 кДж/кг, бензин – 350 – 400 кДж/кг), поэтому пуск двигателя в холодную погоду затруднен. Кроме того, теплотворная способность метанола вдвое меньше, чем бензина, а следовательно, расход топлива вдвое больше.
Самое главное – метанол яд, разрушает детали из магниевых сплавов. Кроме того, метанол обладает высокой токсичностью (ПДК 5 мг/м 3 ).
Именно поэтому, имеющий высокое октановое число, метанол применяют только как добавку к бензину, а также используют его для получения синтетического бензина (на высококремнистых цеолитах при 340−450 °С) в целях экономии нефтяного сырья.
Этиловый спирт
Водород представляется наилучшим экологически чистым топливом (низшая теплота сгорания – 119872 МДж/кг), но обладая малым удельным весом потребует больших затрат на перекачивание по трубам, т.е. выход чистой энергии будет значительно ниже. КПД двигателей внутреннего сгорания, работающих на водороде выше, а загрязнение окружающей среды ничтожно (состав отработавших газов – воздух, Н2 О, NOx ).
ДВС работают либо на жидком баллонном водороде, либо гидридах металлов, разлагающихся при нагреве с выделением водорода, например:
СаН 2 + Н2 → 2Н2 + Са(ОН)2 .
Синтетический бензин
биодизельного топлива
Двигатели внутреннего сгорания, работающие на традиционных видах топлива, будут еще долгие годы занимать ведущие позиции в автомобильном мире, что обусловлено значительными естественными запасами природных ресурсов.
Автомобиль с двигателем внутреннего сгорания можно рассматривать как своеобразный химический реактор, который синтезирует ядовитые вещества и выбрасывает их в атмосферу.
| Бензин + воздух | 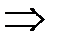 |
ДВС |  |
ОГ (> 170 вредных компоненто в ) |
нетоксичные
В качестве традиционных видов топлив в автомобилях используют бензины, дизельное топливо, природный сжатый газ.
Бензины – углеводородные фракции нефти, выделяемые при атмосферной перегонке нефти, представляющие собой низкокипящую бензиновую фракцию (35 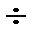 100 °С), состоящую из предельных, циклических и ароматических углеводородов (С5 –С8 ) и лигроин (С8 –С12 , с температурой кипения 80
100 °С), состоящую из предельных, циклических и ароматических углеводородов (С5 –С8 ) и лигроин (С8 –С12 , с температурой кипения 80 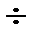 180 °С).
180 °С).
Бензины прямой перегонки не являются готовым топливом для двигателей внутреннего сгорания. Кондиционные качества ему придают путем облагораживания добавками соответствующих компонентов в результате крекинга, гидрокрекинга и риформинга.
Крекинг – это высокотемпературная переработка нефтяных фракций с целью получения более низкомолекулярных продуктов.
термический
При крекинге наряду с предельными углеводородами образуются и непредельные с двойной связь. Например,
| С 10 Н22 | → | С 5 Н12 | + | С 5 Н10 . |
Пентан (С 5 Н12 ) и пентен (С5 Н10 ) могут разлагаться дальше. Разложение углеводородов идет через образование свободных радикалов – частиц с неспаренными электронами:
СН 3 –СН2 –СН2 –СН2 –СН3 → СН3 –СН2 –  Н2 +
Н2 + 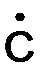 Н2 –СН3 .
Н2 –СН3 .
Частицы с неспаренными электронами недолговечны, они должны стабилизироваться:
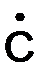 Н2 –СН3 → Н2 С = СН2 +
Н2 –СН3 → Н2 С = СН2 + 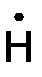 ;
;
СН 3 –СН2 – 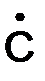 Н2 +
Н2 + 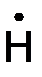 → СН3 –СН2 –СН3 .
→ СН3 –СН2 –СН3 .
Топлива, полученные при крекинге, содержат в себе значительное количество непредельных углеводородов. Непредельные углеводороды оказывают неоднозначное влияние на качество топлива: с одной стороны, повышают октановые числа, а с другой – вызывают его осмоление в результате окисления неустойчивой двойной связи. Поэтому продукты крекинга подвергаются облагораживанию на различных катализаторах.
Риформинг
| бензин (фракция перегонки нефти) ОЧ = 30 — 45 | + Н 2 | 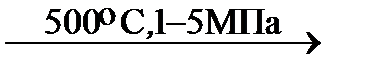 катализатор MoO3 , CoO, Cr2 O3 катализатор MoO3 , CoO, Cr2 O3 |
риформинг- бензин ОЧ = 85 – 95 |
Эксплуатационные свойства бензина
Теплота сгорания
Для углеводородов существует зависимость теплоты сгорания от соотношения углерод/водород. Чем больше это соотношение в углеводородах, тем ниже его высшая теплота сгорания.
Наибольшей высшей теплотой сгорания обладают парафиновые углеводороды. Их теплота сгорания с увеличением молекулярной массы понижается. Ароматические углеводороды имеют самую низкую высшую теплоту сгорания, повышающуюся с увеличением его молекулярной массы.
Изомерное строение углеводородов не оказывает существенного влияния на их теплоту сгорания.
Фракционный состав
Бензин, используемый в качестве топлива, включает следующие фракции перегонки нефти: бензины риформинга; бензины каталитического крекинга; бензины гидрокрекинга.
Детонационная стойкость .
Устойчивость к детонации определяется химическим составом топлива. Наличие в топливе ароматических углеводородов или предельных углеводородов разветвленного строения, имеющих большое число коротких боковых цепей, снижает детонационную способность топливовоздушной смеси.
Октановое число (ОЧ) численно равно содержанию (в объемн. %) изооктана (С8 Н18 , ОЧ=100) в его эталонной смеси с н-гептаном (С7 Н16 , ОЧ = 0), при котором эта смесь имеет равные с испытуемым топливом антидетонационные свойства.
Наименьшим октановым числом
Таблица 3
| Вещество | Формула | ОЧ |
| н-гептан | СН 3 –(СН2 )5 –СН3 | |
| н-гексан | СН 3 –(СН2 )4 –СН3 | |
| гексен-1 | СН 3 –(СН2 )3 –СН=СН2 | |
| циклогексан | С 6 Н12 | |
| изопентан | СН 3 –СН2 –СН(СН3 )2 | |
| изооктан | СН 3 -С(СН3 )2 СН2 СН(СН3 )2 | |
| бензол | С 6 Н6 |
При полном сгорании топлива образуются СО 2 и Н2 О. Но в зависимости от вида топлива и направления процесса окисления при сгорании образуются органические гидроперекиси (R–O–O–H), органические перекиси R–O–O–R и гидроперекиси кислот (R–CO–O–O–H).
Гидроперекиси в зависимости от строения углеводородного радикала разлагаются с образованием радикалов H–O–O — , а также спиртов, альдегидов и кетонов.
Цепной характер реакции может вызывать микровзрывы (детонацию).
Для их предупреждения в топливо вводят антидетонаторы, на которых происходит обрыв цепи. В качестве антидетонаторов обычно используется тетраэтилсвинец, или ТЭС Pb(C 2 H5 )4 . При 200о С происходит разложение Pb(C2 H5 )4 c образованием свинца, который затем окисляется до диоксида свинца:
Pb(C 2 H5 )4 → Pb + 4 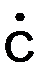 2 H5 ;
2 H5 ;
Pb + O 2 → PbO2 .
Диоксид свинца разрушает перекисные соединения, образуя малоактивные продукты окисления углеводородов (спирты, альдегиды, кислоты) и оксид свинца, который окисляется до PbO 2 , например:
| RCH 2 OOH | PbO 2 | RCHO | + | PbO | + | H 2 O | + | 1/2O 2 . |
Тетраэтилсвинец представляет собой металлоорганическое соединение. Это тяжелая ( 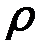 =1,652 г/см3 ) ядовитая жидкость (ПДК 0,005 мг/м3 ), легко растворяющаяся во всех нефтепродуктах и не растворимая в воде, температура кипения 200 о С. ТЭС добавляют в бензины в составе этиловой жидкости, содержащей галогенопроизводные углеводородов, например, бромистый этил C2 H5 Br. Такие галогенпроизводные углеводородов называют «выносителями». При сгорании они образуют со свинцом и его окислами летучие соединения, которые имеют более высокое давление насыщенных паров, не конденсируются на деталях двигателей внутреннего сгорания и выносятся из него в парообразном состоянии.
=1,652 г/см3 ) ядовитая жидкость (ПДК 0,005 мг/м3 ), легко растворяющаяся во всех нефтепродуктах и не растворимая в воде, температура кипения 200 о С. ТЭС добавляют в бензины в составе этиловой жидкости, содержащей галогенопроизводные углеводородов, например, бромистый этил C2 H5 Br. Такие галогенпроизводные углеводородов называют «выносителями». При сгорании они образуют со свинцом и его окислами летучие соединения, которые имеют более высокое давление насыщенных паров, не конденсируются на деталях двигателей внутреннего сгорания и выносятся из него в парообразном состоянии.
Все бензины ядовиты (ПДК 0,1–0,3 г/м 3 ), особенно этилированные.
В качестве антидетонаторов используются также менее токсичные вещества – этиловый спирт (С 2 Н5 ОН), тетраметилсвинец Pb(CH3 )4 . Использование этилового спирта может привести к расслоению его смесей с бензином, поэтому в этом случае необходим стабилизатор. Тетраметилсвинец имеет более низкую температуру кипения (110 о С) и более высокое давление насыщенных паров, что способствует равномерному распределению его по цилиндрам двигателя.
Перспективным антидетонатором является пентакарбонил марганца Mn(CO) 5 .
В качестве высокооктановой добавки может быть применен метилтретбутиловый эфир (МТБЭ) СН 3 –О–С4 Н9 . Он не ядовит, отличается более высокой теплотой сгорания, хорошо смешивается с бензином в любых соотношениях, не агрессивен к конструкционным материалам.
Химическая и физическая стабильность.
Химическая стабильность – способность топлива сохранять без изменения свой химический состав. Концентрация фактических смол является показателем уровня химической стабильности. Такие отрицательные явления, как окисление, осмоление обусловливаются недостатком химической стабильности топлива. Для повышения химической стабильности в бензины вводят ингибиторы (антиокислительные присадки), например древесно-смоляной антиокислитель ДСА (0,05 – 0,15%), синтетический ингибитор – ионол (0,03 – 0,1%).
