Во все времена химия служит человеку в его практической деятельности. Еще в древности возникли ремесла, в основе которых лежали химические процессы: получение металлов, свекла, керамики, красителей.
Большую роль играет химия в современной промышленности.
Химическая и нефтехимическая промышленность являются важнейшими отраслями, без которых невозможно функционирование экономики.
В настоящее время в химическую промышленность входит много отраслей, которые производят десятки тысяч видов продукции. Уровень их развития сильно различается. По производству серной кислоты Россия занимает второе место в мире, по выпуску минеральных удобрений — пятое, синтетических смол — четырнадцатое. Среди важнейших продуктов следует назвать кислоты, щелочи, соли, минеральные удобрения, растворители, масла, пластмассы, каучуки и резины, синтетические волокна и многое другое. Особенность химической промышленности — очень широкая, разнообразная по составу сырьевая база.
Химическая и нефтехимическая промышленность — прогрессивная, быстро развивающаяся отрасль.
Место химической индустрии в развитии экономики страны определяется её важной ролью как одного из крупных базовых комплексов народного хозяйства России, который обеспечивает многие отрасли промышленности и сельское хозяйство сырьем, социально-ориентированной продукцией, способствует формированию прогрессивной структуры производства и потребления, развитию новейших отраслей и направлений, обеспечивает экономию и сохранение жизненно важных ресурсов, повышение производительности труда в смежных отраслях.
Все большее значение приобретает использование химических технологий и методов при очистке и обезвреживании жидких и газообразных сред в различных отраслях, переработке и утилизации отходов.
Химическая промышленность, наряду с машиностроением и электроэнергетикой, влияет на развитие НТР в стране путём химизации её хозяйства. Химизация — широкое применение химических технологий и материалов во всех хозяйственных отраслях. Значение химизации определяется рядом особенностей химической промышленности, которые влияют и на размещение её предприятий.
Во-первых, она создаёт новые материалы, которых нет в природе. По своим качествам они часто превосходят натуральные продукты. Их применение экономит труд людей и сырьё. Поэтому предприятия хим. промышленности часто создают в уже сложившихся районах, центрах производства и потребления традиционных
Особенности размещения отрасли народного хозяйства в регионе ...
... федеральных округах. Целью данной работы является выявление особенностей размещения такой отрасли народного хозяйства, как сельское хозяйство, на примере Пензенской области. Для достижения поставленной цели в ходе работы решались следующие ... (продукты питания) и дает основную массу сырья для легкой и пищевой промышленности, но и потому, что оказывает влияние на уровень и темпы развития тяжелой ...
Во-вторых, у химической промышленности почти неограниченная сырьевая база: нефть, газ, древесина, вода, воздух и т.д. При этом очень часто один и тот же продукт можно получать из разных видов сырья. Например, азотные удобрения можно производить на основе коксования угля, электролиза воды, переработки нефти и природного газа. Поэтому теоретически предприятия химической промышленности можно создать повсеместно. Но на сегодняшний день в основном используются продукты нефте- и газопереработки, т.е. специально подготовленное сырьё.
В результате современная химия в значительной мере тяготеет к районам добычи и переработки этих видов сырья.
В-третьих, химические технологии очень разнообразны. Это открывает огромные возможности для комплексной переработки сырья. Так, например, из нефти получают сотни видов продукции. Поэтому и в самой химической промышленности, и при её взаимодействии с другими отраслями широко развито комбинирование. Оно способствует формированию разнообразных комбинатов: химических, коксохимических, нефтехимических, лесохимических и др.
СПЕЦИАЛЬНАЯ ЧАСТЬ. ТЕОРИТИЧЕСКИЕ ВОПРОСЫ
Значение воды для химической промышленности
Подготовка воды для производственных процессов. Очистка сточных вод
Общее количество воды на Земле составляет 1,4·10 18 тонн. Большая часть этой воды находится в постоянном кругообороте под воздействием тепловой энергии солнца и теплоты земных недр. Природная вода подразделяется на атмосферную, поверхностные воды, подземные воды и морскую (океанскую) воду.
Атмосферная вода, выпадающая в виде дождя и снега, содержит минимальное количество примесей, главным образом, в виде растворенных газов (кислорода, оксида углерода (II), азота, сероводорода), бактерий, а в промышленных районах также оксиды азота и серы и различные органические вещества.
Поверхностные воды представляют воды открытых водоемов: рек, озер, каналов, водохранилищ. В состав поверхностных вод входят различные минеральные и органические вещества, природа и концентрация которых зависят от климатических, геоморфологических, почвенно-геологических условий, а также от агро- и гидротехнических мероприятий, развития промышленности в регионе и других факторов.
Подземные воды — воды артезианских скважин, колодцев, ключей и гейзеров. Для них характерно высокое содержание минеральных солей, выщелачиваемых из почвы и осадочных пород, и малое содержание органических веществ.
Морская вода представляет многокомпонентный раствор электролитов и содержит практически все элементы, входящие в состав литосферы. В ней растворены также различные газы.
В зависимости от солесодержания природные воды делятся на:
Пресные (содержание солей менее 1 г/кг), солоноватые (содержание солей 1-10 г/кг), Из общего объема гидросферы планеты запасы пресных вод составляют всего 0,03%, при этом источниками промышленного водоснабжения становятся, преимущественно, только речные воды, что связано со значительной протяженностью их береговой линии.
В настоящее время на промышленные цели в РФ расходуется до 9% общего стока пресной воды, что составляет 700 куб. км в год.
Соленые (содержание солей более 10 г/кг).
Воды морей и океанов являются источниками сырья для добычи многих химических веществ. В промышленных масштабах из них извлекаются хлориды натрия и магния, бром, йод и другие продукты. В настоящее время их рассматривают и как потенциальные источники получения многих других элементов.
Жиры как продукт питания и химическое сырье
... очень часто используют в пищевой промышленности. жир органический продукт Таким образом область применения жиров досточна широка. И целью нашей работы является изучение особенностей использования жиров в качестве химического сырья и в качестве продукта питания. ...
Химическая промышленность — один из крупнейших потребителей воды
Расход воды в химических производствах очень велик. На отдельных химических предприятиях потребление воды достигает 1 млн. м 3 в сутки. Вода используется почти во всех химических производствах для разнообразных целей.
Вода расходуется на промывку, охлаждение агрегатов, разбавление сточных промышленных вод. По суммарному водопотреблению химическая промышленность занимает первое место среди отраслей обрабатывающей промышленности.
Превращение воды в один из важнейших элементов химического производства объясняется:
- наличием комплекса ценных свойств (высокая теплоемкость, малая вязкость, низкая температура кипения и др.);
- доступностью и дешевизной (затраты исключительно на извлечение и очистку);
- нетоксичностью;
- удобством использования в производстве и транспортировки.
В химической промышленности вода используется в следующих направлениях:
- Для технологических целей в качестве:
- растворителя твердых, жидких и газообразных веществ;
- среды для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы и др.);
- промывной жидкости для газов;
- экстрагента и абсорбента различных веществ.
- Как теплоноситель — в виде горячей воды и пара и хладоагента для обогрева и охлаждения аппаратуры.
- В качестве сырья и реагента для производства различной химической продукции (например, водорода, ацетилена, серной и азотной кислот и др.)
ПОДГОТОВКА ВОДЫ ДЛЯ ПРОИЗВОДСТВЕННЫХ ПРОЦЕССОВ
Масштабы потребления воды химической промышленностью зависят от типа производства и колеблются в широких пределах. Так, расходные коэффициенты по воде (в м 3 на тонну продукции) составляют: для азотной кислоты 200, вискозного волокна 1200, аммиака 1500, синтетического каучука 1600, капронового волокна 2500.
Например, завод капронового волокна расходует такое же количество воды как город с населением 120000 человек, а специализированный завод пластических масс по потреблению воды эквивалентен городу с населением 400000 человек.
Водооборотные циклы технологических установок, цехов и химических предприятий в целом являются важнейшим фактором рационального использования водных ресурсов. В этих циклах осуществляется многократное использование воды без выброса загрязненных стоков в водоемы, а потребление свежей воды для ее восполнения ограничено только технологическими превращениями (в качестве компонента сырья) и естественными потерями.
В химических производствах используют три схемы водооборота в зависимости от тех изменений, которые претерпевает вода в процессе производства:
- вода только нагревается и должна быть перед возвратом охлаждена в градирнях или бассейнах;
- вода только загрязняется и должна быть перед возвратом очищена в специальных очистных сооружениях;
- вода нагревается и загрязняется. Этот тип водооборота представляет комбинацию водооборотов первого и второго типов.
Вода, используемая в химической промышленности (технологическая вода) должна удовлетворять по качеству определенным требованиям того или иного производства.
Современные методы очистки сточных вод от ионов тяжелых металлов
... кислотно-щелочных сточных вод, содержащих смесь металлов, не всегда удается выдержать оптимальные условия осаждения и, соответственно, достичь необходимой степени очистки /11, 13/. Более глубокая очистка от ионов тяжелых металлов достигается при использовании ...
Качество воды определяется совокупностью ее физических и химических характеристик, к которым относятся: цвет, прозрачность, запах, общее солесодержание, жесткость, окисляемость, реакция (рН), которые зависят от содержания в воде различных примесей.
Для промышленных вод важнейшими из этих характеристик являются:
ЖЕСТКОСТЬЮ называется свойство воды, обусловленное присутствием в ней солей кальция и магния. В зависимости от природы анионов различают временную (устранимую, карбонатную) жесткость, зависящую от наличия в воде гидрокарбонат-ионов НСО 3 — , Жв , и постоянную (некарбонатную) жесткость, вызываемую присутствием хлорид-ионов Cl— , нитрат-ионов NO3 — и сульфат-ионов SO4 -2 , Жп . Сумма временной и постоянной жесткости называется общей жесткостью воды:
Ж о = Жв + Жп
Жесткость воды выражается суммой концентраций ионов кальция и магния, содержащихся в 1 литре воды, то есть в ммоль/л. По значению общей жесткости воды делятся на мягкую (Ж о менее 2), средней жесткости (Жо = 2 — 10) и жесткую (Жо более 10).
Вредное влияние примесей, содержащихся в промышленной воде, зависит от их химической природы, концентрации, дисперсного состояния, а также технологии конкретного производства, использующего воду. Все вещества, присутствующие в воде, могут находиться в виде истинного раствора (соли, газы, некоторые органические соединения, в коллоидном состоянии (алюмо- и железосиликаты, некоторые гидроксиды, кремневая кислота, органические соединения типа лигнина и др.) и во взвешенном состоянии (глинистые, песчаные и известковые частицы).
Растворенные в воде вещества образуют при нагреве накипь на стенках аппаратуры и вызывают коррозионное разрушение ее.
Коллоидные примеси вызывают загрязнение диафрагм электролизеров, вспенивание воды.
Грубодисперсные взвеси засоряют трубопроводы, снижая их производительность, могут вызвать их закупорку.
Все это вызывает необходимость предварительной подготовки воды, поступающей на производство — водоподготовки.
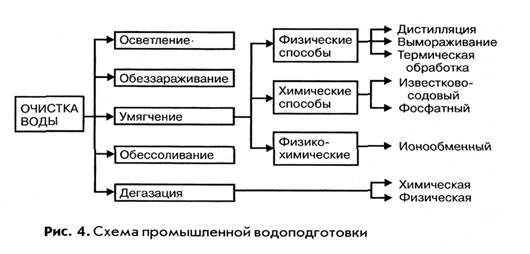
ВОДОПОДГОТОВКОЙ называют комплекс операций по удалению из природной воды вредных для производства примесей, содержащихся в ней в виде взвесей, коллоидных частиц, растворенных солей и газов. В водоподготовку входят: операции осветления, умягчения, дегазации, а в отдельных случаях обессоливания и для питьевой воды обеззараживания.
ОСВЕТЛЕНИЕ воды достигается отстаиванием ее с последующим фильтрованием через зернистый материал различной дисперсности. Для коагуляции коллоидных примесей и абсорбции окрашенных веществ, содержащихся в воде, к ней добавляют электролиты — сульфаты алюминия и железа.
ОБЕЗЗАРАЖИВАНИЕ воды обеспечивается ее хлорированием или озонированием.
ДЕГАЗАЦИЯ — удаление из воды растворенных газов достигается химическим способом, при котором газы поглощаются химическими реагентами.
ОБЕССОЛИВАНИЕ применяется в тех производствах, где к воде предъявляются особо жесткие требования по чистоте, например, при получении полупроводниковых материалов, химически чистых реактивов, фармацевтических препаратов. Обессоливание воды достигается методом ионного обмена, дистилляцией и электродиализом.
МЕТОД ИОННОГО ОБМЕНА основан на свойстве некоторых твердых тел (ионитов) поглощать из раствора ионы в обмен на эквивалентное количество других ионов того же знака. Иониты подразделяются на катиониты и аниониты. Катиониты содержат подвижные катионы натрия или водорода, а аниониты подвижные ионы гидроксила. В качестве катионитов применяют сульфоугли, алюмосиликаты (пермутит, цеолит и др.), в качестве анионитов искусственные смолы, например карбамидные.
Соответственно, процессы ионного обмена подразделяются на Н (Na) — катионирование, например:
2 [Кат] + Ca(HCO3 )2 Ca[Кат] + 2Na«2 CO3
и анионирование, например:
Ан[Cl] + H«Ан[OH] + HCl 2 O,
где: [Кат] и [Ан] — не участвующая в обмене матрица ионита.
Поскольку процесс ионного обмена обратим, установление равновесия в системе означает прекращение процесса обессоливания. При насыщении ионита он может быть регенерирован промывкой растворами для Н катионитов кислоты, Na катионитов хлорида натрия и для анионитов раствором щелочи.
Полное обессоливание воды обеспечивается ее дистилляцией (термическое обессоливание) обычно после того, как вода предварительно очищена с помощью ионитовых фильтров.
Вода последовательно проходит через катионитный и анионитный фильтры и поступает, распыляясь в дегазатор, где из нее удаляются растворенные диоксид углерода, кислород и другие газы.
Для регенерации катионита в фильтр периодически подается кислота или раствор хлорида натрия, для регенерации анионита — раствор щелочи.
Одной из основных и обязательных операций водоподготовки технологической воды является ее умягчение.
УМЯГЧЕНИЕМ называется обработка воды для понижения ее жесткости, то есть уменьшения концентрации ионов Ca +2 и Mg+2 различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в их карбонаты, выпадающие в осадок: Ca(HCO 3 )2 = CaCO3 + H2 O + CO2 — этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и известково-содовый, заключающийся в обработке воды тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
CaSO 4 + 2Na3 PO4 = 3Na2 SO4 + Ca3 (PO4 )2
Во втором случае протекают две реакции. Гидрокарбонаты кальция и магния реагируют с гидроксидом кальция, чем устраняется временная жесткость:
(HCO 3 )2 + Ca(OH)2 = 2CaCO3 + 2H2 O,
а сульфаты, нитраты и хлориды — с карбонатом натрия, чем устраняется постоянная жесткость:
4 + Na2 CO3 = CaCO3 + Na2 SO4
Водоподготовка в химическом производстве представляет весьма трудоемкий процесс и требует больших капитальных и эксплуатационных затрат. На современных химических предприятиях доля капитальных затрат на водоподготовку составляет 10 — 15% общего объема расходов на производство химической продукции.
Следовательно, размещать водоёмкие производства целесообразно в районах с благоприятным водным балансом, у источников воды.
ОЧИСТКА СТОЧНЫХ ВОД
Особенностью экологического воздействия предприятий химического комплекса является многообразие источников и видов выделяющихся вредных веществ. Ряд загрязняющих веществ выбрасывается в атмосферный воздух или сбрасывается в природные водоемы в относительно небольших по массе количествах, но характеризуется высокой токсичностью.
Потребляя 1/ 10 всех основных источников энергии, по водоёмкости химическая промышленность уступает только электроэнергетике, но в отличие от последней значительная часть воды используется в технологических процессах, а это приводит к значительному загрязнению воды и требует расходов на очистку сточных вод.
Сточные воды — любые воды <#»700641.files/image002.jpg»>
Танк-отстойник первичной очистки
В последнее время мембранная технология <#»700641.files/image003.jpg»>
Соотношение между энергией активации (![]() ) и энтальпией (энтропией) реакции (ΔH) при наличии и при отсутствии катализатора. Наивысшая точка энергии представляет собой энергетический барьер. В присутствии катализатора энергии, которая необходима для начала реакции, требуется меньше.
) и энтальпией (энтропией) реакции (ΔH) при наличии и при отсутствии катализатора. Наивысшая точка энергии представляет собой энергетический барьер. В присутствии катализатора энергии, которая необходима для начала реакции, требуется меньше.
Энергия активации E каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора. Например, для некаталитического разложения NH3 на N2 + Н2 E ~ 320 кДж/моль, для того же разложения в присутствии Pt Е ~ 150 кДж/моль.
Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия <#»700641.files/image005.jpg»> <#»700641.files/image006.gif»>. На ns-орбитали содержится один или два электрона <#»700641.files/image007.gif»>
- орбитали. Поскольку числовалентных электронов <#»700641.files/image008.jpg»>
Аминокислоты <#»700641.files/image010.gif»>
Находим малярную массу (М) элементов уравнения:
М: H 2 S = 1*2 + 32 = 34 у.е.
М: 0 2 = 1,5*(16*2) = 1,5*36 = 48 у.е.
М: S0 2 = 32 + 16*2 = 32 + 32 = 64 у.е.
М: H 2 O = 1*2 + 16 = 18 у.е.
1. Начинаем с печки
0 2 = ½ 02 → S03 — 20т/ч — производительность
М: S0 3 = 32 + 16*3 = 32 + 48 = 80 у.е.
S0 3 + H2 O → H2 SO4
М: H 2 SO4 = 1*2 + 32 + 16*4 = 98 у.е.
2. Определяем S0 3 ;
- у.е. S0 3 образует 98 у.е. H2 SO4 , как Х тонн образует 20 т ⇒
Х = (80*20) / 98 = 1600/98 = 16,33 т.
S0 3 = 16,33 т.
- Определяем S0 2 ;
- у.е. S0 2 образует 80 у.е. SO3 , как Х тонн образует 16,33 т ⇒
Х = (64*16,33) / 80 = 1045,12/80 = 13,1 т.
S0 2 = 13,1 т.
2. Определяем H 2 S;
- у.е. H 2 S образует 64 у.е. SO2 , как Х тонн образует 13,1 т ⇒
Х = (34*13,1) / 64 = 445,4/64 = 6,96 т.
H 2 S = 6,96 т.
3. Определяем H 2 O;
- Х = (18*6,96) /34 = 125,28/34 = 3,68 т.
H 2 O = 3,68 т.
4. Определяем 0 2 ;
- у.е. H 2 S взаимодействуют с 48 у.е. 02 как 6,96 с Х ⇒
Х = (6.96*48) /34 = 334,08/34 = 9,82 т.
2 = 9,82 т.
- Определяем количество азота 2 S = 6,96 т → 92%
⇒ Х = (6,96*8) / 92 = 55,92 / 92 = 0,61 т.
Х → 8%
Так как Х составляет N 2 — 4% и H2 O = 4%, тогда N2 = 0,61 / 2 = 0,3 т.
- Так как воздух содержит 79 % азота (N 2 ) и 21% кислорода (02 )
,82 т. составляют 21% кислорода (0 2 )
⇒ N 2 = (9,82*79) / 21 = 775,78 / 21 = 36,94 т.
Х т. составляют 79 % азота (N 2 )
- Составляем таблицу материального баланса.
6,96т. 9,82т. 13,1т. 3,68т.
2 S + 1,502 = S02 + H2 O
М: 34. М: 48. М: 64. М: 18
|
ПРИХОД |
РАСХОД |
||
|
Наименование вещества |
Масса (т.) |
Наименование вещества |
Масса (т.) |
|
H 2 S |
6,96 |
S0 2 |
13,1 |
|
N 2 |
0,3 |
H 2 O |
3,68 |
|
H 2 O |
0,3 |
N 2 |
0,3 |
|
0 2 |
9,82 |
H 2 O |
0,3 |
|
N 2 |
36,94 |
N 2 |
36,94 |
|
ИТОГО |
54,32 |
54,32 |
|
ЗАДАЧА № 36
Составить материальный баланс печи для сжигания серы производительностью 75 т в сутки.
Степень окисления серы 0,97 (остальная сера возгоняется и сгорает вне печи).
Коэффициент избытка воздуха равен α = 1,5.
Расчет вести по сжигаемой сере в кг/ч.
Состава сухого воздуха (% вес): N 2 — 77; O2 — 23.
Коэффициент избытка воздуха характеризует отношение практически подаваемого в печь воздуха к теоретически необходимому согласно уравнению реакции.
Решение
- Процесс горения серы описывается уравнением реакции
+О 2 =SО2
- Производительность печи
т/сутки /24 час/сутки = 3,125 т/ч = 3 125 кг/ч серы.
- Количество окисленной до SО 2 серы
125 * 0.95 = 2968.75 кг
- В печи газообразная сера занимает объем
75 кг /32 кг/кмоль *22.4 м 3 /кмоль = 2078.125 м3
5. Осталось в виде паров неокисленной серы
125 — 2968.75 = 156.25 кг
или
25 кг/32 кг/кмоль * 22.4 м 3 /кмоль = 109.375 м3
- Израсходовано кислорода на окисление О2 = 2 968.75 кг/32 кг/кмоль * 22.4 м3 /кмоль = 2 078.125 м3
7. Подано в печь с учетом коэффициента избытка α = 1.5
2 078.125 * 1.5 = 3 117.1875 м 3
или
- С кислородом поступает азот — балласт процесса —
125 кг /23% * 77% = 14 908.288 кг N2 = 14 908.288 кг / 28 кг/кмоль * 22.4 м3 /кмоль = 11 926.6304 м3
- Образовалось в результате реакции диоксида серы
75 * 64/32 = 5937.5 кг
или SО2 = 5937.5 кг / 64 кг/кмоль * 22.4 м3 /кмоль = 2078.125 м3
10. Осталось неизрасходованного кислорода
117.1875 м 3 — 2 078.125 м3 = 1039.0625 м3
или 1039.0625 м 3 /22.4 м3 /кмоль * 32 кг/кмоль = 1484.375 кг
- Полученные данные сводим в таблицу
Материальный баланс процесса
|
Приход |
кг |
% |
Расход |
кг |
% |
|
Исходное вещество |
Продукт |
||||
|
Сера |
3 125,000 |
13.9 |
Сера |
156,250 |
0.7 |
|
Оксид серы |
5 937,500 |
26.4 |
|||
|
Воздух, в т.ч. |
Воздух, в т.ч. |
||||
|
— кислород |
4 453.125 |
19.8 |
— кислород |
1 484,375 |
6.6 |
|
— азот |
14 908.288 |
66.3 |
— азот |
14 908,288 |
66.3 |
|
ИТОГО |
22 486,413 |
100.0 % |
ИТОГО |
22 486,413 |
100.0 % |
ЗАКЛЮЧЕНИЕ
Химический комплекс является стратегической составляющей промышленности России, имеет огромное общехозяйственное и оборонное значение для развития экономики страны. Он включает в себя 15 крупных подотраслей, специализирующихся на выпуске разнообразной химической продукции).
В химической и нефтехимической промышленности насчитывается около 760 крупных и средних предприятий, более 100 научных и проектно-конструкторских организаций. В отрасли работают более 770 тысяч человек. На функционирование химического комплекса значительное влияние оказывают вертикально интегрированные структуры (РАО «Газпром», ОАО «АК «Сибур», ЗАО «Лукойл-Нефтехим», ООО «Амтел» и др.), которые производят значительную часть внутреннего валового продукта. Эти корпорации также располагают возможностями для осуществления технологических процессов от сырья до выпуска конечной наукоемкой продукции и занимают лидирующее положение на рынке химикатов России
Ведущая роль химического комплекса остается непреложным фактом. Сегодня в химической и нефтехимической промышленности сосредоточено около 4,7% основных производственных фондов. Доля химического комплекса в общем объеме промышленного производства составляет 4,5%, доля валютных поступлений от российского экспорта — 4,8 процентов.
Мощный производственный и научно-технический потенциал позволяет российским предприятиям производить около 2% мирового объема химической продукции. По отдельным ее видам, например, по выпуску аммиака и карбамида, российские компании контролируют 15% мирового рынка, а также треть международной торговли этими продуктами.
В настоящее время наметился новый подъем отрасли. За последние пять лет объем производства химической продукции увеличился в 1,6 раза. Рост производства в 2013 году составил 104,4% к уровню 2012 года. Необходимо иметь в виду, что положительная динамика производства продукции в последние годы обеспечивалась за счет перемещения платежеспособного спроса внутреннего рынка с импортной химической продукции на отечественную и в целом благоприятной внешнеэкономической конъюнктурой на основные экспортные товары химического комплекса.
В то же время уже имеет место тенденция замедления темпов роста и снижения рентабельности производства.
Несмотря на имеющиеся факторы, сдерживающие стабильное развитие химической и нефтехимической промышленности, в стране существует ряд преимуществ для развития данного сектора в будущем.
Во-первых, Российская Федерация обладает достаточно мощной сырьевой базой. Например, по разведанным запасам и добыче природного газа Россия стоит на первом месте в мире, по разведанным запасам и добыче нефти — на втором.
Во-вторых, наличие быстро развивающегося внутреннего рынка и потенциала спроса на продукцию химического комплекса. Потребление химикатов в России будет постоянно увеличиваться.
В-третьих, наличие недорогой и квалифицированной рабочей силы
СПИСОК ЛИТЕРАТУРЫ
[Электронный ресурс]//URL: https://inzhpro.ru/kontrolnaya/tehnologii-himicheskoy-promyishlennosti/
1. Водоподготовка, Под.ред. О.И. Мартыновой. — М.: Атомиздат, 1977.
- В. В. Курилкин основы химической технологии
- Комплексное использование сырья и отходов.
Под. ред Б.М. Равича. — М.: 1988.
- Гарин В. М., Клёнова И. А., Колесников В. И. Экология для технических вузов 5. Серия «Высшее образование». Под ред. В. М. Гарина. Ростов н/Д:Феникс, 2003.
- Попов А.
М., Румянцев И. С. Природоохранные сооружения. — М.: Колос,
- Боресков Г. К. Катализ. Вопросы теории и практики. — Новосибирск, 1987.
- Гейтс Б.
Химия каталитических процессов / Б. Гейтс, Дж. Кетцир.
- Колесников И. М. Катализ и производство катализаторов. — М.: Техника,.
- Шуйт Г.
— М.: Мир, 1981. — 551 с.
11. Яблонский Г. С., Быков В. И., Горбань А. Н. Кинетические модели каталитических реакций. — Новосибирск: Наука (Сиб. отделение), 1983. — 255 c.
