Проблема коррозии является одной из важнейших в промышленности, транспорте и сельском хозяйстве, так как суммарные потери составляют в странах с развитой экономиках 2-4 % совокупного национального продукта и сопоставимы с затратами в крупных отраслях хозяйства. В настоящее время созданы национальные центры и институты по коррозии, действует сеть лабораторий, испытательных станций, противокоррозионных служб и сервисных центров. Успехи науки о химическом сопротивлении металлических материалов обеспечиваются совместными усилиями ученых коррозионистов, материаловедов, металлургов, химиков. Защита металлов от коррозии стала важнейшим элементом современной технологии, а учение о химсопрамате материалов — существенной составляющей материаловедения и физической химии. Наука о коррозии и противокоррозионной защите занимает важное место среди разделов физикохимии, использующих электрохимический подход. В процессе коррозии поверхность металла является катализатором окислительно-востановительных превращений компонентов жидкой и газовой фаз, как это имеет место гетерогенном катализе, но сама служит участником реакций. Поэтому большую роль играют степень гетерогенности металлической поверхности, её фазовый состав, поликристалличность и взаимное влияние структурных составляющих материала.
Ситуация осложняется изменением во времени электродного потенциала и поверхностных слоёв коррозирующего металла и среды. Поэтому научной основой коррозиологии является электрохимия растворяющихся металлических поверхностей. Исходя из этого, коррозия трактуется как переход компонентов металлического материала из его собственной системы связей в состояние связи с компонентами среды. Химическое или электрохимическое взаимодействие металла и среды изменяет его свойства и нарушает его функции. Коррозия характеризуется скоростью воображаемого непрерывного движения точки фронта коррозии, то есть границы раздела между металлом и средой, в том числе продуктами коррозии. Техническая скорость коррозии как характеристика коррозионной стойкости — это наибольший показатель коррозии, вероятностью превышения которого нельзя пренебречь. Существуют следующие показатели коррозии: массовый (г/м2 с), линейный 9мм/год), объёмный (м/с), токовый (А/м2), а также время до появления первого очага коррозии, доля поверхности, занятая продуктами коррозии, количество точек или язв на единице поверхности и др.
Коррозия классифицируется по характеру поражения металла: сплошная или общая (равномерная, неравномерная, избирательная, например, обесцинкование сплавов) и местная (пятнами, язвами, точечная или питтинг, сквозная, нитевидная, поверхностная, мелкокристаллитная, ножевая и д. р); по условиям протекания: газовая, в жидких металлах, в неэлектролитах (кислотная, щелочная, в нейтральных средах), атмосферная, почвенная, биокоррозия, электрокоррозия, под напряжением и при другом воздействии внешних факторов; по условиям контакта с агрессивной средой: при полном, неполном и периодическом погружении, струйная, щелевая.
Разработка ингибитора кислотной коррозии нелегированных сталей
... металлом и средой. Например, окисление железа в воздухе при высоких температурах (образование окалины). Электрохимическую коррозию характеризуют процессы, в которых наряду с разрушением металла в среде ... Алюминий обладает свойством образовывать на своей поверхности защитную пленку, даже при отсутствии окислителя, ... и легирующие компоненты марганца, кремния и другие, которые составляют в сумме менее ...
Следует рассматривать следующие аспекты коррозии: экономический (прямые и косвенные потери от коррозии и расходы на противокоррозионную защиту), экологический(изменение среды влияет на коррозионную стойкость, а коррозия может приводить к ухудшению экологической обстановки), технологический (создание новых технологий и получение сверхчистых материалов), биомедицинский (создание протезов), культурный (сохранение исторических памятников), стратегический(дефицит металлов).
1. Химическая коррозия. Жаростойкость. Жаропрочность
Химическая коррозия — это взаимодействие металла с коррозионной средой, при которой окисление металла и восстановление окислительного компонента коррозионной среды протекает в одном акте. Ее первопричиной является термодинамическая неустойчивость металлов в разных агрессивных средах.
Наиболее распространенным и практически важным видом химической коррозии металлов является газовая коррозия. Она протекает при многочисленных высокотемпературных технологических процессах получения и обработки металлов (выплавке и разливке металла, нагреве перед прокаткой, ковке, штамповке, термообработке и т.д.), работе оборудования в условиях влияния высоких температур (арматура нагревательных печей, детали двигателей внутреннего сгорания и т.д.).
Поведение металлов и сплавов в этих условиях оценивается двумя характеристиками: жаростойкостью и жаропрочностью.
Жаростойкость — это способность металла оказывать сопротивление коррозионному влиянию газов при высоких температурах.
Жаропрочность — способность металла сохранять при высоких температурах необходимые механические свойства: длительную прочность и сопротивление ползучести.
При коррозии в кислородсодержащих газах поверхность металла покрывается пленкой оксидов других соединений, от защитных свойств которой в значительной мере зависит жаростойкость металлов и сплавов.
Заметными защитными свойствами могут обладать лишь сплошные пленки. Возможность их образования определяется условием:
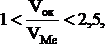 (1)
(1)
где Vок — молекулярный объем оксида или другого соединения; VМе — атомный объем металла, из которого образуется оксид или другое соединение.
Жаростойкость металлов и сплавов можно в значительной мере повысить легированием — введением в их состав компонентов, которые улучшают защитные свойства образующихся пленок. В результате этого на поверхности сплава образуется слой оксидов легирующего компонента или высокозащитных двойных оксидов легирующего компонента с основным металлом типа шпинели (FeCr2O4, NiFe2O4 и др.).
Тугоплавкие металлы и сплавы
... более высокую температуру плавления. Еще более эффективным оказывается механизм дисперсионного упрочнения в результате образования карбидов ZrC, TiC, (Ti, Zr)C. Тугоплавкие металлы и их сплавы широко используются ... для многих отраслей техники являются сплавы на основе Nb. Они обладают хорошей технологичностью, свариваемостью, высокой жаростойкостью до 1300°С. Температура хладноломкости Nb ниже - 196° ...
В установившемся режиме скорость химической коррозии определяется кинетическими возможностями протекания отдельных стадий процесса: кристаллохимическим превращением (кинетический контроль процесса); диффузией реагентов в образовавшейся пленке продуктов коррозии (диффузионный контроль процесса); обеими этими стадиями одновременно при соизмеримом сопротивлении их протеканию (диффузионно-кинетический контроль процесса).
При кинетическом контроле процесса (образование несплошных пористых пленок) жаростойкость определяется природой металла, а при диффузном контроле (образование сплошных оксидных пленок) — защитными свойствами пленки, которая образуется на металле.
Примером удачного сочетания обоих свойств являются сплавы никеля с хромом.
2. Жаростойкость. Теории легирования для повышения жаростойкости
Жаростойкость — способность металлов и сплавов сопротивляться окислению и газовой коррозии при высоких температурах. Жаростойкость зависит от многих внешних и внутренних факторов. В основном за жаростойкость отвечают поверхность металла и чистота ее обработки. Полированные поверхности окисляются медленнее, так как оксиды распределены равномерно и более прочно сцеплены с поверхностью металла. Формирующаяся на поверхности оксидная пленка достаточно хорошо защищает металл от дальнейшего окисления в том случае, если она плотная и не пропускает ионы кислорода, хорошо сцеплена с подложкой и не отслаивается при механических испытаниях. К металлам, которые образуют такие пленки, относятся хром и алюминий. Оксидные пленки типа шпинели Сг203 и А1203 хорошо защищают от окисления при высоких температурах. Если на поверхности образуется рыхлый оксид, как у магния, то он не стоек и не защищает металл от дальнейшего окисления.
Повышение жаростойкости сплавов достигается легированием элементами (хром, алюминий, кремний), образующими на поверхности непроницаемые для ионов основного металла и кислорода Оксидные пленки. Также для этих целей используются защитные покрытия, состав которых выбирается с учетом условий работы изделия и состава агрессивной среды. Структура жаростойкого материала должна быть однородной и однофазной (чистые металлы, твердые растворы).
Термическая обработка меняет строение сплавов и, следовательно, их коррозионную стойкость. Отжиг и нормализация приводят к формированию однофазной структуры и способствуют увеличению жаростойкости материала.
Пластическая деформация ухудшает жаростойкость, так как приводит к появлению градиента напряжений в структуре металла. Величина зерна для жаростойкого материала не существенна, поэтому эта характеристика является структурно нечувствительной.
Характеристики сплавов, стойких к коррозии при повышенных температурах, могут быть даны лишь к конкретным агрессивным средам и выбор материала решается с учетом условий работы данного изделия.
Во многих химических процессах металлические конструкции и изделия эксплуатируются в жестких условиях, при повышенных температурах, больших давлениях, высокой агрессивности среды.
Чистые металлы, как правило, являются коррозионностойкими и требуют дополнительных мер защиты.
Современная техника противокоррозионной защиты располагает рядом эффективных способов для увеличения стойкости металлов и сроков их эксплуатации. Применительно к условиям газовой коррозии одним из наиболее часто используемых способов является жаростойкое легирование с целью получения сплавов, обладающих повышенной коррозионной устойчивостью.
Применительно к условиям газовой коррозии одним из эффективных способов защиты металлов является легирование с целью получения сплавов жаростойких сплавов. В зависимости от предполагаемого действия легирующей добавки можно указать на три наиболее обоснованные теории такого легирования, которые не противоречат, а скорее дополняют друг друга.
1 Теория уменьшения дефектности образующегося оксида
Согласно теории, разработанной Вагнером и Хауфе, небольшая добавка легирующего элемента окисляется с образованием ионов определенной валентности и, растворяясь в оксиде основного металла, уменьшает в его кристаллической решетке концентрацию дефектов (межузельных катионов в оксидах с избытком металла или катионных вакансий в оксидах с недостатком металла).
Это приводит к упорядочению структуры и снижению скорости диффузии ионов в защитной пленке, уменьшая тем самым скорость окисления.
В соответствии с этой теорией к легирующему элементу Лэ предъявляются следующие требования:
- иметь большее сродство к кислороду, чем у основного металла, т.е. (Gт)ЛэО <
- (Gт)МеО;
- оксид легирующего элемента ЛэО должен растворяться в оксиде основного металла;
- при легировании металлов, образующих оксиды с избытком металла, валентность ионов легирующего элемента zЛэ должна удовлетворять неравенству zЛэ >z, гдеz — валентность ионов основного металла;
- при легировании металлов, образующих оксиды с недостатком металла, необходимо соблюдение неравенства zЛэ <z, а приzЛэ =zжелательно соблюдение неравенства радиусов ионов, т.е.rи.Лэ<rи.
Данная теория позволяет предсказать влияние низкого легирования различными элементами на жаростойкость основного металла.
Если скорость окисления металла определяется не диффузией ионов, а другими процессами, или при легировании в оксидной пленке образуется новая фаза, то изложенные выше принципы жаростойкого легирования неприменимы.
2 Теория образования защитного оксида легирующего элемента
Согласно теории, разработанной А.А. Смирновым, И.Д. Томашовым и др., на поверхности металла (сплава) образуется защитный оксид легирующего элемента, затрудняющий диффузию реагентов и окисление основного металла. Для этого легирующий элемент должен удовлетворять следующим требованиям:
- его оксид удовлетворяет условию сплошности: Voк/V Лэ ≥ 1;
- он имеет большее сродство к кислороду, чем основной металл: (Gт)ЛэО <
- (Gт)МеО;
- размер ионов легирующего элемента должен быть меньше размера иона основного металла, т.е. rи.Лэ <rи. Это облегчает диффузию легирующего элемента к поверхности сплава, на которой образуется защитный оксид;
- образуется оксид с высоким электросопротивлением, затрудняющим движение в нем ионов и электронов;
- оксиды легирующих элементов имеют высокие температуры плавления и возгонки и не образуют низкоплавких эвтектик. Это обеспечивает при высоких температурах сохранение оксида в твердой фазе. Переход оксида в жидкое состояние облегчает протекание диффузионных процессов, а частичная возгонка оксида увеличивает пористость пленки, что снижает ее защитные свойства;
- легирующий элемент и основной металл образуют твердый раствор, что обеспечивает образование сплошной пленки оксида легирующего элемента по всей поверхности сплава.
Рассмотренная теория легирования для повышения жаростойкости находится в хорошем соответствии с целым рядом практических данных по окислению сплавов и позволяет на основании некоторых свойств элементов и их оксидов качественно оценить пригодность различных элементов для среднего и высокого легирования металлов с целью повышения жаростойкости.
3 Теория образования высокозащитных двойных оксидов
Эта теория разработана В.И. Архаровым, П.Д. Данковым, И.И. Корниловым и др. наиболее полно для сплавов на основе железа. По этой теории оптимальными являются такие легирующие элементы, которые уменьшают возможность образования малозащитной вюститной фазы и благоприятствуют образованию двойных оксидов шпинельной структуры с малым параметром решетки: FeCr2O4, FeAl2O4, NiFe2O4, NiCr2O4 и др.
Даже при низком легировании хромом, кобальтом, кремнием и алюминием повышается температура появления в окалине вюстита, что указывает на возрастание жаростойкости стали. В табл.1 указана температура, при которой замечены первые следы FeO в окалине.
Табл. 1
|
Состав |
Температура Т |
|
|
появления FeO, °С |
||
|
Чистое железо |
575 |
|
|
Fe + 1,03 %Cr |
600 |
|
|
Fe + 1,5 %Cr |
650 |
|
|
Fe + 1,0 %Co |
||
|
Fe + 10 %Co |
700 |
|
|
Fe + 1,14 %Si |
750 |
|
|
Fe + 0,4 %Si + 1,1 %Al |
800 |
|
|
Fe + 0,5 %Si + 2,2 %Al |
850 |
Установлено, что железо в пассивном состоянии, а также легированные стали имеют поверхностные слои с кристаллографической решеткой шпинельного типа, обладающие защитными свойствами. При окислении железа образуется магнетит FeO·Fe2O3, а в хромоникелевых сплавах пленка состоит из NiO·Cr2O3. Двухвалентными ионами могут быть ионы Mg, Fe, Ni, Mn, трехвалентными — ионы Al, Fe, Cr.
Малое количество дефектов у пленок со структурой типа шпинелей делает их защитными. Еще более высокими защитными свойствами обладают сложные оксиды типа FeO·Me2O3 или MeO Fe2O3. Установлено, что при длительном окислении слой оксидной пленки, примыкающий к поверхности высокохромистой стали, имеет состав FeO·Cr2O3, а внешний слой, обогащенный железом, сформирован из твердых растворов хрома в оксидах железа типа (Fe,Cr)2O3. При повышении температуры окисления поверхностный слой пленки значительно обогащается оксидами железа.
Легирование сталей на жаростойкость
Легирование стали элементами с меньшим, чем у железа ионным радиусом (например, Cr, Al, Si, и др.; см. табл. 7.7) уменьшает параметр решетки образовавшегося сложного оксида, замедляя диффузионную подвижность ионов кислорода и основного металла (железа), что и способствует повышению жаростойкости стали.
Основными легирующими элементами стали, повышающими ее жаростойкость, являются хром, алюминий и кремний, образующие прочные защитные оксидные пленки.
Наиболее важным легирующим элементом, повышающим жаростойкость сталей, является хром. Хромистые стали благодаря образованию плотной и прочной защитной пленки относятся к лучшим техническим сплавам с повышенным сопротивлением окислению в газовой и пароводяной средах. Поскольку плотности оксидов Fe2O3 и Cr2O3 близки(5100-5200и 5210 кг/м3 соответственно), обогащение защитных пленок оксидом хрома не вызывает в них дополнительных объемных изменений и напряжений, что могло бы привести к их разрушению. Достаточная жаростойкость при рабочей температуре 700°С обеспечивается содержанием в стали 5 % Cr. Для работы при более высоких температурах (до 1100°С) содержание хрома в стали необходимо увеличить до15-25%.
Легирование алюминием и кремнием, снижающим диффузионную подвижность ионов Fe в образовавшихся сложных оксидах FeO·SiO2 и FeO·Al2O3, значительно повышает жаростойкость сталей. Но низкая плотность оксидов Al2O3 и SiO2 (2200 и 3960 кг/м3 соответственно) по сравнению с оксидом железа может привести к значительным объемным изменениям, возникновению напряжений и разрушению защитных пленок. Кроме того, повышенная концентрация в стали Si (> 4 %) и Al (> 1,5 %) приводит к снижению ее технологических свойств — уменьшению пластичности и большей склонности к хрупкому разрушению.
Наибольшее повышение жаростойкости дает одновременное легирование стали несколькими элементами: Cr и Si, Cr и Al или Cr, Si и Al. При этом легирование хромом повышает жаростойкость в наибольшей степени, а Si и Al только усиливают действие Cr, но самостоятельного значения практически не имеют.
При высоких температурах (выше 800 °С) в воздушной атмосфере окисление и обезуглероживание стали замедляется с повышением содержания в ней углерода, что связано с интенсификацией процесса образования оксида углерода СО, образующего в окалине газовые пузыри.
Сера, фосфор, никель и марганец, присутствующие в стали, практически не влияют на высокотемпературное окисление железа, а титан, медь, кобальт и бериллий, хотя и незначительно, но повышают сопротивление окислению в газовой среде. Введение в сталь в небольших количествах Мо (до 0,7 %) и V(0,1-0,35%) замедляет окислениеиз-заторможения диффузионного переноса атомов железа в стали. Но превышение указанных количеств Мо и V сильно ускоряет окисление вследствие образования их легкоплавких и летучих оксидов МоО3 (Тпл = 795°С) и V2O5 (Тпл = 660°С) на поверхности стали.
Повышение жаростойкости тугоплавких металлов может быть достигнуто:
- легированием для получения сложных нелетучих оксидов (например, Nb + Ti → TiO2·3Nb2O5);
- легированием для приближения отношения Vок/VМе к единице (Nb + V или Мо);
- легированием элементами, оксиды которых термодинамически устойчивее основного металла (Nb + Ti или Zr);
- легированием оксидами для получения дисперсно-упрочненных материалов типа Ме + оксид (W + ThO2;
- Mo + Al2O3, Cr2O3, ZrO2, TiO2 и др.).
Практическая реализация жаростойкого легирования ограничивается следующими причинами:
— •различие в сродстве компонентов сплава к кислороду и их различная диффузионная подвижность в сплаве и окалине затрудняет равномерное распределение легирующих катионов в пленке, а, следовательно, и типа проводимости оксида по глубине слоя.
Заключение
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
В XXI веке высокие темпы развития промышленности, интенсификация производственных процессов, повышение основных технологических параметров (температура, давление, концентрация реагирующих средств и др.) предъявляют высокие требования к надежной эксплуатации технологического оборудования и строительных конструкций. Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Необходимость осуществления мероприятий по защите от коррозии диктуется тем обстоятельством, что потери от коррозии приносят чрезвычайно большой ущерб. По имеющимся данным, около 10% ежегодной добычи металла расходуется на покрытие безвозвратных потерь вследствие коррозии и последующего распыления. Основной ущерб от коррозии металла связан не только с потерей больших количеств металла, но и с порчей или выходом из строя самих металлических конструкций, т.к. вследствие коррозии они теряют необходимую прочность, пластичность, герметичность, тепло- и электропроводность, отражательную способность и другие необходимые качества.
Список использованных источников
[Электронный ресурс]//URL: https://inzhpro.ru/referat/zaschita-oborudovaniya-ot-korrozii/
коррозия жаростойкость жаропрочность легирующий
1.Абрамович М.Д., Вотинов С.Н., Иолтуховский А.Г. Радиационное материаловедение на АЭС. — М.: Энергоатомиздат, 1984. — 136 с.
- Бескоровайный Н.М., Иолтуховский А.Г. Конструкционные материалы и жидкометаллические теплоносители. — М.: Энергоатомиздат, 1983. — 164 с.
- Бескоровайный Н.М., Калин Б.А., Платонов П.А., Чернов И.И.
Конструкционные материалы ядерных реакторов: Учебник для вузов. — М.: Энергоатомиздат, 1995. — 704 с.
- Бескоровайный Н.М., Беломытцев Ю.С., Абрамович М.Д. и др. Конструкционные материалы ядерных реакторов. Ч. 1. Ядерные и теплофизические свойства, основы коррозии и жаропрочности: Учебное пособие для вузов. — М.: Атомиздат, 1972. — 240 с.
- Баландин Ю.Ф., Горынин И.В., Звездин Ю.И.
и др. Конструкционные материалы АЭС. — М.: Энергоатомиздат, 1984. — 280 с.
- Герасимов В.В., Монахов А.С. Материалы ядерной техники. — М.: Энергоатомиздат, 1982. — 288 с.
- Бялобжеский А.В., Цирлин М.С., Красилов Б.И.
Высокотемпературная коррозия и защита сверхтугоплавких металлов. — М.: Атомиздат, 1977.
