2.1 История открытия углекислого газа
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием “дикого газа” алхимиком XVI в. Ван-Гельмонтом. Открытием углекислого газа было положено начало новой отрасли химии – пневматохимии (химии газов).
“Уголь, – утверждал Ван-Гельмонт, – и вообще все горючие вещества освобождают необходимым образом при своем горении “дикий газ”. 62 ливра дубового угля дают один ливр золы. Остальные 61 ливр пошли на образование “дикого газа”. Этот “воздух”, неизвестный до сих пор, который нельзя ни собрать в сосуды, ни превратить в видимое тело, я называю новым именем – газ.
Есть тела, которые таят в себе этот газ; он в них, таким образом, как бы фиксирован или отвержен. Его выводят из этого состояния посредством фермента, как это наблюдается при брожении вина, теста, пива. Винное сусло, яблочный сок, ягоды, мед под влиянием фермента приходят как бы в кипение, производимое выделением газа. Этот газ, сдавленный с большой силой в бочках, делает вина пенящимися и игристыми.”
Тот же самый газ, который выделяется при горении угля и брожении вина, оказывается далее, может получаться и из других, крайне отличных друг от друга источников, а именно:
1. При действии кислоты на скорлупу (“в момент, когда уксус растворяет раковую скорлупу”).
2. В пещерах, копях и погребах (“ничто не волнует так сильно, как зрелище газа в собачьей близ Неаполя. Очень часто он убивает тех, кто работает в копях; можно мгновенно оказаться удушенным им в погребах”).
3. В некоторых минеральных водах (“воды сна выделяют дикий воздух”).
Этим открытием Ван-Гельмонта был заложен фундамент пневматохимии. И этот же Ван-Гельмонт, выращивая в течение 5 лет взвешенный отросток вербы во взвешенном количестве земли и не обнаружив после этого убыль веса земли, пришел к убеждению, что растения образуются из воды, которой они поливаются, ни минуты не подумав, что источником прибыли веса растения может являться воздух или открытый им газ.
Безопасное обращение с электричеством, бытовым газом и средствами бытовой химии
... резкому увеличению выпуска продукции бытовой химии. Глава 1. Безопасное обращение с электричеством. 1.1. Меры ... безопасности. А ведь это надо знать всем, даже тем, кто по своей специальности и образованию очень далёк от электричества – ведь все мы пользуемся бытовыми электрическими приборами. При ... помнить, что большинство электропроводок, главным образом в старых домах, выполнено до ...
Единственное испытание, которому подвергал Ван-Гельмонт разные газы для отличения их друг от друга, была горящая свеча – средство, еще не достаточное для отличения углекислого газа, например, от азота, который тоже не поддерживает горения и действует на живые существа удушающим образом, как и “дикий воздух” Ван-Гельмонта.
То свойство углекислого газа, по которому углекислый газ действительно можно отличить почти от всякого другого газа, его способность “притягиваться” известковой водой и мутить ее, было обнаружено Блэком; за это отличие от обыкновенного воздуха Блэк и дал дикому газу (“может быть, весьма неудачно”) новое название: фиксируемый воздух.
Несколько лет спустя Кавендиш, верный своему правилу все определять “мерой, числом и весом”, обнаружил еще два характерных физических свойства углекислого газа: его высокий удельный вес и значительную растворимость в воде.
Вскоре затем Лавуазье предпринял опыт, которому суждено было направить химические исследования в новое русло. Задавшись целью выделить из окалины свинца ту составную часть воздуха, которая, по его предположению, присоединилась к свинцу и вызвала увеличение веса, Лавуазье прокалил оксид свинца с углем и получил газ, который хорошо растворялся в воде, осаждал известковую воду, гасил пламя и удушал животных, одним словом, имел “все свойства в точности такие же, какие присущи виду воздуха, известному под названием фиксируемого воздуха”.
Этот фиксируемый воздух, т.е. углекислый газ, Лавуазье ошибочно принял вначале за ту составную часть обыкновенного воздуха, которая присоединяется металлами при прокаливании. Что фиксируемый воздух содержится в атмосфере, Блэком уже было доказано: оставленная в открытом сосуде на воздухе известковая вода с течением времени мутится.
Лавуазье понял свою ошибку лишь после встречи с Пристли, который сам того не подозревая, посредством своего опыта с “ртутной окалиной” уже решил задачу, над которой бился Лавуазье. Лавуазье тотчас же повторил свой опыт восстановления углем окалины металла, лишь заменив окись свинца окисью ртути и на этот раз дал правильное истолкование: “Поскольку уголь полностью исчезает при восстановлении ртути из ее окалины и поскольку при этой операции получаются только ртуть и фиксируемый воздух, поскольку фиксируемый воздух есть соединение жизненного воздуха (кислорода) с углем, т.е. окисел (оксид) углерода”.
2.2 Строение молекулы углекислого газа
2.2.1 С позиции ВС
Молекула оксида углерода (IV) имеет следующее строение: атом углерода переходит в возбужденное состояние, имея 4 неспаренных электрона.
C +6 )) 1s 2 2s 2 2p 2 C * +6 )) 1s 2 2s 1 2p 3
Совершенствование технологии использования продувочных газов ...
... Установка метанатора для вовлечения в процесс дополнительного углекислого газа со стадии очистки 1 Значение процесса синтеза аммиака для мировой истории В конце 18 века ... атмосферного воздуха. К нежелательным примесям относятся окислы углерода и сернистые соединения. Они являются контактными ядами для катализаторов синтеза. Часть примесей, непрореагировавшие углеводороды, благородные газы являются ...
24
O +8 )) 1s 2 2s 2 2p 4
26
Mr(CO 2 ) = 12,011 + 15,999 2 = 44,009 44
Молекула оксида углерода (IV) состоит из двух атомов кислорода и одного атома углерода.
Электронная формула Структурная формула
O C
- O O = C = O
Все 4 ковалентные связи полярны. Молекула имеет линейную форму. Это объясняется следующим образом: в многоатомных молекулах связь между атомами может быть полярной, а сами молекулы в зависимости от пространственного строения могут быть как полярными, так и неполярными. Электрический момент диполя в таких молекулах определяется числом полярных связей и их направленностью. Он равен векторной сумме моментов диполя отдельных связей. Например, электрический момент диполя связей C = O равен 910 -30 Клм, а молекулы CO 2 – нулю. Т.к. в линейной молекуле CO 2 векторы связей радиально направлены от центра, а потому результирующий момент равен нулю.
C +
O — O —
Рис.1. Геометрическое сложение электрических моментов диполей связей в молекуле углекислого газа
Раз каждая из связей углерод-кислород является полярной, поэтому на каждом из атомов кислорода должен быть некоторый отрицательный заряд, а на углероде сосредоточен положительный заряд. Поскольку атомы кислорода расположены на одной прямой по обе стороны от атома углерода на равных расстояниях, центры распределения положительных и отрицательных зарядов совпадают. Вследствие этого заряд на углероде полностью нейтрализуется.
Значит, хотя каждая из связей углерод-кислород полярна, молекула углекислого газа в целом является неполярной и причиной тому является ее линейное строение.
2.2.2 с позиции МЛКАО
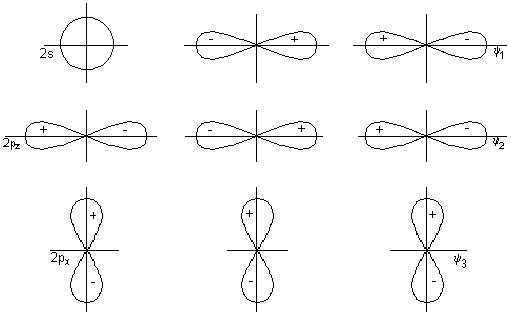
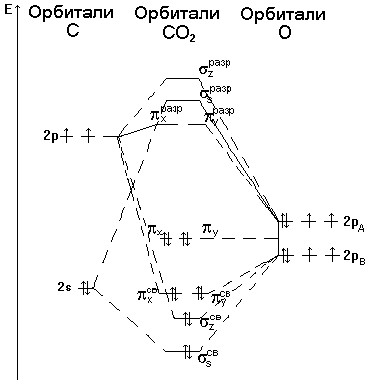
Мы знаем, что форма молекулы диоксида углерода линейная. У атома кислорода имеются орбитали p-типа.
На рис.2 показаны валентные орбитали центрального атома (углерода) и групповые орбитали лигандов (атомов кислорода).
Кислород. Его свойства и применение
... половины XVIII в. — швед Карл Шееле и англичанин Джозеф Пристли. Первым получил кислород К. Шееле, но его работа «О воздухе и огне», в которой был описан этот газ, ... из четырех, и поэтому для образования двух электронных пар при взаимодействии с тем или иным атомом не требуется энергии возбуждения (a). Ячейки соответствует определенным состояниям (орбиталям) электронов на каждом ...
а) б)
Рис.2. Орбитали центрального атома (а) групповые орбитали (б) для трехцентровой линейной молекулы CO 2 .
Вследствие большого энергетического различия 2s и 2p орбиталей кислорода участием 2s орбиталей можно пренебречь. Сочетание орбиталей 2s- 1 , 2p z — 2 приводит к образованию молекулярных орбиталей -типа: σ s св , σ s разр и z св , z разр .
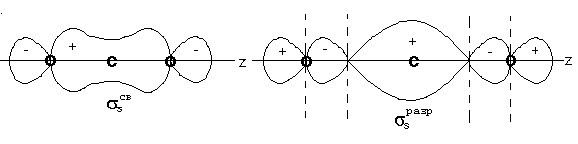
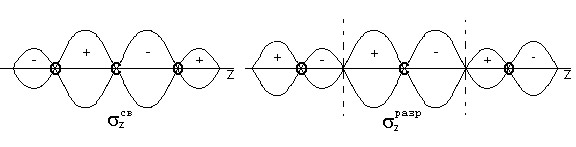
Рис.3. Связывающие и разрыхляющие S-орбитали молекулы углекислого газа
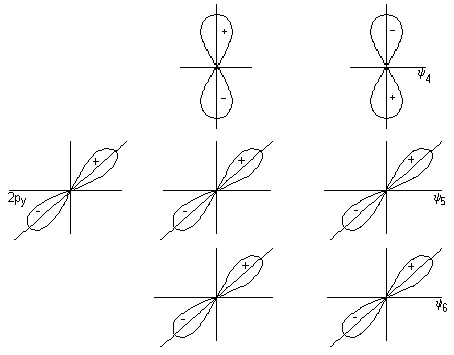
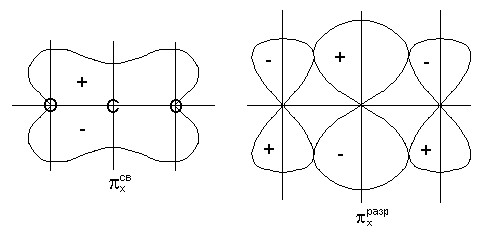
Комбинация орбиталей 2p x — 3 и 2p y — 5 приводит к образованию трехцентровых орбиталей -типа: x св , x разр и y св , y разр (рис.4).
Для групповых орбиталей 4 и 6 подходящих по симметрии орбиталей центрального атома нет, поэтому в молекуле CO 2 они играют роль несвязывающих и обозначаются x и y . Несвязывающие орбитали локализованы у атомов кислорода (рис.4)
Система выпуска отработавших газов
... или глушитель. Система выпуска отработавших газов: а - без нейтрализатора; б - с нейтрализатором; в - схема прохождения отработавших газов; 1 - кронштейн ... оксид углерода превращается в малотоксичный углекислый газ, а оксиды азота восстанавливаются до безвредного азота. Степень очистки газов в исправном нейтрализаторе достигает 90-95%. Для нормальной работы нейтрализатора состав отработавших газов ...
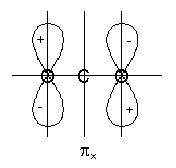
Рис.4. -связывающие, разрыхляющие и несвязывающие орбитали молекулы CO 2 .
Приближенная энергетическая диаграмма молекулы CO 2 показана на рис.5. Распределение валентных электронов (четыре атома углерода и восемь – двух атомов кислорода) по орбиталям молекулы CO 2 соответствует электронной конфигурации
( z св ) 2 ( z св ) 2 ( x св ) 2 ( y св ) 2 ( x ) 2 ( y ) 2 ,
а с учетом 2s-электронов двух атомов кислорода
(2S A ) 2 (2S B ) 2 ( s св ) 2 ( z св ) 2 ( x,y ) 4 ( x,y ) 4 .
Четыре пары электронов приходятся на четыре трехцентровые связующие орбитали, т.е. на каждый из атомов кислорода приходится по две пары связывающих электронов. Таким образом, можно считать, что порядок связи между атомом кислорода и углерода в молекуле CO 2 равен 2. Это можно отразить структурной формулой O = C = O.
Промышленные воды
... второй группе относятся: азотные термальные, метановые и сероводородные воды. К третьей группе относятся углекислые воды, которые в соответствии с общим химическим составом подразделяются на пять ... 150 °С) и содержание в водах растворенных газов, в частности СО2. На участках скопления углеводородов в нефтегазоносных районах подземные воды максимально обогащаются растворенным органическим веществом ...
2.3 Физические свойства углекислого газа
Углекислый газ (оксид углерода (IV) или угольный ангидрид) – бесцветный газ, имеющий слабокислый запах и вкус, в 1,5 раза тяжелее кислорода, поэтому можно его переливать из стакана в стакан. = 1,98 г/л. В одном объеме воды при 20С растворяется 0,88 объема CO 2 . При охлаждении в условиях нормального давления газ затвердевает при -78,515C, минуя жидкое состояние. Твердый оксид углерода (IV) – снегообразная масса, называемая сухим льдом. Жидкий CO 2 образуется только под давлением при 20C; 58,4610 5 Па. В жидком состоянии хранится и транспортируется в стальных баллонах. При открывании вентиля баллона происходит сильное охлаждение и часть газа переходит в сухой лед. Легко возгоняется, затвердевает. Давление паров: 133,32Па (-135,1C); 1,3332 кПа (-119,6C); 13,332 кПа (-100,2C); 53,328 кПа (-86,0C). t пл = -56,6C (0,52 МПа).
Коэффициент растворимости в сыворотке крови человека 0,58. Содержание в воздухе 4% по объему CO 2 вызывает болезненный явления, при концентрации CO 2 выше 10% появляется удушье.
Оксид углерода (IV) – конечный продукт дыхания растений и животных, а также процессов горения, дыхания, гниения, брожения. Служит источником питания зеленых растений – фотосинтез.
Углекислый газ бесцветен, т.е. не поглощает никаких видимых лучей. Но в инфракрасной части спектра углекислого газа наблюдаются широкие линии поглощения; для инфракрасных, иначе говоря, тепловых, лучей углекислый газ мало прозрачен. Поэтому, если бы атмосфера Земли состояла из углекислого газа, она выполняла бы роль стекла в парниках, солнечное излучение достигало бы сквозь нее поверхности Земли беспрепятственно без заметного ослабления и сильно нагревало бы ее, но обратное тепловое излучение Земли в мировое пространство очень сильно задерживалось бы мало прозрачным для тепловых лучей углекислым газом. От этого климат Земли резко утеплился (“Парниковый эффект”, глава “География”).
2.4 Химические свойства углекислого газа
Оксид углерода (IV) химически довольно активен. Рассмотрим некоторые реакции.
1. Оксид углерода (IV) – кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) – обратимая реакция.
H 2 O + CO 2 H 2 CO 3
равновесие при комнатной температуре на 99% сдвинуто влево
Углекислый газ не просто растворяется в воде, а частично соединяется с нею, образуя угольную кислоту.
2H 2 O + CO 2 H 3 O + + HCO 3 —
Однако угольная кислота – соединение крайне непрочное. Она может присутствовать лишь в водном растворе, при всякой же попытке выделить угольную кислоту из раствора она опять разлагается на CO 2 и H 2 O.
H 2 CO 3 H + + HCO 3 Ka I = 4,4510 -7
HCO 3 — H + + CO 3 Ka II = 4,6910 -11
2. С сильными основаниями оксида углерода (IV) реагирует с образованием солей угольной кислоты – карбонатов и гидрокарбонатов.
Ca(OH) 2 + CO 2 CaCO 3 + H 2 O
CaCO 3 + H 2 O + CO 2 Ca(HC0 3 ) 2
3. Углекислый газ – вещество очень прочное, тем не менее при температуре красного каления с кальцием дает карбид и оксид кальция.
2CO 2 + 5Ca CaC 2 + 4CaO
4. Наиболее активные металлы горят в оксиде углерода (IV).
600C
2Mg + CO 2 2MgO + C
5. При высоких температурах восстанавливается в CO с железом, цинком, углем.
3CO 2 + 4Fe 2Fe 2 O 3 + 3C
CO 2 + C 2CO
6. С водородом в присутствии никеля при 350-400C или оксида меди (II) при 200C восстанавливается в метан.
350-400C
CO 2 + 4H 2 → CH 4 + 2H 2 O
Ni
7. С аммиаком при 600C дает карбамид.
CO 2 + NH 3 CO(NH 2 ) 2
8. С сероуглеродом в присутствии меди дает
CO 2 + CS 2 2S + 2CO
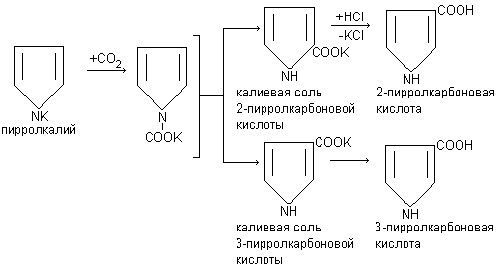
9. Реагирует со многими органическими соединениями, карбоксилируя их. Пиррол, подобно фенолу карбоксилируется оксидом углерода (IV), образуя 2-пирролкарбоновую кислоту, а в более жестких условиях температуры 3-пирролкарбоновую кислоту.
2.5 Получение углекислого газа
В химических лабораториях либо пользуются готовыми баллонами с жидким угольным ангидридом, либо получают двуокись углерода в аппаратах Киппа действием соляной кислоты на куски мрамора. Пользоваться серной кислотой вместо соляной при этом нельзя, потому что тогда вместо растворимого в воде хлорида кальция получился бы гипс – соль, малорастворимая в воде. Отлагаясь на куски мрамора, гипс крайне затрудняет доступ к ним кислоты и тем самым очень замедляет течение реакции. От примеси паров хлористого водорода двуокись углерода освобождается в промывной склянке с водой, а от паров воды – в следующей склянке с серной кислотой.
В промышленности двуокись углерода получается главным образом как побочный продукт обжига известняка, спиртового брожения.
2.6 Применение углекислого газа
Г.Кавендиш первый обратил внимание на то, что водный раствор двуокиси углерода имеет хотя и слабый, но приятный кислый вкус. Он продемонстрировал в Королевском обществе стакан “чрезвычайно приятно искрящийся (шипучей) воды, едва ли отличной от сельтерской воды” и получил за это открытие золотую медаль общества. Это было первое практическое применение диоксида углерода, им заинтересовались американские предприниматели (когда Д.Пристли находился уже в эмиграции), после того как один доктор стал прописывать карбонизированную воду с добавкой фруктовых соков своим пациентам. Отсюда и стала развиваться промышленность газированных напитков, которая до сих пор является одним из важнейших потребителей углекислого газа.
Диоксид углерода применяют для газирования фруктовых и минеральных вод, для производства сахара, пива, в медицине для углекислых ванн. Его наполняют спасательные пояса и плоты из маленьких стальных баллонов с жидкой массой диоксида углерода. Жидкий угольный ангидрид применяют:
1) в портативных огнетушителях;
2) в огнетушительных системах самолетов и кораблей, пожарных углекислотных машинах.
Такое широкое применение в огнетушении связано с тем, что в некоторых случаях вода не годится для тушения, например, при тушении загоревшихся огнеопасных жидкостей или при наличии в помещении невыключенной электропроводки, уникального оборудования, которое от воды может пострадать.
Применение прессованного твердого угольного ангидрида, который мы называем сухим льдом, тоже достаточно широкое. Так его используют для поддержания низкой температуры в вагонах-холодильниках для транспорта скоропортящихся продуктов, а также при производстве мороженого. Почему, возникает вопрос, нельзя использовать обыкновенный лед. А оказывается сухой лед имеет ряд преимуществ:
1. позволяет поддерживать в холодильнике, роль которого у продавцов мороженого играет простой картонный короб, гораздо более низкую температуру до -78,2C;
2. поглощает при испарении втрое больше теплоты на единицу массы, чем лед при плавлении;
3. не загрязняет холодильника, как обыкновенный лед, жидким продуктом плавления;
4. создает в холодильнике атмосферу из диоксида углерода, дополнительно предохраняющую пищевые продукты от порчи.
Сухой лед применяют также для охлаждения и отвердевания заклепок из алюминиевых сплавов и при надевании бандажей – металлических колец или поясов на части машин.
Углекислый газ применяется также как теплоноситель в графитовых реакторах.
Очень интересное применение оксида углерода IV для изменения погоды: при рассеивании порошка сухого льда с самолета, пролетающего над переохлажденным облаком, создается искусственный снегопад над аэродромами (при расходе всего примерно 100 г льда на 1 км 3 облака).
При этом начинают падать густые мокрые хлопья снега, а вскоре сквозь сплошную облачность начинает просвечивать небо. Просветы быстро расширяются и сливаются в широкое синее небо. В результате сильного охлаждения замерзают лишь немногие водяные капельки. Остальные остаются в переохлажденном состоянии. Но так как при одной и той же температуре переохлажденная вода имеет большую упругость пара, чем лед, тотчас начинается нарастание ледяных кристаллов за счет капелек жидкой воды, что и приводит к снегопаду.
Во многих случаях угольный ангидрид используют не в готовом виде, а получают в процессе использования. В таких случаях исходные вещества применяют либо раздельно – как серная кислота и дикарбонат натрия в обычных огнетушителях, либо в виде смеси двух сухих порошков (как в некоторых хлебопекарных порошках), например, смесь бикарбоната натрия с кислым виннокислым калием, виннокислым аммонием или хлоридом аммония. Пока такая смесь остается сухой, реакция не происходит. При добавлении воды соли растворяются, диссоциируют, и возникает ионная реакция с выделением диоксида углерода.
Подобные реакции происходят в результате смешивания хлебопекарных порошков с тестом для разрыхления теста химическим путем, без применения биологических средств – дрожжей и заквасок. В результате тесто “всходит”, наполняясь пузырьками диоксида углерода, и выпеченный из него продукт получается мягким и легче переваривается.
Углекислый газ выступает как инертная атмосфера.
Вот такое широкое применение имеет оксид углерода (IV).
Здесь показаны лучшие его качества, но не весь углекислый газ бывает полезен человеку и природе.
2.7 Круговорот углекислого газа в природе
В истории зеленого углерода можно различить несколько этапов. До появления водной оболочки Земли углерод главным образом входил в состав земной атмосферы в виде углекислого газа. Об этом свидетельствует анализ газовых включений в силикатных минералах: кислород в них отсутствует, а содержание углекислого газа достигает 96%. С охлаждением земной коры и появлением жидкой воды, насыщенной углекислым газом, начинается процесс выветривания магматических горных пород, сводящийся в основном к вытеснению кремниевой кислоты из силикатов угольной кислотой, как кислотой более сильной. Нерастворимые продукты разрушения горных пород в виде рыхлых масс остаются на листе, а растворимые соли, в том числе дикарбонаты, увлекаются в мировой океан. Таким образом создается необходимое сочетание условий для возникновения растительной живой материи: углекислый газ, жидкая вода и растворенные в ней соли.
В мировом океане зародилась жизнь; это начало нового этапа в геохимической жизни углерода. В результате основного процесса жизнедеятельности растений – фотосинтеза – углерод из атмосферы переходит в состав живой массы биосферы, и состав атмосферы постепенно изменяется, углекислый газ в ней сменяется кислородом. Таким образом возникают необходимые предпосылки к возникновению животной жизни: свободный кислород и накопленные растениями органические вещества.
Рисунок сводит отдельные, рассмотренные выше превращения углекислого газа в природе в единую цельную картину.
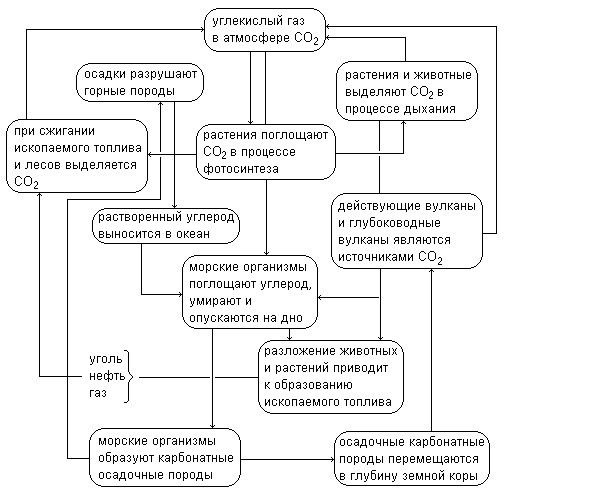
Углекислый газ используется в процессе фотосинтеза для образования органических веществ. Именно благодаря этому процессу замыкается круговорот углерода в биосфере. Как и кислород, углерод входит в состав почв, растений, животных, участвует в многообразных механизмах круговорота веществ в природе. Содержание углекислого газа в воздухе, который мы вдыхаем, примерно одинаково в различных районах планеты. Исключение составляют крупные города, в которых содержание этого газа в воздухе бывает выше нормы.
Некоторые колебания содержания углекислого газа в воздухе местности зависят от времени суток, сезона года, биомассы растительности. В то же время исследования показывают, что с начала века среднее содержание диоксида углерода в атмосфере, хотя и медленно, но постоянно увеличивается. Ученые связывают этот процесс главным образом с деятельностью человека.
Как и каждый химический элемент, углерод в земной коре находится в постоянном движении, преобразовании из одной химической формы соединений в другую; эти изменения замыкаются в целую систему взаимно переплетающихся циклов. Исходя из одной определенной формы существования углерода, например из CO 2 , и последовательно прослеживая его преобразования мы вновь возвратимся в исходную точку – в CO 2 .
В минеральной природе главными генераторами углекислого газа являются вулканы, не только действующие, но и давно потухшие; вулканические местности изобилуют выделяющимися из под земли струями углекислого газа и ключами, постоянно выбрасывающими CO 2 из земных недр в виде раствора, насыщенного углекислым газом (нередко под большим давлением).
В минеральной природе диоксид углерода расходуется процессами выветривания. Это крайне медленные химические реакции; мы непосредственно не можем проследить их течение. Но, встречая на поверхности земли полуразрушенные выветриванием глубинные породы, например гранит в окружении продуктов его разрушения – песка и глины, мы легко можем мысленно воссоздать процесс разрушения, всякий раз необходимым участником агрессии, постигшей изверженную породу, окажется углекислый газ. Таким образом, с точки зрения геохимии углерода, процессы выветривания – это процессы связывания углекислого газа. Именно углекислый газ является главным деятелем процессов выветривания, а так как они идут повсеместно, и охватывают неизмеримо большие массы минеральной материи, диоксид углерода извлекается ими из атмосферы в настолько больших количествах, что по расчетам геологов, углекислого газа, содержащегося в данный момент в атмосфере, хватило бы на процессы выветривания не больше чем на 18000 лет.
Масштабы процессов, пополняющих атмосферу углекислым газом и расходующих его, представляются в современную эпоху существования земного шара таблицей:
Масштабы круговорота угольного ангидрида (в млрд. т в год).
|
Поступление в атмосферу |
Уход из атмосферы |
|
Из океанов 200 |
В океаны 200 |
|
Дыхание и гниение 60 |
Фотосинтез 60 |
|
Горячие источники и вулканы 0,1 |
Выветривание 0,1 |
|
Сжигание топлива 6 |
|
|
Освоение целинных земель 2 |
|
Из таблицы видно, что в природе образование и расходование углекислого газа сбалансированное. Но деятельность человека нарушает баланс. Сопоставление анализов воздуха на протяжении последних 100 лет обнаруживает постепенное накопление диоксида углерода в атмосфере. С этим предположительно связывают некоторое смягчение климата на земном шаре.
Круговорот углерода представляется нам движением по замкнутому кругу, однако в рамках сравнительно ограниченного геологического срока; если же рассматривать историю углерода в целом, начиная с возникновения его первых простейших соединений и кончая зарождением, постепенным усложнением и усовершенствованием органической материи, легко убедиться, что в действительности круговорот углерода не простое повторение пройденного, а движение поступательное, по восходящей линии, развитие от простого к сложному, от низшего к высшему. Это относится и к круговороту всех других элементов, образующих земной шар.
2.8 Гигиенические нормативы предельно допустимой концентрации (ПДК)
Оказывается, у людей появляется привыкание к углекислому газу. Но существует в странах мира ПДК углекислого газа в атмосфере. К сожалению у нас в России ПДК в воздухе рабочей зоны не установлена, в США – 9000 мг/м 3 . В угольных и озокеритовых шахтах разрешается содержание углекислого газа до 0,5%. По данным Елисеевой, в жилых и общественных зданиях среднесуточная концентрация не должна превышать 0,05% углекислого газа, а кратковременная (разовая) – 0,01%.
