Вода в нашей жизни — самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Пожалуй, только жидкий гелий может соперничать с ней. Но необычные свойства жидкого гелия (такие, как сверхтекучесть) проявляются при очень низких температурах (вблизи абсолютного нуля) и обусловлены специфическими квантовыми законами. Поэтому жидкий гелий — это экзотическое вещество. Вода же в нашем сознании является прообразом всех жидкостей, и тем более удивительно, когда мы называем ее самой необычной. Но в чем же заключается необычность воды? Дело в том, что трудно назвать какое-либо ее свойство, которое не было бы аномальным, то есть ее поведение (в зависимости от изменения температуры, давления и других факторов) существенно отличается от такового у подавляющего большинства других жидкостей, у которых это поведение похоже и может быть объяснено из самых общих физических принципов. К таким обычным, нормальным жидкостям относятся, например, расплавленные металлы, сжиженные благородные газы (за исключением гелия), органические жидкости (бензин, являющийся их смесью, или спирты).
Вода имеет первостепенное значение при большинстве химических реакций, в частности и биохимических. Древнее положение алхимиков – «тела не действуют, пока не растворены» – в значительной степени справедливо. Человек и животные могут в своем организме синтезировать первичную («ювенильную») воду, образовывать ее при сгорании пищевых продуктов и самих тканей. У верблюда, например, жир содержащийся в горбу, может путем окисления дать 40 л воды. Связь между водой и жизнью столь велика, что даже позволила В. И. Вернадскому «рассматривать жизнь, как особую коллоидальную водную систему… как особое царство природных вод». Вода – вещество привычное и необычное. Известный советский ученый академик И.В.Петрянов свою научно – популярную книгу о воде назвал “Самое необыкновенное вещество в мире”. А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о воде – “Вещество, которое создало нашу планету”. Ученые правы: нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
-
Распространение воды на планете Земля
43 стр., 21274 словНаучная работа: Создание научных основ обеззараживания и очистки ...
... основ очистки воды на основе нанотехнологии с использованием электроактивационного метода и разработанные рекомендации по оптимизации технологических процессов очистки, путем установления физико-технических параметров метода и свойств питьевой воды. В результате ...
Нахождение в природе.
Вода — самое распространенное на земле вещество. Поверхность нашей планеты на 71 % покрыта водой. Но эти огромные ресурсы не пригодны для питья: 97 % всех вод Земли засолены; лишь 1 % — пресная вода; 2 % — это ледники.
I. Соленая вода океанов и морей — 1.370.000.000 км 3
II. Солоноватые подземные воды — 60.000.000 км 3
III. Весь запас пресной воды на Земле — 30.500.000 км 3
IV. Пресная вода в реках, озерах и почве — 826.000 км 3
V. Годовое потребление пресной воды населением Земли — 8.000 км 3
Вода — самый необходимый источник жизни для всего живого. Вода содержится в животных и растениях. Человек на 70 % состоит из воды (а огурец аж на 97 % ).
Почти ¾ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Из общего количества воды на Земле, равного 1 млрд. 386 млн. кубических километров, 1 млрд. 338 млн. кубических километров приходится на долю солёных вод Мирового океана, и только 35 млн. кубических километров приходится на долю пресных вод. Всего количества океанической воды хватило бы на то, чтобы покрыть ею земной шар слоем более 2,5 километров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Но трудность в том, что подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает её труднодоступной для человека. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% — в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
2. Состав воды.
24 июня 1783 г. А. Лавуазье и П. Лаплас в присутствии группы своих коллег-ученых «сделали» воду из кислорода и водорода. Воду они получили как продукт сгорания водорода (а то, что в процессе горения участвует кислород — «огненный ВОЗДУХ», стало известно чуть раньше).
При этом вес образовавшейся воды равнялся весу водорода и кислорода, участвовавших в реакции горения.
Вот так в один день стало ясно, что вода — не простои элемент, а сложное вещество, но какой долгий и трудный путь вел к этому знаменательному дню, сколько огорчении, разочарований, ошибок и личных трагедий пережили естествоиспытатели, пока вода наконец-то раскрыла свою природу.
Изотопный состав воды
Атомы водорода и кислорода, образующие воду, или окись водорода, могут иметь различные массовые числа и отличаться друг от друга своими физико-химическими свойствами, но при этом они имеют одинаковый электрический заряд атомных ядер и поэтому занимают в периодической системе элементов одно и то же место. Такие разновидности атомов одного и того же химического элемента называются изотопами. Известны пять водородов и пять кислородов. Правда, по два из них ( 4 H, 5 H, 14 O и 15 O ) радиоактивны и очень короткоживущие. Например, длительность существования водорода –4—4*10 -11 сек. Наиболее широко известны следующие изотопы водорода: протий 1 H ( с относительной атомной массой 1), дейтерий 2 H , или D ( c относительной атомной массой 2) и тритий 3 H , или T ( c относительной атомной массой 3), наиболее тяжелый, но слаборадиоактивный водород ( его период полураспада 12,3 года), и изотопы кислорода: 16 O , 17 O и 18 O . Эти шесть изотопов могут образовывать 18 изотопических разновидностей воды: 1 Н 2 16 О; 1 Н D 16 О; D 2 16 О ; 1 Н T 16 О; DT 16 О; T 2 О 16 ; 1 Н 2 17 О; 1 Н D 17 О; D 2 17 О; 1 Н T 17 О; DT 17 О; T 2 17 О; 1 Н 2 18 О; 1 Н D 18 О; D 2 18 О; 1 Н T 18 О; DT 18 О; T 2 18 О.
Вода и ее применение в современных технологиях
... определяет интенсивность растворения водой различных веществ. При 0°С диэлектрическая проницаемость воды (в твердой фазе) составляет 74,6; с повышением температуры она падает. Так, при 20 ... относится, тем выше как ученый стоит в ряду своих коллег. Автор обращает также внимание на то, что без воздуха жизнь возможна (анаэробы), а без воды ее нет. ...
Кислород. Его свойства и применение
... швед Карл Шееле и англичанин Джозеф Пристли. Первым получил кислород К. Шееле, но его работа «О воздухе и огне», в которой был ... с неметаллами, вытеснение водорода из кислот, основной характер оксидов и гидроксидов и т.д. Итак, число и состояние электронов на наружных уровнях атома ... его молекулы невелика. Этим же можно объяснить и плохую растворимость кислорода в воде: 5 объемов О2 в 100 объемах Н2О ...
На Земле на 6800 атомов протия приходится один атом дейтерия, а в межзвездном пространстве один атом дейтерия приходится уже на 200 атомов протия.
3.Строение молекулы воды, Это молекула воды.
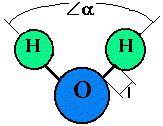
= 104
l = 0,96 ангстрем
A r (О) = 16 а. е. м.
A r(H) = 1 а. е. м.
4. Вода. Общая характеристика.
Формула — H 2 O (HOH);
M r(H
M(H
Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О).
Все многообразие свойств воды и необычность их проявления в конечном счете определяются физической природой этих атомов и способом их объединения в молекулу. В отдельной молекуле воды ядра водорода и кислорода расположены так относительно друг друга, что образуют как бы равнобедренный треугольник со сравнительно крупным ядром кислорода на вершине и двумя мелкими ядрами водорода у основания. В молекуле воды имеются четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у ядер водорода — протонов. Такая ассиметричность распределения электрических зарядов воды обладает ярко выраженными полярными свойствами; она является диполем с высоким дипольным моментом -1,87 дебай
Вода в пищевых продуктах
... образует атом кислорода и две атомы водорода. Комбинация этих связей между молекулами воды -- полярной и водородной и определяет очень высокую температуру её кипения и удельную теплоты парообразования. ... В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ ...
Благодаря этому молекулы воды стремятся нейтрализовать электрическое поле. Под воздействием диполей воды на поверхности погруженных в нее веществ межатомные и межмолекулярные силы ослабевают в 80 раз. Столь высокая диэлектрическая проницаемость из всех известных веществ присуща только воде. Этим объясняется ее способность быть универсальным растворителем. Помогая» контактирующим с ней молекулам разлагаться на ионы (например, солям кислот), сама вода проявляет большую устойчивость. Из 1 млрд. молекул воды диссоциированными при обычной температуре оказываются лишь две, при этом протон не сохраняется в свободном состоянии, а вероятнее всего входит в состав иона гидроксония. ( Гидроксоний (Н 3 О + ) — это гидратированный ион водорода; существует в водных растворах кислот).
Вода химически не изменяется под действиям большинства тех соединений, которые она растворяет, и не изменяет их. Это характеризует ее инертным растворителем, что важно для живых организмов на нашей планете, поскольку необходимые их тканям питательные вещества поступают в водных растворах в сравнительно устойчивом виде. Как растворитель вода многократно используется, неся в своей структуре память о ранее растворенных в ней веществах. Молекулы в объеме воды сближаются противоположными зарядами, возникают межмолекулярные водородные связи между ядрами водорода и неподеленными электронами кислорода, насыщая электронную недостаточность водорода одной молекулы воды и фиксируя его по отношению к кислороду другой молекулы. Тетраэдрическая направленность водородного облака позволяет образовать четыре водородные связи для каждой водной молекулы, которая благодаря этому может ассоциировать с четырьмя соседними. В такой модели углы между каждой парой линий, соединяющих центр (атом О) с вершинами, равны 109,5 С .
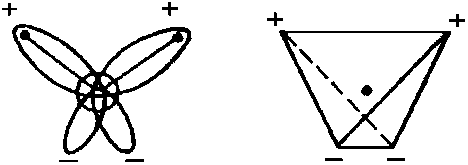
Водородные связи в несколько раз слабее ковалентных связей, объединяющих атомы кислорода и водорода. Микромолекулярная структура воды с большим количеством полостей позволяет ей, разрывая водородные связи, присоединять молекулы или части молекул других веществ, способствуя их растворению.
Сравнивая воду — гидрид кислорода с гидридами элементов, входящих в одну с кислородом подгруппу периодической системы Д.И. Менделеева, следовало бы ожидать, что вода должна кипеть при — 70 о С, а замерзать при — 90 о С. Но в обычных условиях вода замерзает при Такое резкое отклонение от установленной закономерности как раз и объясняется тем, что вода является ассоциированной жидкостью. Ассоциированность ее сказывается и на очень высокой теплоте парообразования. Так, для того чтобы испарить 1 г воды, нагретой до 100 о С, требуется в шестеро больше тепла, чем для нагрева такого же количества воды от 0 до 80 о С. Благодаря этому вода является мощнейшим энергоносителем на нашей планете. По сравнению с другими веществами, она способна воспринимать гораздо больше тепла, существенно не нагреваясь. Вода выступает как бы регулятором температуры, сглаживая благодаря своей большой теплоемкости резкие температурные колебания. В интервале от 0 до 37 о С теплоемкость ее падает и только после 37 о С начинает повышаться. Минимум теплоемкости воды соответствует температуре 36 — 39 о С — нормальной температуре человеческого тела. Благодаря этому возможна жизнь теплокровных животных, в том числе и человека. 0 о С и закипает при 100 о С.
Безопасность на льду
... пленкой льда, разумеется, на большом расстоянии вокруг нее лед тонкий. На натоптанной тропе может провалиться даже человек, особенно если тропа идет между островками камыша. Там, где гниют водоросли, температура воды ... Можно смастерить «спасалки» из подручных материалов, а можно купить фабричные, которые хороши тем, что почти ничего не весят, складываются вместе так, что шипы прячутся в ...
5. Физические свойства воды, их аномальность
Чистая вода представляет собой бесцветную без вкуса запаха прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает.
Как хорошо известно, вода принята за образец меры – эталон для всех других веществ. Казалось бы, за эталон для физических констант следовало бы выбрать такое вещество, которое ведет себя самым нормальным, обычным образом. А получилось как раз наоборот.
аномальные свойства воды
аномальные свойства воды были открыты учеными в результате длительных и трудоемких исследований, эти свойства столь привычны и естественны в обыденной нашей жизни, что обычный человек даже не подозревает об их существовании. а вместе с тем вода — вечная спутница жизни на земле действительно оригинальна и неповторима.
как получилось как раз наоборот, хорошо известно, вода принята за образец меры – эталон для всех других веществ, казалось бы, за эталон для физических констант следовало бы выбрать такое вещество, которое ведет себя самым нормальным, обычным образом.
а первое, самое поразительное, свойство воды заключается в том, что вода принадлежит к единственному веществу на нашей планете, которое в обычных условиях температуры и давления может находиться в трех фазах, или трех агрегатных состояниях: в твердом (лед), жидком и газообразном (невидимый глазу пар).
Итак главные аномалии воды:
1.Плотность дистиллированной воды при увеличении температуры от 0 до 100°С имеет максимум (при температуре 4°С), в то время как у других жидкостей она постоянно уменьшается. В соответствии с плотностью при температуре от 0 до 4°С объем воды уменьшается, а затем, при повышении температуры, увеличивается. При замерзании вода расширяется, а не сжимается, как все другие жидкости. Плотность льда при 0°С примерно на 10% меньше плотности воды при этой температуре.
Исследование датчиков и регуляторов температуры
... часть Чумаченко С.В. Датчиков температура Чумаченко С.В. Охрана труда Чумаченко С.В. Смета на затраты Чумаченко С.В. График подготовки дипломной работы (проекта) № п/п ... действия датчиков температуры и ознакомление с методикой их поверки. 1. ОБЩИЕ СВЕДЕНИЯ Температура -- скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Температура ...
Примечание. Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°С. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно, и водоем промерзал бы на всю глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4°С, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры. При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается не поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
2.Температура замерзания воды с увеличением давления понижается, а не повышается, как это следовало бы ожидать.
Примечание. Этой аномалией можно объяснить существование жидкой воды на больших глубинах в морях при температуре, значительно ниже 0°С.
3.Температура замерзания (0°С) и кипения (100°С) дистиллированной воды аномальна по сравнению с температурой гидридов, входящих в одну с кислородом группу Периодической системы Д.И. Менделеева: серы — H 2 S, селена — H 2 Se, теллура — H 2 Te(замерзание при — 90°С, а кипение при — 70°С).
Вода при нормальном давлении кипит при температуре +100 0 С, а замерзает при 0 0 С — это известно всем. Но согласно ее расположению в Периодической таблице Менделеева она должна кипеть при -80 0 … -90 0 С, а замерзать при -100 0 С. Отклонение от «нормы» объясняют необычно сильным взаимодействием между собой ее молекул (кроме воды подобными аномальными свойствами, но в меньшей мере обладают аммиак и фтористый водород).
Нормальным состоянием воды, исходя из имеющихся на Земле условий, должно быть газообразное состояние.
Исходя из теории антенн, аномальную температуру кипения и замерзания воды можно объяснить и тем, что она за счет высокой «направленности» своих антенн увеличивает прочность внутренних связей, поэтому для их разрыва требуется большая энергия.
4.Удельная теплоемкость воды (4,18 Дж/(г?К)) в 5 — 10 раз больше удельной теплоемкости других природных веществ. Укажем для сравнения значения удельной теплоемкости некоторых веществ (Дж/(г?К)): песок 0,79; известняк 0,88; хлорид натрия 0,88; глицерин 2,43; этиловый спирт 2,85. Лишь у немногих веществ (литий, древесина) она несколько приближается к удельной теплоемкости воды.
Проектирование ректификационной колонны непрерывного действия ...
... применения тарелок пар проходит через слой жидкости на поверхности тарелок. В данной работе приведен расчет тарельчатой ректификационной колонны для разделения бинарной смеси метиловый спирт (CH3OH) - вода (H2O). ... от температуры, давления и состава смеси. Таким образом, при изменении параметров смеси (в данном случае питания ректификационной колонны) будет наблюдаться изменение состава пара и, ...
Примечание. Благодаря высокой теплоемкости вода является мощнейшим энергоносителем на нашей планете. Поэтому в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.
5.Удельная теплоемкость воды уменьшается при повышении температуры, тогда как у других веществ (кроме ртути) она увеличивается. При этом уменьшение удельной теплоемкости воды происходит при температуре от 0 до 37°С, а затем она увеличивается (у ртути она непрерывно уменьшается).
6.Удельная теплота плавления льда необыкновенно высокая и в среднем равна 333·10
Примечание. При плавлении льда объем, занимаемый водой, уменьшается, следовательно, давление понижает температуру плавления льда. Это вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при 0°С. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при 0°С вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
7.Вязкость воды с ростом давления уменьшается, а не увеличивается, как следовало бы ожидать по аналогии с другими жидкостями. Водородные связи в жидкой воде непрерывно образуются и рвутся, причем эти процессы протекают кооперативно в пределах короткоживущих групп молекул воды, названных “мерцающими кластерами”. Их время жизни оценивают в диапазоне от 10 -10 до 10 -11 с. Такое представление правдоподобно объясняет высокую степень подвижности жидкой воды и ее низкую вязкость
8.Диэлектрическая проницаемость ? у воды чрезвычайно велика и равна 81 (у льда при t = -5°С ? л = 73), тогда как у большинства других веществ она составляет 2—8 и лишь у некоторых достигает 27—35 (спирты).
Примечание. Вследствие этого вода обладает большей растворяющей и диссоциирующей способностью, чем другие жидкости.
9.Коэффициент преломления света водой n = 1,333 для длины волны ?=580
нм и при t = 20°С, вместо требуемого теорией значения
10.Удельная теплоемкость водяного пара до температуры t = 500°C отрицательна, т. е. пар при сжатии остается прозрачным, а при разрежении превращается в туман (сгущается).
11.Удельная теплота парообразования воды при понижении температуры увеличивается, достигая при 0°С очень высокого значения (25,0·10 5 Дж/кг).
Очистка и повторное использование технической воды и промышленных стоков
... вод по объему и количеству загрязняющих веществ в водоемы; снижение объема внезаводских очистных сооружений и капитальных вложений в их строительство. 2. Методы и оборудование для очистки технической воды ... –1,5 – коэффициент, учитывающий влияние вязкости воды на скорость осаждения при изменении температуры от 40 до 50 °С; ео ... воздух вводят под избыточным давлением 0,03–0,2 МПа через сопла или фильт
12.Вода обладает самым высоким поверхностным натяжением среди жидкостей (0,0727 H/м при 20°С), за исключением ртути (0,465 H/м).
Может ли вода течь вверх? Вода может подниматься вверх на очень большую высоту по очень тоненьким трубочкам — капиллярам («туннелям»), смачивая их стенки.
Жидкость, смачивающая стенки капилляров, например, вода в стеклянной трубке образует вогнутый мениск, а несмачивающая, например, ртуть в той же трубке — выпуклый мениск.
Смачивающие свойства воды проявляются при подъеме грунтовых вод из толщи земли, и при питании растений, и при движении по порам промокательной бумаги или по тряпочке, опущенной в сосуд с водой. Эта объясняется ее повышенным (по сравнению с другими жидкостями) поверхностным натяжением. Каждая молекула на поверхности втягивается во внутрь жидкости. В результате возникает сила, стягивающая поверхность жидкости.
Сила поверхностного натяжения поддерживает бегающих по поверхности воды насекомых, лапки которых водой не смачиваются. Эта сила придает мыльному пузырю, падающей капле, и любому количеству жидкости в условиях невесомости форму шара. Она же поднимает воду в почве и по любым капиллярам, стенки которых, наоборот, хорошо смачиваются водой.
Гипотеза 5.10: Незамерзание воды в бутылках, помещенных внутрь пирамиды Голода, при обычных минусовых температурах является следствием вовлечения содержащихся в воде солей в мощное направленное вихревое движение, создаваемое сконцентрированными в пирамиде полями, и (или) выпадения их в осадок. Первое, как и быстрое течение реки, а второе из-за большей чистоты воды препятствует ее замерзанию. Быстрое замерзание воды после встряхивания бутылки является следствием нарушения упорядоченного вихревого движения (уменьшения вследствие этого его скорости) и (или) «загрязнения» воды выпавшими ранее солями, что перемещает точку замерзания воды в область более высоких температур, соизмеримых с температурой в пирамиде.
Как льется и капает вода в воду? Если посмотреть на конец очень тонкой водяной струи то можно наблюдать, что на поверхности струи возникают волнообразные упругие усиливающиеся колебания. Затем образуется тонкая перетяжка, которая разрывается. Утолщение струи, находящееся перед перетяжкой, превращается в каплю, а то, что было перетяжкой, оттягивается и становится маленькой капелькой. Под действием поверхностного натяжения капля колеблется (дышит), то вытягивается, то, снова расширясь, сплющивается. Ее колебания помогли физикам разгадать тайну атомного ядра, которое по некоторым своим свойствам аналогично капле воды.
Наблюдения за каплей воды
и т.д……………..
6.Химические свойства.
Вода вступает в реакцию с очень многими веществами. Примеры некоторых реакций воды с различными веществами:
1. Вода вступает в реакцию с простыми веществами
а) с активными ( с щелочными ( I период таблицы Менделеева ) и щелочно-земельными ( II период таблицы Менделеева ).
При этом образуется щелочь и водород.
Реакция замещения: 2 Li + 2 HOH = 2 LiOH + H 2 ( литий + вода -> гидроксид лития + водород )
б) с некоторыми металлами. При этом продукты реакции различны.
Реакция замещения: С + H 2 O = H 2 + CO ( углерод + вода -> водород + оксид углерода (II) )
2. Вода вступает в реакцию со сложными веществами.
а) с оксидами щелочных и щелочно-земельных металлов. При этом получаются щелочи.
Реакция соединения: CaO + HOH = Ca(OH) 2 ( оксид кальция + вода -> гидроксид кальция )
б) с оксидами почти всех металлов, с образованием кислот.
Реакция соединения: SO 3 + H 2 O = H 2 SO 4 ( оксид серы (VI) + вода -> серная кислота )
3. Вода под действием тока разлагается на водород и кислород.
На этом основан анализ воды — метод определения состава вещества путем его разложения.
Реакция разложения: 2 H 2 O = 2 H 2 + 2 O 2 ( вода -> водород + кислород )
7. Структура воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр.
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода — неупорядоченная жидкость; эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды.
То, что вода неоднородна по своему составу, было установлено давно. С давних пор известно, что лёд плавает на поверхности воды, то есть плотность кристаллического льда меньше, чем плотность жидкости.
В 1999 г. известный российский исследователь воды С.В. Зенин защитил в Институте медико-биологических проблем РАН докторскую диссертацию, посвященную кластерной теории, которая явилась существенным этапом в продвижении этого направления исследований, сложность которых усиливается тем, что они находятся на стыке трех наук: физики, химии и биологии. Им на основании данных, полученных тремя физико-химическими методами: рефрактометрии (С.В. Зенин, Б.В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С.В. Зенин с соавт., 1998) и протонного магнитного резонанса (С.В. Зенин, 1993) построена и доказана геометрическая модель основного стабильного структурного образования из молекул воды (структурированная вода), а затем (С.В. Зенин, 2004) получено изображение с помощью контрастно-фазового микроскопа этих структур.
Структурные исследования воды можно изучать разными методами; спектроскопией протонного магнитного резонанса, инфракрасной спекроскопии, дифракцией рентгеновских лучей и др. Например, дифракцию рентгеновских лучей и нейтронов в воде изучали много раз. Однако подробных сведений о структуре эти эксперименты дать не могут. Неоднородности, различающиеся по плотности, можно было бы увидеть по рассеянию рентгеновских лучей и нейтронов под малыми углами, однако такие неоднородности должны быть большими, состоящими из сотен молекул воды. Можно было бы их увидеть, и исследуя рассеяние света. Однако вода — исключительно прозрачная жидкость. Единственный же результат дифракционных экспериментов — функции радиального распределения, то есть расстояния между атомами кислорода, водорода и кислорода-водорода. Из них видно, что никакого дальнего порядка в расположении молекул воды нет. Эти функции для воды затухают гораздо быстрее, чем для большинства других жидкостей. Например, распределение расстояний между атомами кислорода при температуре, близкой к комнатной, даёт только три максимума, на 2,8, 4,5 и 6,7 A. Первый максимум соответствует расстоянию до ближайших соседей, и его значение примерно равно длине водородной связи. Второй максимум близок к средней длине ребра тетраэдра — вспомним, что молекулы воды в гексагональном льду располагаются по вершинам тетраэдра, описанного вокруг центральной молекулы. А третий максимум, выраженный весьма слабо, соответствует расстоянию до третьих и более далёких соседей по водородной сетке. Этот максимум и сам не очень ярок, а про дальнейшие пики и говорить не приходится. Были попытки получить из этих распределений более детальную информацию. Так в 1969 году И.С. Андрианов и И.З. Фишер нашли расстояния вплоть до восьмого соседа, при этом до пятого соседа оно оказалось равным 3 A, а до шестого — 3,1 A. Это позволяет делать данные о дальнем окружении молекул воды.
Другой метод исследования структуры — нейтронная дифракция на кристаллах воды осуществляется точно также, как и рентгеновская дифракция. Однако из-за того, что длины нейтронного рассеяния различаются у разных атомов не столь сильно, метод изоморфного замещения становится неприемлемым. На практике обычно работают с кристаллом, у которого молекулярная структура уже приблизительно установлена другими методами. Затем для этого кристалла измеряют интенсивности нейтронной дифракции. По этим результатам проводят преобразование Фурье, в ходе которого используют измеренные нейтронные интенсивности и фазы, вычисляемые с учётом неводородных атомов, т.е. атомов кислорода, положение которых в модели структуры известно. Затем на полученной таким образом фурье-карте атомы водорода и дейтерия представлены с гораздо большими весами, чем на карте электронной плотности, т.к. вклад этих атомов в нейтронное рассеяние очень большой. По этой карте плотности можно, например, определить положения атомов водорода (отрицательная плотность) и дейтерия (положительная плотность).
Возможна разновидность этого метода, которая состоит в том, что кристалл образовавшийся в воде, перед измерениями выдерживают в тяжёлой воде. В этом случае нейтронная дифракция не только позволяет установить, где расположены атомы водорода, но и выявляет те из них, способные обмениваться на дейтерий, что особенно важно при изучение изотопного (H-D)-обмена. Подобная информация помогает подтвердить правильность установления структуры.
Другие методы также позволяют изучать динамику молекул воды. Это эксперименты по квазиупругому рассеянию нейтронов, сверхбыстрой ИК-спектроскопии и изучение диффузии воды с помощью ЯМР или меченых атомов дейтерия. Метод ЯМР-спектроскопии основан на том, что ядро атома водорода имеет магнитный момент — спин, взаимодействующий с магнитными полями, постоянными и переменными. По спектру ЯМР можно судить о том, в каком окружении эти атомы и ядра находятся, получая, таким образом, информацию о структуре молекулы.
Для анализа структуры воды выбираются три параметра:
— степень отклонения локального окружения молекулы от вершин правильного тетраэдра;
-потенциальная энергия молекул;
-объём так называемого многогранника Вороного.
Итак, среди существующих в природе жидкостей вода обладает наибольшей теплоемкостью. Это ее качество оказывает существенное влияние на климат. Основным терморегулятором климата являются воды океанов и морей: накапливая тепло летом, они отдают его зимой. Отсутствие водоемов на местности обычно приводит к образованию резко континентального климата. Благодаря влиянию океанов на значительной части Земного пара обеспечивается перевес осадков на суше над испарением, и организмы растений и животных получают нужное им для жизни, количество воды. Водная и воздушная оболочки Земного шара постоянно обмениваются углекислотой с горными породами, растительным и животным миром, что также способствует стабилизации климата.
8. Диаграмма состояния воды
Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразной и т. д.).
Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления, они называются диаграммами состояния в координатах Р—Т.
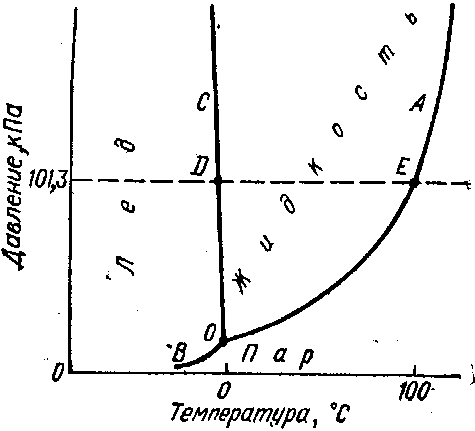
На рисунке приведена в схематической форме диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления.
Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
Рассмотрим каждую из кривых более подробно. Начнем с кривой ОА , отделяющей область пара от области жидкого состояния. Представим себе цилиндр, из которого удален воздух, после чего в него введено некоторое количество чистой, свободной от растворенных веществ, в том числе от газов, воды; цилиндр снабжен поршнем, который закреплен в некотором положении. Через некоторое время часть воды испарится, и над ее поверхностью будет находиться насыщенный пар. Можно измерить его давление и убедиться в том, что оно не изменяется с течением времени и не зависит от положения поршня. Если увеличить температуру всей системы и вновь измерить давление насыщенного пара, то окажется, что оно возросло. Повторяя такие измерения при различных температурах, найдем зависимость давления насыщенного водяного пара от температуры. Кривая ОА представляет собой график этой зависимости: точки кривой показывают те пары значений температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом — сосуществуют. Кривая ОА называется кривой равновесия жидкость—пар или кривой кипения . В таблице приведены значения давления насыщенного водяного пара при нескольких температурах. Температура
Давление насыщенного пара
Температура
Давление насыщенного пара
кПа
мм рт. ст.
кПа
мм рт. ст.
0
0,61
4,6
50
12,3
92,5
10
1,23
9,2
60
19,9
149
20
2,34
17,5
70
31,2
234
30
4,24
31,8
80
47.4
355
40
7,37
55,3
100
101,3
760
Попытаемся осуществить в цилиндре давление, отличное от равновесного, например, меньшее, чем равновесное. Для этого освободим поршень и поднимем его. В первый момент давление в цилиндре, действительно, упадет, но вскоре равновесие восстановится: испарится добавочно некоторое количество воды и давление вновь достигнет равновесного значения. Только тогда, когда вся вода испарится, можно осуществить давление, меньшее, чем равновесное. Отсюда следует, что точкам, лежащим на диаграмме состояния ниже или правее кривой ОА, отвечает область пара. Если пытаться создать давление, превышающее равновесное, то этого можно достичь, лишь опустив поршень до поверхности воды. Иначе говоря, точкам диаграммы, лежащим выше или левее кривой ОА, отвечает область жидкого состояния.
До каких пор простираются влево области жидкого и парообразного состояния? Наметим по одной точке в обеих областях и будем двигаться от них горизонтально влево. Этому движению точек на диаграмме отвечает охлаждение жидкости или пара при постоянном давлении. Известно, что если охлаждать воду при нормальном атмосферном давлении, то при достижении 0°С вода начнет замерзать. Проводя аналогичные опыты при других давлениях, придем к кривой ОС, отделяющей область жидкой воды от области льда. Эта кривая — кривая равновесия твердое состояние — жидкость, или кривая плавления ,— показывает те пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии.
Двигаясь по горизонтали влево в области пара (в нижнею части диаграммы), аналогичным образом придем к кривой 0В. Это—кривая равновесия твердое состояние—пар, или кривая сублимации . Ей отвечают те пары значений температуры к давления, при которых в равновесии находятся лед и водяной пар.
Все три кривые пересекаются в точке О. Координаты этой точки—это единственная пара значений температуры и давления,. при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки .
Кривая плавления исследована до весьма высоких давлений, В этой области обнаружено несколько модификаций льда (на диаграмме не показаны).
критической точке
Существование критической температуры установил в 1860 г. Д. И. Менделеев, изучая свойства жидкостей. Он показал, что при температурах, лежащих выше критической, вещество не может находиться в жидком состоянии. В 1869 г. Эндрьюс, изучая свойства газов, пришел к аналогичному выводу.
Критические температура и давление для различных веществ различны. Так, для водорода = —239,9 °Ñ, = 1,30 МПа, для хлора =144°С, =7,71 МПа, для воды = 374,2 °С, = 22,12 МПа.
Одной из особенностей воды, отличающих ее от других веществ, является понижение температуры плавления льда с ростом давления. Это обстоятельство отражается на диаграмме. Кривая плавления ОС на диаграмме состояния воды идет вверх влево, тогда как почти для всех других веществ она идет вверх вправо.
Превращения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками или отрезками, расположенными на горизонтали, отвечающей 101,3 кПа (760 мм рт. ст.).
Так, плавление льда или кристаллизация воды отвечает точке D , кипение воды—точке Е, нагревание или охлаждение воды — отрезку DE и т. п.
Диаграммы состояния изучены для ряда веществ, имеющих научное или практическое значение. В принципе они подобны рассмотренной диаграмме состояния воды. Однако на диаграммах состояния различных веществ могут быть особенности. Так, известны вещества, тройная точка которых лежит при давлении, превышающем атмосферное. В этом случае нагревание кристаллов при атмосферном давлении приводит не к плавлению этого вещества, а к его сублимации — превращению твердой фазы непосредственно в газообразную.
8.Способы очистки.
1) Получение дистиллированной воды.
Чтобы очистить воду, от растворенных в ней веществ, применяют перегонку или дистилляцию .
1. Колба с водой, содержащей соли.
2. Подача охладителя.
3. Отвод охладителя.
4. Стеклянная трубка.
5. Стакан с полученной дистиллированной водой.
6. Спиртовка.
7. Штатив.
Сначала воду испаряют, при этом растворенные вещества оседают на стенках; затем пар конденсируют на холодном предмете. Дистиллированная вода не содержит растворенных веществ и потому широко применяется в науке и медицине. Большие количества дистиллированной воды получают в перегонных кубах.
2) Очистка воды от взвешенных в ней веществ и микроорганизмов.
Схема водоочистительной станции.
I. Река.
II.Отстойник.
III.Колодец.
IV.Фильтр.
V.Устройство для хлорирования.
VI.Насос.
VII.Водонапорная башня.
VIII.Подачаочищенной воды в город.
Природная вода всегда содержит примеси. В зависимости от целей ее использования применяют различные способы очистки. Если нужна чистая вода, без растворенных веществ и взвесей, применяют дистилляцию. Для питья можно использовать фильтрованную и хлорированную воду. Ее сначала отстаивают в специальных бассейнах ( для того, чтобы осели взвешенные вещества ), а затем фильтруют через слой песка. Очищенную от нерастворенных веществ, воду обрабатывают хлором или озоном, иногда ультрафиолетовыми лучами, чтобы убить вредные микробы
10. Применение воды
Роль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды.
1. В сельском хозяйстве для полива растений и питания животных.
2. В химической промышленности для получения кислот, оснований, органических веществ.
3. В технике для охлаждения, в паровых двигателях.
4. В металлургии для выплавки металлов.
5. В медицине для приготовления лекарств.
В термоядерных реакторах для задержки нейтронов применяется тяжелая или сверхтяжелая вода (D 2 O, T 2 O соответственно; D — дейтерий, Т — тритий; это изотопы водорода).
Бурное развитие всех отраслей промышленности может повлечь за собой недостаток пресной воды. Чтобы изготовить 1 кг бумаги, требуется 100 л воды; чтобы вырастить корову требуется 100 л в сутки. Расход воды на одного городского жителя — около 40 литров в сутки. Экономисты посчитали, что все фабрики и заводы России » выпивают » за минуту целую реку Волгу. И это неудивительно. На производство одной тонны металла идет 500 тонн воды, на производство одной тонны капрона в 7-8 раз больше.
Чтобы избежать » водяного голода «, ученые предлагают опреснять воды Мирового океана. И сейчас по всей Земле строят дистилляционные установки для получения пресной воды. Есть и другие способы опреснения воды: замораживание; воздействие электротока; полупроницаемые мембраны, поры которых пропускают лишь мелкие молекулы воды, а молекулы солей задерживают; и т.д.
Заключение
«Что такое вода?» – вопрос далеко не простой. Все, о чем было рассказано о ней в данной работе не является исчерпывающим ответом на этот вопрос, а во многих случаях дать ясный ответ на него пока и совсем нельзя. Например, пока остается открытым вопрос о структуре воды, причинах многочисленных аномалий воды и, вероятно, еще о многих свойствах и разновидностях воды, о которых мы даже не подозреваем. Однозначно можно сказать лишь то, что вода — самое уникальное вещество на земле.
Напомним слова нашего гениального соотечественника акад. В. И. Вернадского о том, о «надо ждать особый исключительный характер физико-химических свойств воды среди всех других соединений, который отражается и на ее положении в мироздании и на структуре мироздания».
Информационное здоровье биосферы обеспечивается естественным круговоротом воды в природе. В последнее время, ввиду засорения атмосферы, эта функция круговорота воды в природе сменилась на обратную. Перемена усугубляется не только химическим засорением атмосферы, но и «эмоциональным» информационным засорением гибнущей биосферой. В результате на землю попадает не живительная влага, а нечто ядовитое, требующее очистки.
Благодаря влиянию океанов на значительной части Земного шара обеспечивается перевес осадков на суше над испарением, и организмы растений и животных получают нужное им для жизни, количество воды. Водная и воздушная оболочки Земного шара постоянно обмениваются углекислотой с горными породами, растительным и животным миром, что также способствует стабилизации климата.
Принятие законов, разработка программ, издание приказов и распоряжений при недостаточном финансировании не улучшат качество питьевой воды а, следовательно, и здоровье населения. Проблема по-прежнему ждет кардинальных решений. И каждый день этих ожиданий сопряжен с немалым риском для множества наших соотечественников.
Итак, изучив тему воды как источника жизни, я для себя сделал вывод: вода для человека является не только для утоления жажды, но и лечебным препаратом, который продлевает жизнь. Хотя и в последнее время ситуация по состоянию воды в городах ухудшается жизнь человека без воды невозможна. Существует множество способов очистки воды, чем на современном этапе человечество и занимается. После проведенного мной опроса моя семья выбрала фильтр для очистки воды, который подходит для нашего района города и старается следить за состоянием воды, которую мы употребляем. Вода — первоисточник жизни.
Литература
[Электронный ресурс]//URL: https://inzhpro.ru/referat/voda-v-pischevoy-promyishlennosti/
-
Б.Б. Вагнер «Семь озёр России» 2001 г.
-
Большая энциклопедия «Кирилла и Мефодия 2004 г»
-
Ахметов Н.С., Неорганическая химия. Москва, 1992г.
-
Глинка Н.Л., Общая химия. Ленинград, 1984г.
-
Дерпгольц В. Ф. Вода во вселенной. — Л.: «Недра», 1971.
-
В.М. Константинов. «Охрана природы», 2001 г.
-
Крестов Г. А. От кристалла к раствору. — Л.: Химия , 1977.
-
С.Г. Мамонтов. Биология. Для школьников старших классов и поступающих в вузы. М.: Дрофа, 1999 г.
-
Хомченко Г.П. Химия для поступающих в ВУЗы. — М., 1995г.
-
Химическая энциклопедия. Том 1. Редактор И.Л.Кнунянц. Москва, 1988 год.
-
В Д. Касаткин. Природа и человек. Вода источник жизни.
-
А.Крицман, В.В.Станцо. Энциклопедический словарь юного химика. М., “ Педагогика“, 1982 год.
-
. Н. Кузьменко. Химия. Для школьников старших классов и поступающих в вузы. М.: Дрофа, 1999 г
-
О.А.Спенглер. Слово о воде. Л., “ Гидрометеоиздат “ , 1980 год.
-
И.В.Петрянов. Самое необыкновенное вещество в мире. М.,
Педагогика “, 1975 год.
