В общей системе мероприятий по защите металлических изделий, конструкций и сооружений от коррозии занимают защитные покрытия.Различают защитные покрытия на органической и неорганической основе. К первой группе относят лакокрасочные, полимерные и пластмассовые покрытия, ко второй группе – металлические, окисные и солевые покрытия. Как теоретическая основа, так и технология нанесения этих двух групп различна.
Помимо покрытий, предназначенных для защиты основного металла от коррозии, различают защитно-декоративные покрытия. Они не только должны защищать основной металл, но и сообщать его поверхности красивый, часто блестящий вид на протяжении определенного периода эксплуатации.
Довольно широкое применение находят износостойкие покрытия, назначение которых сводится к повышению сопротивляемости трущихся поверхностей механическому износу. Такие покрытия часто используются для защиты цилиндров двигателей внутреннего сгорания автомобилей, тракторов, авиационных моторов и других подобных агрегатов.
Покрытия из металлов и сплавов сообщают поверхности изделий определенные оптические, магнитные, антифрикционные и другие физико-механические свойства. В электронной и приборостроительной промышленностях применяются покрытия из драгоценных металлов – при производстве полупроводниковых приборов и различного рода электрических контактов, когда наряду с химической стойкостью требуется сообщить высокую электропроводность, низкое и постоянное переходное электрическое сопротивление и целый ряд других свойств.
Выбор вида покрытия и его толщины определяется назначением изделия, материалов, из которого оно сделано, условиями эксплуатации. При этом учитываются назначение и свойства покрытия, допустимость контактов сопрягаемых металлов и экономическую целесообразность.
1.2 Требования к покрытиям.
В зависимости от назначения покрытий, к ним предъявляют различные требования. Предъявляемые требования в значительной степени удовлетворяются при надежной подготовке основного металла, правильном выборе типа электролита и оптимальной концентрации компонентов электролита, а также надлежащем выборе режима электролиза. Однако, независимо от назначения, общим требованием, которому должны соответствовать все покрытия, является прочное сцепление с основой. Другими требованиями, предъявляемыми к покрытиям, является мелкая структура осадка, а при нанесении блестящих покрытий, они должны блестеть без полировки. Покрытия должны иметь максимально равномерную толщину на различных участках (выступах и углублениях), т.к. толщина является важнейшей характеристикой покрытия, определяющая срок его защитного действия. Покрытия должны иметь минимум пор (даже микроскопических размеров).
Коррозия металлов и средства защиты от нее
... защита металлических конструкций от коррозии определяется агрессивностью условий их эксплуатации. Наиболее надежными защитными системами металлических конструкций являются алюминиевые и цинковые покрытия. Скорость коррозии: Скорость коррозии металлов ... тому, что металл, находящийся в контакте с коррозионно- ... воздействия на металлы коррозионные среды целесообразно разделить на: 1)неагрессивные; ...
Это требование не так существенно при нанесении анодных покрытий. Анодным является покрытие, металл которого имеет более электроотрицательный потенциал, чем металл изделия. В результате коррозии разрушается такое покрытие, а не металл подложки. Существуют катодные покрытие (металл покрытия электроположительнее металла основы).
Эти покрытия защищают чисто механически. Они должны быть беспористыми, т.к. коррозионная среда, проникая через поры к основному металлу, разрушают его. Катодное покрытие при наличии пор даже ускоряют коррозионный процесс. Защитные свойства таких покрытий можно повысить за счет многослойности.
2. ОСАЖДЕНИЕ СПЛАВОВ.
Часто в промышленности используются покрытия, состоящие не из чистых металлов, а из сплавов. Некоторые металлы вообще не осаждаются в чистом виде, а только совместно с другими металлами. Электроосажденные сплавы часто отличаются рядом ценных свойств: повышенной стойкостью против коррозии, повышенной твердостью, магнитными, антифрикционными свойствами, приятным внешним видом и др.
Несмотря на принципиальную возможность, установленную в лабораторных условиях, электролитического осаждения различных сплавов, широкое промышленное применение получили: латунирование, бронзирование, сплавы золота, сплавы олова, магнитные сплавы. Такое положение, по-видимому, связано, с одной стороны, большой сложностью осаждения сплавов по сравнению с осаждением чистых металлов, с другой – недостаточным изучением самого механизма процесса осаждения сплавов.
Главными факторами, определяющими принципиальную возможность осаждения двух и более металлов и относительный состав сплава, являются:
1. величины равновесных потенциалов каждого металла в данном электролите;
2. катодная поляризация каждого металла;
3. относительная концентрация ионов каждого осаждаемого металла, особенно в прикатодном пространстве;
4. перенапряжение водорода на осаждающемся сплаве;
5. режим электролиза – температура, плотность тока, перемешивание, наличие в растворе коллоидов или других ПАВ.
Влияние каждого фактора может быть учтено, но чрезвычайно трудно предвидеть эффект от одновременного изменения двух или более параметров.
В растворах простых солей лишь немногие металлы имеют близкие значения стандартных равновесных потенциалов. Отсюда возникает необходимость максимально сблизить потенциалы осаждаемых металлов.
Равновесный потенциал определяется следующим уравнением:
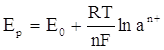
где:
Е р – равновесный потенциал;
Е 0 – стандартный потенциал;
- R – газовая постоянная;
- Т – абсолютная температура;
- n – валентность;
- F – число Фарадея;
а n + – активность ионов.
В этом уравнении величины стандартного потенциала, газовой постоянной и числа Фарадея – это постоянные, валентность в данной электролите тоже величина постоянная. Т.к. в данном уравнении фигурирует абсолютная температура, то ее повышение на несколько десятков градусов существенно не изменит величину равновесного потенциала. На активность ионов в растворах простых солей практически невозможно повлиять путем изменения концентрации, т.к. увеличение концентрации в 10 раз увеличивает потенциал на 0,057 В (для одновалентных ионов) или на 0.029 В (для двухвалентных ионов).
Современные методы очистки сточных вод от ионов тяжелых металлов
... кислотно-щелочных сточных вод, содержащих смесь металлов, не всегда удается выдержать оптимальные условия осаждения и, соответственно, достичь необходимой степени очистки /11, 13/. Более глубокая очистка от ионов тяжелых металлов достигается при использовании ...
Совершенно очевидно, что для сближения потенциалов, стандартные значения которых отличается на десятые доли вольта или вольт, недостаточно прибегнуть к сильному повышению или понижению концентрации ионов в электролите. Повышать концентрацию ионов в электролите на много порядков нельзя из-за ограниченности растворимости солей, а уменьшать концентрацию ионов путем разбавления раствора тоже нельзя.
Единственная возможность сближения равновесных потенциалов, стандартные значения которых отличаются на 0,5 ¸ 1,0 В, сводится к связыванию разряжающихся ионов в комплексы. При этом более благородный металл связывается в более прочный комплекс и наоборот. Часто прибегают к цианидам щелочных металлов для сближения равновесных потенциалов, стандартные значения которых сильно различаются. Т.к. цианид является сильным ядом, то было предпринято много попыток заменить его другими комплексообразователями, но, в большинстве случаев, неудачно. Однако есть металлы, когда один или оба осаждаемых металла не могут образовывать прочных цианистых комплексов, тогда приходится использовать другие электролиты. Например, олово осаждается из щелочного электролита.
При осаждении сплавов необходимо учитывать не только величину разности равновесных потенциалов, но и величину поляризации при соответствующих плотностях тока.
Помимо сближения потенциалов, как равновесных, так и катодных, необходимо заботится об устойчивости электролита, о возможности применения в нем высоких плотностей тока, о нормальном течении анодного процесса, поддержании постоянства электролита и ряде других показателей, характеризующих процесс.
Катодная поляризация отдельных компонентов сплава часто играет значительную роль с точки зрения возможности осаждения сплава и количественного соотношения их в сплаве. Катодный потенциал включает значение равновесного потенциала и величину поляризации.
Е к = Ер + DЕ = 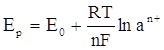 + DЕ
+ DЕ
Электролитическое осаждение сплавов не всегда протекает с теоретическим выходом по току, для вычисления которого необходимо исходить из электрохимического эквивалента сплава. Процесс часто сопровождается выделением водорода, который не только сказывается на выходе по току и качестве покрытия, но и оказывает влияние на состав сплава. Это происходит потому, что выделяющийся водород перемешивает прикатодный слой электролита и изменяет концентрацию ионов осаждаемых металлов.
Если равновесные потенциалы двух металлов достаточно близки, но процесс разряда ионов с более электроотрицательным потенциалом сопровождается более высокой поляризацией, то выделение металла затруднено. При достаточно большой разнице потенциалов для ионов металла с более электроотрицательным потенциалом, но с большей поляризацией, выделение сплава облегчается по мере повышения плотности тока. Причем процентное содержание металла с более электроотрицательным потенциалом увеличивается по мере повышения плотности тока.
Гальваническому покрытию сплавами часто подвергаются сильно профилированные изделия. На различных участках поверхности таких изделий устанавливается различная плотность тока. Поэтому нужно, чтобы с изменением плотности тока состав сплава и его внешний вид сильно не менялись и чтобы на участках с минимальной плотностью тока осаждался сплав нужного состава. Эти условия выполняются при достаточной близости компонентов сплава.
Химический состав электроосаждаемых сплавов зависит от соотношения в электролите, особенно в прикатодном слое, концентраций солей осаждающихся металлов. Увеличение концентрации соли одного из металлов приводит к увеличению процентного состава этого металла. Это увеличение не пропорционально. В некоторых случаях для увеличения содержания металла в сплаве на 5 – 10 % необходимо увеличить концентрацию соли в несколько раз. В других случаях даже незначительное повышение концентрации соли ведет к резкому увеличению содержания металла в сплаве.
3. ОСАЖДЕНИЕ СПЛАВА ОЛОВО-СВИНЕЦ
Оловянно-свинцовые сплавы имеют светло серый цвет. Покрытия такими сплавами легко паяются и сохраняют способность к пайке длительное время (в отличие от чистого олова).
Такие покрытия также хорошо обеспечивает спекание деталей. Покрытия оловянно-свинцовыми сплавами применяют для защиты изделий от коррозии в морской воде и ряде других агрессивных сред.
Сплав может быть осажден в весьма широких диапазонах по составу. Наибольшей химической стойкостью обладает сплав с содержанием свинца и олова по 50 %. Оловянно-свинцовые сплавы с содержанием олова от 5 до 17 % применяют как антифрикционные, особенно в сочетании с маслами, где чистый свинец легко растворяется. Покрытия такого состава также выполняют роль смазки при штамповке деталей из листовой стали.
Значительное распространение в промышленности получили сплавы на основе свинца и олова с добавлением легирующих элементов. Эти сплавы применяются, в основном, для работы трущихся деталей в тяжелых условиях, в частности, двигателей внутреннего сгорания, когда коррозионное воздействие топлив и масел при повышенной температуре воздействует на свинец.
Стандартный потенциал олова – 0,136 В.
Стандартный потенциал свинца – 0,126 В.
Катодные и равновесные потенциалы свинца и олова довольно близки, поэтому самоосаждаются из растворов простых солей. Свинец и олово не образуют ни твердых растворов, ни химических соединений.
3.2 Электролиты для осаждения сплавов олово-свинец.
Электрооосаждение покрытий сплавом олово — свинец проводится во фторборатных, кремнийфтористых, пирофосфатных, перхлоратных, сульфаматных и феносульфоновых электролитах.
Наиболее широко используются фторборатные электролиты. В этих электролитах можно получить сплавы любого состава – от чистого свинца до чистого олова путем регулирования состава электролита и режима электролиза. При этом для данного состава электролита большей плотности тока соответствует повышенное содержание олова в катодном осадке, т.к. потенциал свинца несколько благороднее потенциала олова. Выход сплава по току близок к теоретическому из-за высокого перенапряжения водорода на свинце, олове и оловянно — свинцовые сплавах. Олово в электролиты вводят анодным растворением. После приготовления электролиты необходимо проработать током при катодной плотности тока около 2 А/дм 2 .
СОСТАВ (г/л) ФТОРБОРАТНЫХ ЭЛЕКТРОЛИТОВ И РЕЖИМЫ ЭЛЕКТРОЛИЗА ПРИ 18 ¸ 25 °С СПЛАВОВ ОЛОВА СО СВИНЦОМ.
| Электролит |
Pb(BF 4 )2 |
Sn(BF 4 )2 |
HBF 4 |
H 2 BO3 |
Клей столярный |
i, А/дм 2 |
Sn, % (в сплаве) |
| 1 | 50 – 60 | 5 – 10 | 100 – 140 | — | — | 1 – 2 | 5 – 11 |
| 2 | 100 – 200 | 50 – 75 | 100 – 200 | 15 – 25 | 1 – 3 | 1 – 3 | 5 – 17 |
| 3 | 100 – 120 | 30 – 40 | 250 – 300 | 25 – 40 | 1 – 2 | 1 – 2 | 20 – 25 |
| 4 | 15 – 20 | 25 – 30 | 250 – 300 | 25 – 30 | 3 – 5 | 1 – 2 | £ 60 |
В электролите 1 содержится 1 г/л желатина. В электролите 4 содержится 0,8 – 1,0 г/л гидрохинона.
Присутствие клея или другого коллоида в электролите необходимо для получения осадков с мелкокристаллической структурой, а также для обеспечения необходимого содержания олова в осадке. С увеличением содержания клея увеличивается содержание олова в сплаве, а при полном отсутствии клея выделяется один свинец.
Фенолсульоновый электролит применяют для нанесения прочносцепленных оловянно — свинцовых покрытий на подшипниковые сплавы, содержащие олово (баббиты и бронзы).
Прирофосфатные электролиты имеют более высокую рассеивающую способность, чем фторборатные, отличаются простотой приготовления и неагрессивностью. Электролиз ведут обычно при перемешивании. Содержание олова в покрытии увеличивается при увеличении температуры и плотности тока. Выход по току (анодный) может достигать 100%.
Кремнийфтористые электролиты очень дешевы.
ЭЛЕКТРОЛИТЫ ДЛЯ ОСАЖДЕНИЯ СПЛАВОВ СВИНЦА С ОЛОВОМ.
| Электролит | Состав, г/л. | t, °С. |
i, А/дм 2 |
Аноды | Sn, % (в сплаве) |
| Фенолсульфоновый |
Фенолульфоновые: Свинец 100 – 130, Олово 25; Кислота 60 – 90, Желатин 2 |
20 – 40 | 1 – 2 | Сплав с 10 % Sn | 8 – 12 |
| Пирофосфатный |
Нитрат свинца 15 – 18, Пирофосфаты олова 20 – 22, Пирофосфаты натрия 120. |
£ 60 | 0,5 – 4 | Сплав с 10 % Sn | 1 – 12 |
| Кремний фтористый |
Кремнийфториды:
Клей столярный 1 |
18 – 25 | 4 – 5 | Сплав Pb с Sn | 16 – 18 |
4. СПИСОК ЛИТЕРАТУРЫ
[Электронный ресурс]//URL: https://inzhpro.ru/referat/olovo-svintsovogo-splava/
1. Беленький М.А., Иванов А.Ф. Электроосаждение металлических покрытий. Справ. изд. М.: «Металлургия», 1985.
2. Вячеславов П.М. Электролитическое осаждение сплавов. Л.: «Машиностроение», 1986
3. Гальванические покрытия в машиностроении. Справочник/Под ред. Шлугера М.И. М.: «Машиностроение», 1985.
4. Зальцман Л.Г., Черная С.М. Спутник гальваника. К.:1989.
5. Каданер Л.И. Гальваностегия. К: «Техника», 1964.
6. Каданер Л.И. Справочник по гальваностегии. К.: «Техника», 1976.
7. Кудрявцев В.Т. Электролитические покрытия металлами. М.: «Химия», 1979.
8. Лайнер В.И. Защитные покрытия металлов. М.: «Машиностроение», 1974.
9. Лайнер В.И. Современная гальванотехника. М.: «Металлургия», 1967.
10. Томашов Н.Д., Чернова Г.П. Коррозия и коррозионностойкие сплавы. М.: «Металлиргия», 1973.
11. Федотьев Н.Б. Бибикова Н.Н. Вячеславов П.М. Грихиес С.Я. Электролитические сплавы. М.: «Машгиз», 1961.
12. Ямпольский А.М. Ильин В.А. Краткий справочник гальванотехника. Л.: «Машиностроение», 1981.
| Кафедра xxx Аттестационная работа по теме: «НАНЕСЕНИЕ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ ХИМИЧЕСКИМ СПОСОБОМ» на соискание степени бакалавра по направлению xxx …
Существуют также многочисленные рекомендации составов растворов для нанесения химических покрытий олова , хрома, свинца и некоторых сплавов . Детали из меди и ее сплавов перед осаждением на них покрытий из цианистых электролитов можно обрабатывать в течение 0,5-1,0 мин на аноде при плотности тока 3-5 А/дм 2 в электролите … |
Раздел:
Тип: дипломная работа |
| … Кафедра «ХМ и ЭП» КУРСОВОЙ ПРОЕКТ по дисциплине: Основы электрохимических технологий на тему: «Технология электроосаждения цинкового покрытия »
Восстановление этих ионов протекает при более отрицательном потенциале , чем восстановление простых гидратированных ионов , но с повышением плотности тока катодный потенциал … Например, покрытие сплавом медь-цинк с массовой долей меди 50…60% и цинка 40…50% обозначают М-Ц (60); покрытие сплавом медь-олово —свинец с массовой долей меди 70…78%, олова … |
Раздел:
Тип: курсовая работа |
| ОГЛАВЛЕНИЕ ВВЕДЕНИЕ 2 ХИМИЧЕСКАЯ КОРРОЗИЯ 3 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ ПОД ДЕЙСТВИЕМ ВНУТРЕННИХ МАКРО- И МИКРОГАЛЬВАНИЧЕСКИХ ПАР 7 ЭЛЕКТРОХИМИЧЕСКАЯ …
Если возникновение разности потенциалов вызвано применением эвтектических сплавов , состоящих из металлов различной активности, то не всегда можно руководствоваться данными по … Разработаны определенные режимы осаждения , обеспечивающие эти качества покрытий (температура, плотность тока и состав электролита ).
|
Раздел:
Тип: реферат |
| Часть первая. Общая характеристика IIА группы Периодической Системы элементов. В этой группе располагаются следующие элементы: Be, Mg, Ca, Sr, Ba, Ra …
Поэтому раствором аммиака нельзя полностью осадить гидроокись магния, например из хлорида, т.к. следующий процесс равновесный : Его используют также для раскисления сталей, бронз и других сплавов , очистки свинца и олова от висмута и сурьмы. Также используют для удаления серы из нефтепродуктов и … |
Раздел:
Тип: реферат |
| 1. Литературный обзор 1.1 ОБЩИЕ СВЕДЕНИЯ Хром — элемент 6-й группы периодической системы элементов Д И- Менделеева. Его атомный номер 24, атомная …
F и F-содержащие ионы используются в электролитах холодного хромирования, в том числе ля осаждения покрытий в колокольных и барабанных установках. натрия, сульфиды натрия, феррохромовый шлак, сульфат железа(II), пирит [2, 6 — 9]. Наиболее широко для осаждения металлов используется гидроксид кальция, который осаждает ионы … |
Раздел:
Тип: курсовая работа |
