Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра ОХТ
Технология производства хлористого винила гидрохлорированием ацетилена в газовой фазе
Казань
2008
Теоретическая часть
Технологическая схема производства хлористого винила
Гидрохлорирование ацетилена можно проводить в жидкой или в газовой фазе. При гидрохлорировании ацетилена в газовой фазе в качестве катализатора используют активный уголь, пропитанный солянокислым или водным раствором хлорной ртути (10% от количества угля).
Хлорная ртуть реагирует с ацетиленом, образуя промежуточное ртутьорганическое соединение:
CH H
½½
CH º CH + HgCl 2 ® C = C
½½
H HgCl
При взаимодействии с этим соединением хлористого водорода образуется хлористый винил и регенерируется хлорная ртуть:
Cl H
½½
C = C + HCl ® CHCl = CH 2 + HgCl2
½½
H HgCl
Ацетилен, направляемый на гидрохлорирование, предварительно подвергают осушке, а для удаления влаги из катализатора через него перед гидрохлорированием пропускают хлористый водород. Образующаяся соляная кислота стекает, не вымывая сулему из угля.
В процессе гидрохлорирования применяется синтетический высококонцентрированный хлористый водород, который должен быть тщательно очищен от свободного хлора, так как при реакции ацетилена с хлором происходит взрыв. Благодаря применению концентрированного хлористого водорода оборотный ацетилен значительно меньше разбавляется инертными газами; в связи с этим облегчается конденсация хлористого винила и уменьшаются его потери с отходящими газами. Для наиболее полного связывания ацетилена, присутствие которого в продуктах реакции крайне нежелательно, в исходной газовой смеси должен быть избыток хлористого водорода (5—10 объемн.%).
Технологическая схема синтеза хлористого винила из ацетилена и хлористого водорода в газовой фазе приведена на рисунке 1. Концентрированный ацетилен (97—99%-ный), очищенный от РН 3 , NH3 и других вредных примесей, компрессором 2 нагнетается в систему под избыточным давлением 0,5 ат и охлаждается до 3— 5° С в холодильнике 4 рассолом, циркулирующим в межтрубном пространстве. После отделения в сепараторе 5 от сконденсированной влаги ацетилен поступает на окончательную осушку в аппарат 6, заполненный твердой едкой щелочью. Осушенный ацетилен смешивается с сухим хлористым водородом в смесителе 7. Газовая смесь поступает в трубчатый контактный аппарат 8, предварительно нагретый до 110—120°С горячим маслом, циркулирующим в межтрубном пространстве аппарата.
Производство ацетилена
... В. В. Марковникова. Это правило выполняется, в частности, в реакциях гидрогалогенирования и гидратации алкенов. 1.1 Гидрогалогенирование. При взаимодействии алкенов с хлороводородом или бромоводородом образуются ... может идти в две фазы, причем сначала получаются галоидные производные этиленовых углеводородов: CH2Br-CH2Br > CH2=CHBr + HBr CH2=CHBr > CH?CH + HBr Сам ацетилен может получиться при ...
ккал/моль).
При повышенных температурах хлорная ртуть начинает возгоняться. Так как у входа в реактор реакция протекает наиболее интенсивно, пары сулемы вместе с исходными газами и продуктами реакции начинают перемещаться вдоль катализаторных труб, а в менее горячей части пары сулемы конденсируются. В результате этого создается как бы «подвижный фронт» катализатора. При исчерпывании сулемы из активного угля каталитическая активность понижается и в контактных газах появляется несвязанный ацетилен.
Было предложено для увеличения срока службы катализатора периодически изменять направление движения реакционной смеси на обратное — в этом случае сулема должна была бы перемещаться от одного конца катализаторной трубы к другому, а затем в обратном направлении. Если процесс проводить при температурах до 120°С, потери сулемы в значительной мере уменьшаются.
Появление в контактных газах свободного ацетилена указывает на значительное понижение активности катализатора и на необходимость замены его свежим. Выгрузка отработанного катализатора из контактного аппарата производится пневматически — путем отсасывания через гибкий шланг, присоединенный к вакуумсборнику, через систему циклонов и сепараторов.
В контактном аппарате 8, кроме основной реакции гидрохлорирования, протекают и побочные реакции, в частности образование несимметрического дихлорэтанав результате присоединения хлористого водорода к хлористому винилу по правилу Марковникова:
CHCl = CH 2 = HCl ® CHCl2 ¾ CH3
В результате гидратации ацетилена образуется также некоторое количество ацетальдегида. Поэтому в контактных газах, содержащих примерно 93 вес.% хлористого винила, 5 вес.% хлористого водорода и 0,5 вес.% ацетилена, присутствует 0,3 вес.% паров несимметрического дихлорэтана и 0,3 вес.% ацетальдегида. Эта смесь для удаления хлористого водорода поступает насадочный скруббер 9 из углеродистой стали, футерованный изнутри поливинилхлоридом. В скруббере 10, орошаемом 40%-ным раствором щелочи, из газов удаляется двуокись углерода.
Рисунок 1.
Схема производства хлористого винила газофазным гидрохлорированием ацетилена:
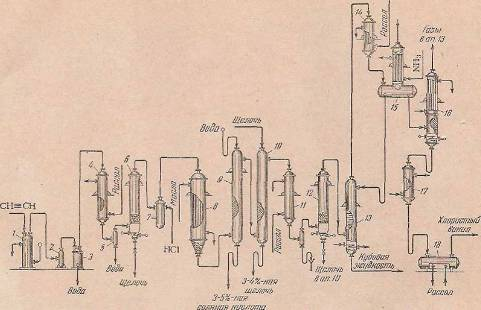
1- гидравлический затвор;
2- ротационный водокольцевой компрессор;
3- водоотделитель;
4, 11, 17- холодильники;
5- сепаратор;
6, 12- аппараты для осушки;
7- смеситель
8- контактный аппарат
9, 10- скрубберы
13- дистилляционная колонна
14- конденсатор
15- аппарат для выделения газа
16- отгонная колонна
18- сборник хлористого винила
После щелочной промывки контактный газ охлаждается до —10°С рассолом (температура рассола —30° С) в холодильнике 11, где происходит вымораживание большей части влаги, и поступает в осушитель 12, заполненный твердой кусковой щелочью. Образующийся раствор щелочи периодически, отводится из нижней части осушителя и используется для промывки газов в скруббере 10. В осушителе 12 контактный газ полностью очищается от влаги и большей части ацетальдегида. Очистку хлористого винила от дихлорэтана и остатков ацетальдегида проводят путем дистилляции в тарельчатой колонне 13, орошаемой жидким хлористым винилом, охлажденным до —30° С. Кубовая жидкость из колонны 13 может быть использована как растворитель.
Выходящий из колонны 13 хлористый винил конденсируется в кожухо-трубном конденсаторе 14, охлаждаемом рассолом (температура рассола —35° С); жидкий хлористый винил самотеком поступает в куб аппарата 15 . Верхняя часть этого аппарата представляет собой колонну-холодильник, охлаждаемую аммиаком, испаряющимся при разрежении и —55°С. Здесь из хлористого винила отгоняются растворенные ацетилен и инертные газы. Из кубовой части аппарата 15 некоторое количество жидкого хлористого винила поступает на орошение колонны 13, а основная часть его перетекает в насадочную колонну 16 для окончательной очистки от ацетилена. Верхняя часть колонны 16 представляет собой рассольный холодильник (температура —30°С).
Выходящий из нее газ, содержащий 1—5% ацетилена, возвращается в колонну 13. Из куба колонны 16 непрерывно вытекает очищенный жидкий хлористый винил. На 1 т 100%-ного хлористого винила, получаемого описанным способом, расходуется около 0,45 г ацетилена, 0,67 т хлористого водорода и 0,2—0,5 кг сулемы. Синтез хлористого винила из ацетилена и хлористого водорода в газовой фазе отличается большими достоинствами (непрерывностью процесса, простотой аппаратурного оформления, высоким коэффициентом использования исходных соединений), однако недостатком этого процесса является относительная дороговизна ацетилена по сравнению с другими исходными углеводородами.
Практическая часть
Материальный баланс процесса
В основу расчета принимаем следующие реакции:
C 2 H2 + HCl ® CHCl = CH2
C 2 H2 +2HCl ® CHCl2 ¾ CH3
C 2 H2 + H2 O ® CH3 ¾ CHO
Условия задачи:
1. Производительность установки по хлорвинилу – сырцу 200 т/сут.
2. Состав хлорвинила сырца % масс.
- хлористый винил 95 %
- дихлорэтан 4,0 %
- ацетальдегид 1,0 %
3. Концентрация ацетилена (примесь CO 2 ) 99 % об.
4. Конверсия ацетилена – 98 %;
5. Избыток НCl по сравнению со стехиометрическим 10 % об.
6. Потери хлористого винила от производительности – 1,5 %.
Решение:
Схема потоков:
 |
C2 H2 ;CO2 ;HCl;H2 O C2 H2 ;CO2 ;HCl;C2 H3 Cl;C2 H4 Cl;CH3 COH
![]()
![]()
![]()
![]()
![]()
![]()
| Приход | Расход | |||
| кг/час | кмоль/час | кг/час | кмоль/час | |
| C 2 H2 | 3553,25 | 136,66 | 71,07 | 2,73 |
| CO 2 | 22,08 | 1,38 | 22,08 | 1,38 |
| HCl | 5429,23 | 148,95 | 493,53 | 13,54 |
| С 2 Н3 Сl | 0 | 0 | 7916,66 + 118,75 | 128,67 |
| C 2 H3 Cl | 0 | 0 | 333,33 | 3,37 |
| C 2 H4 Cl2 | 0 | 0 | 83,33 | 1,89 |
| Н 2 О | 34,02 | 1,89 | 0 | 0 |
| å 1 =9038,58 | å 2 =9038,75 | |||
1) Производительность по хлорвинилу – сырцу 200 т/сут;
m(сырца) = 200·1000/24 = 8333,33кг/час
2)Состав хлорвинила – сырца (производительность:
хлористый винил:
m(C 2 H3 Cl) = 8333,33·95/100 = 7916,66 кг/час;
3) Учитывая потери хлорвинила от производительности 1,5 % масс.
m потери (C2 H3 Cl) = 7916,66·1,5/100 = 118,75 кг/час;
m всего (C2 H3 Cl) = 7916,66 + 118,75 = 8035,41 кг/час;
w всего (C2 H3 Cl) = 8035,41 / 62,45 = 128,67кмоль/час;
4) Состав хлорвинила – сырца:
дихлорэтан:
m (C 2 H4 Cl2 ) = 8333,33·4/100 = 333,33 кг/час;
w (C2 H4 Cl2 ) = 333,33 / 98,9 = 3,37кмоль/час;
ацетальдегид:
m (C 2 H4 О) = 8333,33·1/100 = 333,33 кг/час;
w (C2 H4 О) = 83,33 / 44 = 1,89кмоль/час;
5) Количество ацетилена, пошедшего на образование винилхлорида:
w 1 (C2 H2 ) = w всего (C2 H3 Cl) = 128,67кмоль/час;
6) Количество хлороводорода, пошедшего на образование винилхлорида:
w 1 (HCl) = w 1 (C2 H2 ) = 128,67кмоль/час;
7) Количество ацетилена, пошедшего на образование дихлорэтана:
w 2
8) Количество хлороводорода, пошедшего на образование дихлорэтана:
w 2
9) ацетальдегида
w 3
10) воды:
w (Н2 О) = w 3 (С2 Н2 ) = 1,89 кмоль/час;
m (Н 2 О)=1,89*18=34,02кг/ч
11)Количество С 2 Н2 прореагировавшего:
w 0
m 0 (С2 Н2 )=133,93*26=3482,18кг/час;
12) Учитывая конверсию 98% ацетилена,всего было подано:
3482,18 — 98%
Х — 100%
Х= m всего (С2 Н2 )=3482,18*100/98=3553,25кг/ч
w всего (С2 Н2 )=3553,25/26=136,66кмоль/час
13) Количество и масса непрореагировало ацетилена:
m непр (С2 Н2 )=3553,25-3482,18=71,07кг/час
w непр (С2 Н2 )=71,07/26=2,73
14) Количество хлороводорода,пошедшее на обе реакции:
w 0 (HCl)= w 1 + w 2 =128,67+6,74=135,41кмоль/час
Учитывая избыток по сравнению со стехиометрией 10% об.:
V 0 (HCl)= w 0 (HCl)*22,4=135,41*22,4=3033,18м3 /час
3033,18м 3 /час — 100%
Х — 10%
Х= V изб (HCl)= 3033,18м3 /час*10/100=303,32м3 /час
V всего (HCl)= V0 (HCl)+ Vизб (HCl)=3033,18+303,32=3336,5м3 /час
w изб (HCl)=303,32/22,4=13,54кмоль/ч
m изб (HCl)=13,54*36,45=493,53кг/ч
w всего (HCl)=3336,5/22,4=148,95кмоль/ч
m всего (HCl)=148,95*36,45=5429,23кг/ч
15)Масса и количество примеси углекислого газа в ацетилене 1% об.:
V(С 2 Н2 )= w (С2 Н2 )*22,4=136,66*22,4=3061,18м3 /час
3061,18м 3 /час — 99%
Х — 1%
Х= V(СО 2 )=3061,18*1/99=30,92м3 /час
V(СО 2 )=30,92/22,4=1,38кмоль/час
m(СО 2 )=1,38*44=22,08кг/час
Технологические и технико-экономические показатели процесса
1. Производительность установки установки: 9838.58 кг/ч
2. Конверсия эцетилена: 98 %
3.Фактический выход C 2 H3 Cl:
Q Ф = m(C2 H3 Cl) = 7916.66+118.75 кг;
4.Теоретический выход C 2 H3 Cl:
Mr(С 2 Н2 ) ¾ Mr(C2 H3 Cl), 26 ¾ 62.45,
m под (C2 H2 ) ¾ QТ ; 3553.25 ¾ QТ;
Q Т = 8534.63 кг;
Выход C 2 H3 Clпо ацетилену:
b С2Н2 = QФ / QТ * 100%= 94.15 %
5. Теоретический выход C 2 H3 Cl рассматриваемый, исходя из количество превращенного C2 H2
Mr(C 2 H2 ) ¾ Mr(C2 H3 Cl), 26 ¾ 62.45,
m пр (C2 H2 ) ¾ QТ ‘; 3482.18 ¾ QТ ‘;
Q Т ‘ = 8363.93кг;
b’ C2H2 = QФ / QТ ‘* 100%=96.07%
6. Теоретические расходные коэффициенты по сырью:
по C 2 H2:
s т = Mr(C2 H2 ) / Mr(C2 H3 Cl) = 26/62.45 = 0,416 кг/кг;
по НСl:
s т := Mr(НСl) / Mr(C2 H3 Cl) = 36.45/62.45 = 0.584 кг/кг.
6. Фактические расходные коэффициенты:
по C 2 H2 :
s ф = mтехн (C2 H2 ) / m(C2 H3 Cl) = 3575.33/8035,41 = 0.445 кг/кг;
по НСl:
s ф = mтехн (НСl) / m(C2 H3 Cl) = 5429.23/8035.41 = 0.676 кг/кг.
Список литературы
[Электронный ресурс]//URL: https://inzhpro.ru/referat/atsetilen-i-polivinilhlorid/
1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. М.:Высш. Школа, 2005. 520с.
2. Расчеты химико-технологических процессов / Под ред. И.П. Мухленова. Л.: Химия, 2008, 300с.
