Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX веков. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
Термин коррозия происходит от латинского слова «corrodere», что означает «разъедать, разрушать. Коррозия металлов — самопроизвольный процесс разрушения металлов вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов. Поэтому данная тема особенно актуальна в современном развивающемся мире.
В курсовой работе будут рассмотрены теоретическое обоснование электрохимической коррозии металлов и методы их защиты.
Для этого были поставлены следующие задачи: дать общую характеристику и классифицировать процессы коррозии, выявить условия возникновения коррозиционного процесса, изучить основы кинетической теории коррозии, электрохимическую коррозию и методы защиты металлов.
Коррозия металлов определяется как процесс самопроизвольного разрушения металлов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой. Коррозия представляет собой нежелательный и непреднамеренный процесс. Электрохимическое растворение анодов из черновой меди в ванне по ее рафинированию нельзя считать коррозионным процессом, так как оно является необходимым и желательным звеном в очистке меди от примесей. В то же время электрохимическое растворение железного анода в ванне по электролизу воды следует отнести к категории коррозионных процессов, поскольку оно здесь нежелательно. Разъедание стенок железной цистерны при перевозке в ней серной кислоты считается коррозионным разрушением, а растворение железа в серной кислоте с целью получения чистого реактивного сульфата железа не принято рассматривать как его коррозию, хотя в основе обоих процессов лежат одни и те же явления.
Коррозия — это не только нежелательный, но и самопроизвольный процесс, и в подавляющем большинстве случаев ее протекание не связано с подведением энергии от какого-либо внешнего ее источника. Эту особенность коррозии легко понять, если учесть, что корродируют обычно металлы (черные и цветные), встречающиеся в природе не в самородном состоянии, а как соответствующие минералы и руды. На извлечение этих металлов из руд или минералов расходуется большое количество энергии. Эти же металлы переходят в результате их коррозионного разрушения снова в окислы, сульфаты, карбонаты и другие соединения, в форме которых они обычно встречаются в природе. Процесс коррозии, поскольку он приводит к регенерации исходных соединений, термодинамически более устойчивых по сравнению с чистыми металлами, протекает с уменьшением свободной энергии и совершается самопроизвольно. Напротив, металлы, которые в природе обычно встречаются в чистом виде (золото, платина и другие), не корродируют, если только условия их использования не слишком отличаются от природных. Неудивительно поэтому, что разрушение многих металлов проходит со значительной скоростью и приносит колоссальный ущерб всем отраслям народного хозяйства [1].
Разработка ингибитора кислотной коррозии нелегированных сталей
... Изучение основных физико-химических процессов, которые характеризуют разрушение металла. 2) Изучение патентов в данной области исследования. 3) Изучение методов борьбы с коррозией. 4) Экспериментальное изучение действия ингибиторов. 5) Предложение технологических ...
2. Виды коррозии металлов
Различают 4 основных вида коррозии: химическую, водородную, кислородную и электрохимическую коррозию металлов.
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисления металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
Водородная и кислородная коррозия
Если происходит восстановление ионов H 3 O+ или молекул воды H2 O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:
H 3 O+ + 2e− → 2H2 O + H2
или
H 2 O + 2e− → 2OH− + H2
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
O 2 + 2H2 O + 4e− → 4OH−
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна [5].
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозия металлов
... коррозионное разрушение металлов под действием агрессивной среды в условиях колебательного движения двух поверхностей трения относительно друг друга; структурная коррозия, вызванная структурной неоднородностью сплава; в то же время происходит ускоренный процесс ...
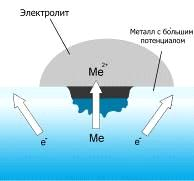
Рисунок 1 ̶ Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO 2 , образуется гальванический элемент, так называемый коррозионный элемент (рисунок 1).
Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокс потенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.
Примером крупномасштабной электрохимической коррозии может служить происшествие, случившееся в декабре 1967 года с норвежским рудовозом «Анатина», следовавшим из Кипра в Осаку. Налетевший в Тихом океане тайфун привёл к попаданию в трюмы солёной воды и образованию большой гальванической пары: медного концентрата со стальным корпусом судна, который вскоре размягчился, и судно подало сигнал бедствия [12].
Виды коррозии по условиям протекания:
- Атмосферная коррозия — наиболее распространенный вид коррозии, связанный с разрушением металлов в атмосфере воздуха;
- Газовая — коррозионное разрушение металла под воздействием газов при высоких температурах;
- Жидкостная — вид коррозии металла в жидкой среде, который подразделяется на коррозию в электролитах и неэлектролитах;
- Почвенная — коррозия металла в грунтах и почвах;
- Биокоррозия — вид коррозии, связанный с разрушением под влиянием живых микроорганизмов;
- Структурная — связанная с неоднородностью структуры металлов;
- Коррозия блуждающими токами — вид электрохимического разрушения под воздействием блуждающих токов;
- Внешним током — электрохимическое разрушение металла под влиянием тока от внешнего источника;
- Контактная коррозия — возникает при контакте разнородных металлов (имеющих разные стационарные потенциалы в данном электролите);
- Щелевая коррозия — явление повышения скорости коррозионного разрушения в зазорах и щелях в металле;
- Коррозия под напряжением — разрушение металла при одновременном воздействии агрессивной среды и механических напряжений;
- Кавитация — разрушение металла при одновременном воздействии ударного воздействия внешней среды и коррозионного процесса;
- Фреттинг-коррозия — вид коррозии, возникающий при колебательных перемещениях двух поверхностей относительно друг друга в условиях коррозионной среды;
- Коррозия при трении (коррозионная эрозия) — происходит при одновременном воздействии на металл трения и коррозионной среды;
Виды коррозии по характеру разрушения:
Коррозия и защита металлов
... (атмосферная коррозия). По природе гетерогенных процессов взаимодействия окружающей среды с металлами эти процессы можно разделить на два основных типа. высокотемпературная Электрохимическая коррозия, идущая в ... исследования мы используем первую часть равенства (1). Для исследования процессов электрохимической коррозии необходимо рассматривать выражение DG 0 , содержащее разность потенциалов и ...
- Сплошная (общая коррозия) — охватывающая всю поверхность металла, которая находится под воздействием коррозионной среды;
- Местная — распространяется лишь на некоторых участках поверхности металла.
Сплошная коррозия подразделяется на: равномерную, неравномерную и избирательную.
Местный вид коррозии бывает: пятнами, питтинговой, язвенной, сквозной, нитевидной, межкристаллитной, подповерхностной, ножевой, коррозионным растрескиванием и коррозионной хрупкостью [5].
3. Электрохимическая коррозия
электрохимический коррозия металл гальванический
Первопричиной коррозии металлов, в том числе и электрохимической коррозии, является их термодинамическая неустойчивость. При взаимодействии с электролитами металлы самопроизвольно растворяются, переходя в более устойчивое окисленное (ионное) состояние. Большой теоретический и практический интерес представляет механизм этого саморастворения металлов, т.е. механизм коррозионного процесса, его основные закономерности, скорость протекания процесса и характер коррозионного разрушения.
.1 Термодинамическая возможность электрохимической коррозии металлов
Принципиальная возможность или невозможность самопроизвольного протекания процесса электрохимической коррозии металла, так же как и химической коррозии, определяется знаком изменения свободной энергии процесса. Возможно самопроизвольное протекание только коррозионных процессов, которое сопровождается убылью изобарно-изотермического потенциала, т.е. ΔG Т < 0. При электрохимической коррозии металлов для расчетов более удобно пользоваться электрохимическими данными — электродными потенциалами. Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие
ΔG Т = -nEТ F < 0 (1)
Е Т = (Ек ) oбр — (Еа )обр — э.д.с. гальванического элемента, в котором обратимо осуществляется данный коррозионный процесс, В;
(Е к ) oбр — обратимый потенциал катодной реакции в данных условиях, В;
(Е а ) обр = (ЕMe )обр — обратимый потенциал металла в данных условиях(для сплавов — обратимый потенциал анодной составляющей сплава в данных условиях), В;= 23062 кал/г-экв — число Фарадея.
Принципиальная возможность протекания процесса электрохимической коррозии металла определяется, таким образом, соотношением обратимого потенциала металла в данных условиях и обратимого потенциала катодного процесса в данных условиях.
Самопроизвольное протекание электрохимического коррозионного процесса возможно, если
(Е а ) обр = (ЕMe )обр < (Ек ) oбр (2)
т.е. для электрохимического растворения металла необходимо присутствие в электролите окислителя — деполяризатора, обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях. При соблюдении этого условия Е Т > 0, a ΔGТ < 0.
Доклад по материаловедению «Коррозия металлов»
... чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют способы защиты металлов от коррозии. 1. 2. 3. 4. 5. Электрохимическая защита: а) б) Для ...
.2 Катодные процессы при электрохимической коррозии металлов
Процесс катодной деполяризации электрохимической коррозии металлов может осуществляться:
ионами:
+ H2 О + e = H + H2 О = ½ H2 + H2 О (3) + mH2 О + e = Ag + mH2 О (4)
Cu 2+ mH2 О + e = Cu + mH2 O (5) + mH2 O + e = Сu + mН2 О (6) 3+ mH2 O + е = Fe 2+ mH2 O (7)2 O8 2- + 2e = S2 O8 4- = 2SO8 2- (8)
HSO 3 — + 2Н + + 2е = S2 O4 2- + 2H2 O (9)3 — + 3H + + 2e = HNO2 + H2 O (10)
HNO 2 + 4H + + 4e = H2 N2 O2 + 2H2 O (11)
Cr 2 O7 2- + 14Н + + 6e = 2Cr 3+ + 7H2 O (12)
нейтральными молекулами:
O 2 + 4e + 2H2 O = 4OH — (13)2 O2 + 2e = 2OH — (14)2 + 2e = 2Сl — (15)2 + 2e = 2I — (16)2 + 2e = 2Вr — (17)
нерастворимыми пленками:
О + 2е + Н 2 O = Сu + 2OН — (18)
Fe 3 O4 + 2е + Н2 O = 3FeO + 2OH — (19)
Fe(ОН) 3 + е = Fe(OH)2 + ОН— (20)
органическими соединениями:
+ 2е + 4Н + = RН2 + Н2 O (21)+ 2е + 2Н + = RН2 (22)
где R — радикал или органическая молекула.
Обратимые окислительно-восстановительные потенциалы катодных реакций (Е к ) oбр = (Еox / red )oбр характеризующие возможность протекания последних, выражаются уравнением:
(E к )обр = (Vк )0 обр + (RT/nF)2,303 lg (ap ox /ared q ) (23)
где (E к ) oбр = (Eox / red ) oбр — стандартный окислительно-восстановительный (обратимый окислительно-восстановительный потенциал при (ap ox /ared q )=1);ox и ared — активность окислителя и восстановителя соответственно;
- р и q — стехиометрические коэффициенты окислителя и восстановителя соответственно в окислительно-восстановительной реакции.
Наибольшее значение в большинстве конкретных случаев электрохимической коррозии металлов имеют катодные реакции: (13) — кислородная деполяризация и (3) — водородная деполяризация (деполяризация водородными ионами).
3.3 Гомогенный и гетерогенный пути протекания электрохимической коррозии металлов
Современная теория электрохимической коррозии металлов исходит из возможности протекания процесса как гомогенно-электрохимическим, так и гетерогенно-электрохимическим путем (локальные элементы), из которых второй (гетерогенно-электрохимический) в практических случаях коррозии преобладает.
В теории необратимых электродных потенциалов металлов А.Н. Фрумкина, в которой сформулирован электрохимический механизм саморастворения (коррозии) металлов в электролитах, рассматривалось растворение металла с однородной (гомогенной) поверхностью, т. е. предполагалось, что скорость протекающих на поверхности электрохимических реакций одинакова на всех участках и что все точки поверхности обладают одним и тем же значением потенциала (т.е. что поверхность является строго эквипотенциальной).
Автор этой теории считает, что такое допущение вполне законно для жидкого металла, например для поверхности ртути или амальгамного электрода, которая может служить образцом однородной поверхности. Относительно твердого металла это допущение может служить лишь известным приближением. Даже если твердый металл химически вполне однороден, разные участки его поверхности не являются вполне однородными физически. Разные точки поверхности, различающиеся своим положением в решетке отдельных кристаллитов, обладают различной энергией и различными свойствами, что отражается на кинетике электрохимических реакций, протекающих в этих точках. Особенно резкое отклонение от принятой упрощенной картины получается в том случае, когда металл содержит в себе инородные включения и когда вследствие этого на его поверхности имеются разделенные участки с различными физическими и химическими свойствами.
А. Н. Фрумкиным и В. Г. Левичем было теоретически доказано, что поверхность корродирующего металла остается приблизительно эквипотенциальной и при наличии неоднородностей, если только размеры включений малы, а электропроводность электролита достаточно велика, что подтверждено измерениями Г. В. Акимова и А. И. Голубева (рис. 2).
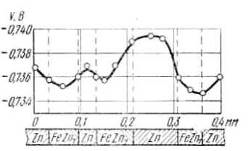
Рисунок 2 ̶ Значение электродных потенциалов на структурных составляющих сплава цинк — железо в растворе 0,05-н.
Как видно из рисунка 2, наблюдаются заметные изменения потенциала при переходе от одной составляющей сплава (анод-цинк, катод-FeZn 7 ) к другой, но абсолютная величина их невелика. В тех случаях, когда нас интересует только общая величина коррозии, а не распределение ее по поверхности (например, при определении величины саморазряда электрода источника тока), это позволяет трактовать заведомо неоднородную поверхность как однородную. Необходимо иметь, однако, в виду, что в случае металла с неоднородной поверхностью значение общей, скорости коррозионного процесса, как правило, еще совершенно не определяет величины и степени опасности коррозионных разрушений. Как видно из рисунка 2, скорость анодного процесса резко возрастает с приближением к краю катодного включения. Разрушение металла происходит, следовательно, неравномерно; в данном случае оно концентрируется главным образом вблизи включения.
Таким образом, гомогенная трактовка протекания электрохимического коррозионного процесса, являющаяся вполне законной для жидкого металла, при переходе к твердому металлу может служить только известным приближением являющимся упрощенной картиной при наличии в металле инородных включений и пригодным только для металлов повышенной частоты или для количественной оценки случаев более или менее равномерного характера разрушения поверхности корродирующего металла, т.е. когда общая величина коррозии представляет интерес.
По этой теории, в стационарных условиях суммарные скорости анодного i а и катодного iк процессов саморастворения (коррозии) металла равны, т.е.
![]() (24)
(24)
что значительно упрощает расчеты, но дает очень грубое приближение или вовсе не пригодно для оценки и расчета неравномерных и местных коррозионных разрушений металлов.
Согласно более ранней, имеющей почти полуторавековую историю, гетерогенной трактовке процессов электрохимической коррозии металлов (теории локальных элементов), участки анодной и катодной реакций пространственно разделены и для протекания коррозии необходим переток электронов в металле и ионов в электролите. Такое пространственное разделение анодной и катодной реакций энергетически более выгодно, так как они локализуются на тех участках, где их прохождение облегчено (энергия активации реакции меньше).
В большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных (более или менее постоянных) участках корродирующей поверхности металла, что приводит к неравномерному или местному характеру коррозионного разрушения. Эти отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходят анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими (имеющими размеры, хорошо различимые невооруженным глазом) или микрогальваническими (обнаруживаемыми лишь при помощи микроскопа) элементами (рис. 3).
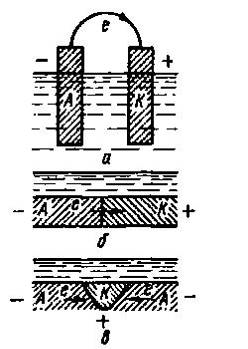
Рисунок 3 ̶ Схема гальванических элементов: а — обычный элемент; б — модель коррозионного элемента; в — коррозионный элемент; А — анод; К- катод; е — электроны
Таким образом, электрохимическая коррозия металлов напоминает работу гальванического элемента, в котором отрицательный электрод (например, цинк) растворяется, когда он соединен проводником со вторым электродом, на котором восстанавливаются ионы водорода или другие вещества и поэтому ее можно рассматривать как результат работы большого числа коррозионных гальванических элементов на корродирующей поверхности металла, соприкасающейся с электролитом.
Основателем теории микрогальванических (локальных) элементов принято считать де для Рива (1830 г.), хотя еще в 1813 г. аналогичная теория была сформулирована Ф.И. Гизе. Теория микрогальванических элементов получила признание и свое дальнейшее развитие в XX в. благодаря трудам многих ученых и прежде всего Н.А. Изгарышева, Г. В. Акимова и его школы. А.И. Голубевым и Г.В.Акимовым были исследованы реальные микроэлементы.
Эта теория в ее современном виде объясняет не только общую величину коррозии, но и влияние гетерогенности поверхности корродирующих металлов (включая и структурную гетерогенность) на характер и скорость (увеличение и уменьшение ее, равно как и отсутствие влияния в ряде случаев) коррозионного разрушения. Она была широко использована для объяснения коррозионного поведения конструкционных металлов и сплавов в различных условиях.
По этой теории, в стационарных условиях суммарные скорости анодного i а и катодного iк процессов при саморастворении (коррозии) металлов не равны, так как площади анодных и катодных участков, как правило, не равны, т.е. Sа ≠ Sк , поэтому
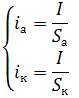 (25)
(25)
При этом скоростью собственно коррозии является только первая величина, т.е. анодная плотность тока i а .
Современная теория электрохимической коррозии металлов не противопоставляет два пути (гомогенный и гетерогенный) протекания процесса, полагая, что соответствующие теоретические положения, основанные в обоих случаях на использовании электрохимической термодинамики и кинетики, дополняют друг друга, так как каждое из них имеет свои границы применения. В связи с этим попытки необъективной критики одной из этих теорий являются ненужными [4].
3.4 Коррозионные гальванические элементы и причины их возникновения
Поверхность корродирующего металла представляет собой обычно многоэлектродный, т.е. состоящий из нескольких (более двух) отличающихся друг от друга электродов,гальванический элемент (рис. 4).
В первом приближении эту поверхность можно рассматривать как двухэлектродную систему, т.е. состоящую из участков двух видов — анодных (одного сорта) и катодных (тоже одного сорта).
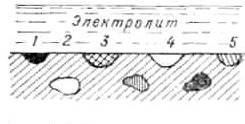
Рисунок 4 ̶ Схема пятиэлектродного коррозионного гальванического элемента
Причины возникновения электрохимической гетерогенности (неоднородности) поверхности раздела металл — электролит при электрохимической коррозии металлов приведены в таблице 2.
Таблица 2 ̶ Причины возникновения электрохимической гетерогенности поверхности металл-электролит (типы коррозионных гальванических элементов) по Н. Д. Ромашову
|
Общая причина возникновения гетерогенности |
Конкретная причина возникновения гетерогенности |
Обычная полярность участков |
||
|
Неоднородность металлической фазы |
Макро- и микровключения Неоднородность сплава |
Включения с более положительным электродным потенциалом являются катодами (рис. 5, а) Участки сплава, обогащенные компонентом с более положительным электродным потенциалом, являются, как правило, катодами |
||
|
Неоднородность поверхности металла |
Наличие границ блоков и зерен кристаллитов Выход дислокаций на поверхность металла Анизотропность металлического кристалла |
Границы блоков и зерен могут быть и катодами, и анодами (рис. 5, б) Область выхода дислокации на поверхность обычно является анодом Различные грани монокристаллов могут быть анодами или катодами |
||
|
Субмикроскопическая (атомарная) неоднородность поверхности металла |
Наличие разнородных атомов в твердом растворе |
Атомы или группы атомов металла с более отрицательным электродным потенциалом являются в ряде случаев анодами |
||
|
Неоднородность защитных пленок на поверхности металла |
Макро- и микропоры в окисной пленке Неравномерное распределение на поверхности металла вторичных продуктов коррозии |
Металл в порах является анодом (рис. 5, в) Участки металла под продуктами коррозии, как правило, являются анодами (рис. 5, г) |
Неравномерная деформация Неравномерность приложенных внешних нагрузок |
Более деформированные участки металла являются анодами (рис. 5, д) Более напряженные участки металла являются анодами (рис. 5, е) |
|
Неоднородность жидкой фазы |
Различие в концентрации собственных ионов данного металла в электролите Различи в концентрации нейтральных солей в растворе |
Участки металла, соприкасающиеся с более разбавленным раствором, при установлении искаженного обратимого электродного потенциала являются анодами Участки металла, соприкасающиеся с более концентрированными растворами солей с активным анионом, являются анодами (рис. 5, ж), а с растворами пассивирующих солей, наоборот — катодами |
||
|
Неоднородность жидкой фазы |
Различие в pH Различие в концентрации кислорода или других окислителей |
Участки металла, соприкасающиеся с раствором с более низким значением рН, являются катодами Участки металла, соприкасающиеся с раствором с большей концентрацией кислорода или другого окислителя, являются катодами (рис. 5, з) |
||
|
Неоднородность физических условий |
Различие температуры Неравномерное распределение лучистой энергии Неравномерное наложение внешнего электрического поля |
Более нагретые участки металла являются анодами (рис. 5, и) Более интенсивно облучаемые участки металла являются анодами Участки металла, где положительные заряды (катионы) выходят в электролит, являются анодами (рис. 5, к) |
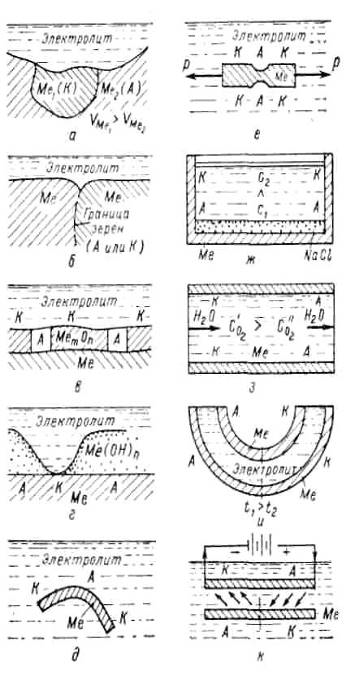
Рисунок 5 ̶ Типы коррозионных гальванических элементов
Таким образом, электрохимическая гетерогенность поверхности корродирующего металла приводит к дифференциации последней на анодные (с более отрицательным электродным потенциалом V а ) и катодные (с более положительным электродным потенциалом Vк ) участки. Степень гетерогенности этой поверхности характеризуется разностью электродных потенциалов анодных и катодных участков, т.е. (Vк ) oбр — (Vа ) обр (см. рис. 2) [10].
3.5 Схема и особенности электрохимического коррозионного процесса
Электрохимическое растворение металла — сложный процесс, состоящий из трех основных процессов (рис. 6):
анодного процесса — образования гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции:
![]()
процесса перетекания электронов по металлу от анодных участков к катодным и соответствующего перемещения катионов и анионов в растворе;
катодного процесса — ассимиляции электронов какими-либо ионами или молекулами раствора (деполяризаторами), способными к восстановлению на катодных участках по реакции:
+ nе = [Dne]
Таким образом, электрохимическая коррозия на неоднородной (гетерогенной) поверхности металла аналогична работе короткозамкнутого гальванического элемента [3].
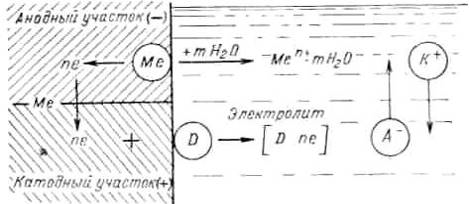
Рисунок 6 ̶ Схема электрохимического коррозионного процесса
При замыкании в электролите двух обратимых электродов с разными потенциалами [(V а ) обр и (Vк )oбр ] происходит перетекание электронов от более отрицательного электрода (анода) к менее отрицательному (или более положительному) электроду (катоду).
Это перетекание электронов выравнивает значения потенциалов замкнутых электродов. Если бы при этом электродные процессы (анодный на аноде и катодный на катоде) не протекали, потенциалы электродов сравнялись бы, и наступила бы полная поляризация. В действительности анодный и катодный электродные процессы продолжаются, препятствуя наступлению полной поляризации вследствие перетекания электронов с анода к катоду, т.е. действуют деполяризующие. Отсюда, в частности, происходит и название ионов и молекул раствора, обеспечивающих протекание катодного процесса — деполяризаторы. Однако из-за отставания электродных процессов от перетока электронов в гальваническом элементе потенциалы электродов изменяются (сближаются) и короткозамкнутая система, в конечном итоге, полностью заполяризовывается.
Особенности электрохимического коррозионного процесса:
- подразделение его на два одновременно протекающих, но в значительной степени независимых электродных процесса: анодный и катодный;
- зависимость кинетики этих двух электрохимических процессов, а следовательно, и скорости коррозии в соответствии с законами электрохимической кинетики от величины электродного потенциала металла: смещение потенциала металла в положительную сторону (например, в результате поляризации от внешнего источника тока) обычно облегчает анодный процесс и затрудняет катодный;
- смещение потенциала в отрицательную сторону, наоборот, ускоряет катодный процесс и тормозит анодный;
- возможность локализации электродных процессов на различных участках поверхности корродирующего металла, где их протекание облегчено;
- при локализации электродных процессов реализация материального эффекта коррозии (растворения металла) преимущественно на анодных участках поверхности корродирующего металла.
Общие принципы протекания коррозионных процессов: в большинстве случаев электрохимической коррозии металлов основными тормозящими явлениями, устанавливающими определенную конечную скорость ее, служат явления поляризации [12].
4. Методы защиты металлов от электрохимической коррозии
Методы защиты металлов от электрохимической коррозии можно классифицировать:
1) по защитному фактору:
- повышение термодинамической устойчивости металла (защитные неорганические, металлические и органические покрытия);
- кинетическое торможение (повышение анодной, катодной поляризации, электропроводности среды).
2) по объекту воздействия:
- на металл (коррозионностойкое легирование);
- на среду (ингибиторы);
- на конструкцию (анодная, катодная, протекторная защита) [1].
.1 Защита от коррозии посредством специальных покрытий
Чтобы защитное покрытие справлялось с задачами, которые возлагаются на него, оно должно обладать целым рядом особых качеств:
- быть износостойким и максимально твердым;
- характеризоваться высоким показателем прочности сцепления с поверхностью обрабатываемого изделия (то есть обладать повышенной адгезией);
- иметь такую величину теплового расширения, которая бы незначительно отличалась от расширения защищаемой
- быть максимально недоступным для вредных факторов окружающей среды.
Также покрытие должно наноситься на всю конструкцию как можно более равномерно и сплошным слоем.
Все используемые в наши дни защитные покрытия делят на:
- металлические и неметаллические;
- органические и неорганические.
.1.1 Борьба с коррозией при помощи органических неметаллических покрытий
Самым распространенным и сравнительно несложным вариантом защиты металлов от ржавления, известным уже очень давно, признается использование лакокрасочных составов. Антикоррозионная обработка материалов такими соединениями характеризуется не только простотой и дешевизной, но еще и следующими положительными свойствами:
- возможностью нанесения покрытий разных цветовых оттенков — что и элегантный облик конструкциям придает, и надежно защищает их от ржавчины;
- элементарностью восстановления защитного слоя в случае его повреждения.
К сожалению, лакокрасочные составы имеют совсем небольшой коэффициент термической стойкости, малую стойкость в воде и относительно низкую механическую прочность. По этой причине в соответствии с существующими правилами их рекомендовано применять в тех случаях, когда на изделия действует коррозия со скоростью не более 0,05 миллиметров в год, а запланированный срок их эксплуатации не превышает десяти лет.
К составляющим современных лакокрасочных составов относят такие элементы:
- краски: суспензии пигментов с минеральной структурой;
- лаки: растворы (коллоидные) смол и масел в растворителях органического происхождения (защита от коррозии при их применении достигается после полимеризации смолы либо масла или их испарения под влиянием дополнительного катализатора, а также при нагреве);
- искусственные и природные соединения, называемые пленкообразователями (например, олифа — самый, пожалуй, популярный неметаллический «защитник» чугуна и стали);
- эмали: лаковые растворы с комплексом подобранных пигментов в измельченном виде;
- смягчители и разнообразные пластификаторы: адипиновая кислота в виде эфиров, дибутилфтолат, касторовое масло, трикрезилфосфат, каучук, другие элементы, которые увеличивают эластичность защитного слоя;
- этилацетат, толуол, бензин, спирт, ксилол, ацетон и другие (данные компоненты нужны для того, чтобы лакокрасочные составы без проблем наносились на обрабатываемую поверхность);
- инертные наполнители: мельчайшие частицы асбеста, тальк, мел, каолин (они делают антикоррозионные возможности пленок более высокими, а также уменьшают траты других составляющих лакокрасочных покрытий);
- пигменты и краски;
- катализаторы (на языке профессионалов — сиккативы): необходимые для быстрого высыхания защитных составов кобальтовые и магниевые соли жирных органических кислот.
Лакокрасочные соединения выбирают с учетом того, в каких условиях эксплуатируется обрабатываемое изделие. Составы на базе эпоксидных элементов рекомендованы для использования в атмосферах, где постоянно присутствуют испарения хлороформа, двухвалентного хлора, а также для обработки конструкций, находящихся в различных кислотах (азотная, фосфорная, соляная и т. п.).
К кислотам также устойчивы и лакокрасочные составы с полихровинилом. Они, кроме того, применяются для предохранения металла от воздействия масел и щелочей. А вот для защиты конструкций от газов чаще применяются составы на базе полимеров (эпоксидных, фторорганических и иных).
Очень важно при подборе защитного слоя учитывать требования для разных отраслей промышленности [11].
.1.2 Антикоррозионная обработка неметаллическими неорганическими покрытиями
На металлических изделиях вполне можно формировать посредством электрохимической либо химической обработки специальные пленки для защиты их от ржавления. Чаще всего создаются фосфатные и оксидные пленки.
Фосфатные пленки подходят для антикоррозионной защиты цветных и черных металлов. Суть такого процесса заключается в погружении изделий в нагретый до определенной температуры (в районе 97 градусов) раствор цинка, железа или марганца с кислыми фосфорными солями. Получающаяся при этом пленка идеальна для нанесения на нее лакокрасочного состава.
Заметим, что фосфатный слой сам по себе не отличается длительным сроком применения. Он малоэластичный и совсем непрочный. Используется фосфатирование для защиты деталей, которые работают при высоких температурах или в соленой воде (например, в морской).
Также ограниченно используются и оксидные защитные пленки. Получают их при обработке металлов в растворах щелочей под действием тока. Известным раствором для оксидирования является едкий натр (4%).
Операцию получения оксидного слоя нередко называют воронением, так как на поверхности мало- и высокоуглеродистых сталей пленка характеризуется красивым черным цветом.
Оксидирование производится в ситуациях, когда начальные геометрические параметры нужно сохранить в неизменном виде. Оксидный слой обычно наносят на точные приборы, стрелковое вооружение. Толщина такой пленки в большинстве случаев не превышает полутора микронов.
— Пассивирование. В этом случае изделия подвергаются обработке в растворах нитратов либо хроматов. Детали из стали разных марок пассивируют, как правило, в нитрите натрия, алюминий пассивируется бихроматом калия, а вот медные конструкции погружают в хроматные ванны.
— Анодирование. Способ защиты металла от коррозии, разработанный специально для сплавов на основе алюминия. Он очень надежен и при этом по-настоящему прост. Анодирование производится в ваннах, состоящих из: 5-10 % щавелевой кислоты, 3 % хромового ангидрида и серной кислоты (на один литр раствора ее идет около 190 граммов).
— Эмалирование. Защита металла от коррозии при помощи композиции, состоящей из сплавленного полевого шпата, цинка, мела, песка, титана, глины, фтористых солей, оксидов хрома, поташа, буры и некоторых других компонентов. Подобное покрытие демонстрирует отличную стойкость к коррозии, вызываемой газовыми средами, солями, органическими и минеральными кислотными составами [9].
.2 Электрохимические способы защиты от коррозии металлических конструкций
Если изделия из металла подвергнуть поляризации, скорость ржавления, обусловленного электрохимическими факторами, можно существенно уменьшить. Электрохимическая антикоррозионная защита бывает двух видов: анодной и катодной.
Анодная технология подходит для материалов из: сплавов (высоколегированных) на базе железа; нержавеющих сталей с малым уровнем легирования; углеродистых сталей.
Суть методики анодной защиты проста: металлическое изделие, которому требуется придать антикоррозионные свойства, подключается к катодному протектору либо к «плюсу» источника (внешнего) тока. Данная процедура обеспечивает уменьшение скорости ржавления в несколько тысяч раз. В качестве катодного протектора могут выступать элементы и соединения с высоким положительным потенциалом (свинец, платина, диоксид свинца, платинированная латунь, тантал, магнетит, углерод и другие).
Описанный вид электрохимической защиты небезопасен из-за риска активного анодного растворения конструкций во время приостановки подачи тока. В связи с этим он осуществляется только тогда, когда имеется специальная система контроля выполнения всех предусмотренных технологической схемой операций.
Более распространенной и менее опасной считается катодная защита, которая годится для металлов, не имеющих склонности к пассивации. Подобный метод предполагает подсоединение конструкции к электродному отрицательному потенциалу или к «минусу» источника тока.
При катодной поляризации скорость катодного процесса (восстановление кислорода, выделение водорода) возрастает, а скорость растворения металла уменьшается. Таким образом, при помощи внешней катодной поляризации можно защитить металл от коррозии. Это явление называется протект — эффектом. Катодная защита может быть осуществлена или при помощи соединения защищаемого металла с другим металлом (протектором), имеющим более отрицательное значение равновесного потенциала, чем защищаемый металл (рис.7).
В качестве металлов-протекторов используют электроотрицательные металлы — цинк, алюминий, магний и их сплавы, которые равномерно растворяются с высокой практической токоотдачей [9].
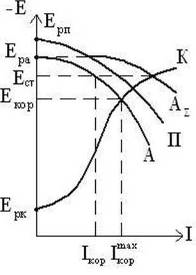
Рисунок 7 ̶ Диаграмма Эванса для протекторной защиты
Для реализации катодной электрохимической защиты от внешнего источника тока необходимы вспомогательные аноды. В качестве вспомогательных анодов (анодных заземлений) используются анодно растворимые материалы (алюминий, углеродистая сталь), труднорастворимые (графит, высококремнистые чугуны) и нерастворимые (платинированный титан, сплавы свинца, диоксид свинца, магнетит, оксидные рутениево-титановые аноды и др.).
При поддержании потенциала защиты Е з , равным равновесному потенциалу защитной конструкции Ера , можно достичь полной катодной защиты 1кор = 0 (рис. 8).
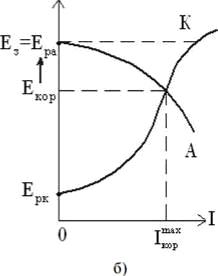
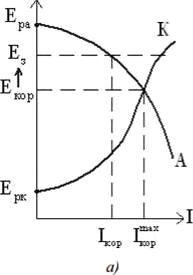
Рисунок 8 ̶ Диаграммы Эванса для неполной (а) и полной (б) катодной электрохимической защиты
При значительном сдвиге защитного потенциала в электроотрицательную сторону имеет место так называемая перезащита, при которой наблюдается выделение водорода на защищаемой конструкции. Это приводит к наводороживанию металла и ухудшению его механических свойств, нарушению целостности защитных покрытий, ускоренному разрушению вследствие подщелачивания приэлектродного слоя.
Если металл в используемой коррозионной среде склонен к пассивации, то его перевод в пассивное состояние имеет большое практическое значение, так как плотность тока на участке полной пассивации металла достаточно мала. К способам перевода металла в пассивное состояние относят катодное и анодное легирование, введение в среду окислителей — пассиваторов, использование анодной защиты от внешнего источника тока.
При катодном легировании металлов легирующий элемент (для углеродистой стали Сu, Ag, Pd, Pt и металлы платиновой группы) с основным металлом должен образовывать механическую смесь. В этом случае появляется более электроположительная фаза, на которой облегчается протекание катодной реакции, и сплав переходит в пассивное состояние (рис.9, а).
Легирующий компонент так же должен быть устойчив в коррозионной среде. Как правило, он требуется в небольших количествах (несколько десятых долей %), поэтому можно говорить не о катодном легирования, а о катодном модифицировании сплава.
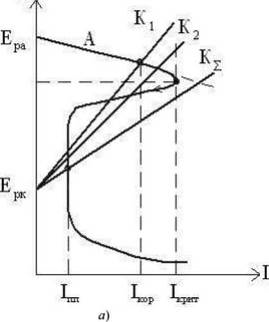
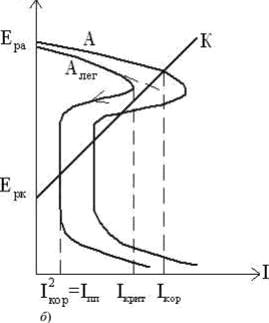
Рисунок 9 ̶ Катодное (а) и анодное (б) легирование металла
При анодном легировании металлов облегчается переход основы сплава в пассивное состояние. Это возможно, если легирующий компонент (Cr, Ni) с основным металлом (например, железом) образует твердый раствор, что будет соответствовать изменению анодной кривой А А лег . В этом случае при наличии одного и того же катодного процесса (кривая К) сплав будет самопассивироваться и находиться в коррозионно-устойчивом состоянии (рис. 9, б).
Желаемый результат достигается введением значительного количества легкопассирующего металла (15-20 и более %), который также не должен ухудшать технологических и механических свойств сплава.
Анодная защита сплавов от коррозии заключается в их переводе в пассивное состояние путем анодной поляризации от внешнего источника тока и поддержанием этого состоянии при потенциале защиты, лежащим посредине пассивной области. Анодная защита используется в тех случаях, когда коррозионная среда имеет достаточно высокую проводимость, а металлическая конструкция имеет область пассивации не мене 0,05 В и обладает невысоким омическим сопротивлением [6].
.3 Способы обработки коррозионной среды
На производственных предприятиях с коррозией можно с успехом справляться посредством модификации состава агрессивной атмосферы, в которой работают металлические детали и конструкции. Существует два варианта снижения агрессивности среды:
- введение в нее ингибиторов (замедлителей) коррозии;
- удаление из среды тех соединений, которые являются причиной возникновения коррозии.
Ингибиторы, как правило, используются в системах охлаждения, цистернах, ваннах для выполнения травильных операций, различных резервуарах и прочих системах, в коих коррозионная среда имеет примерно постоянный объем. Замедлители подразделяют на:
- органические, неорганические, летучие;
- анодные, катодные, смешанные;
- работающие в щелочной, кислой, нейтральной среде.
Ниже указаны самые известные и часто используемые ингибиторы коррозии, которые отвечают требованиям для разных производственных объектов: бикарбонат кальция; бораты и полифосфаты; бихроматы и хроматы; нитриты; органические замедлители (многоосновные спирты, тиолы, амины, аминоспирты, аминокислоты с поликарбоксильными свойствами, летучие составы).
А вот уменьшить агрессивность коррозионной атмосферы можно такими методами:
- вакуумированием;
- нейтрализацией кислот при помощи едкого натра либо извести (гашеной);
- деаэрацией с целью удаления из кислорода.
Как видим, на сегодняшний день существует немало способов защиты металлических конструкций и изделий. Важно лишь грамотно подобрать оптимальный для каждого конкретного случая вариант, и тогда детали и сооружения из стали и чугуна будут служить очень и очень долго [8].
Ежегодно от 5 до 20% выплавляемого количества черных металлов разрушается в результате коррозии. Однако как бы велики не были прямые потери от коррозии, они не могут дать правильного представления о фактических убытках, причиняемых этим процессом. Даже небольшое разрушение металла при коррозии какого-либо химического аппарата может вывести его из строя, вызвать нарушение технологического режима, остановку процесса, потерю времени, материалов. Эти потери значительно превосходят убытки, связанные со стоимостью разрушенного металла. Так, например, относительно невысокая стоимость разрушенного участка подземного свинцового кабеля не идет ни в какое сравнение с затратами на работы по обнаружению места повреждения, по удалению почвы и по его ремонту. Ущерб, причиняемый коррозией металлов, трудно переоценить. Естественно поэтому, что изучение коррозии и разработка методов защиты металлов от нее представляют несомненный теоретический интерес и имеют большое народнохозяйственное значение.
В ходе курсовой работы была дана общая характеристика и классификация процессов коррозии, выявлены условия возникновения коррозиционного процесса, изучены основы кинетической теории коррозии, электрохимическая коррозия и методы защиты металлов от коррозии.
1 Улиг Г.Г. Коррозия и борьба с ней / Г.Г. Улиг, Р.У. Реви. — Л.: Химия, 1989. — 344 с.
Никифоров В.М. Технология металлов и конструкционные материалы / В. М. Никифоров. — М.: Высшая школа, 1980. — 450 с.
Герасимов Я. И. Курс физической химии / Я. И. Герасимов, В. П. Древинг, Е. Н. Еремин и др. — М.: Химия, 1973. — 624 с.
Исаев Н. И. Теория коррозийных процессов / Н. И. Исаев. — М.: Металлургия, 1997. — 368 с.
Cеменова И.В. Коррозия и защита от коррозии / И. В. Семеновой. — М.: ФИЗМАТЛИТ, 2002. — 232 с.
Вячеславов П. М. Металлические покрытия, нанесенные химическим способом / П. М. Вячеславов. — Л.: Машиностроение, 1985. — 103 с.
Строкан Б. В. Коррозионная стойкость оборудования химических производств: Способы защиты оборудования от коррозии / Б. В. Строкан. -Л.: Химия, 1987. — 280 с.
Иванов Е.С. Ингибиторы коррозии металлов в кислых средах Е.С. Ивано. — М.: Металлургия, 1986. — 175 с.
Френкель Г.Я. Протекторная защита от коррозии металлического оборудования и специальных стальных конструкций гидротехнических сооружений / Г.Я. Френкель. — М.: Гидропроект, 1993. — 186 с.
Шлугер М. А. Коррозия и защита металлов / М. А. Шлугер, Ф. Ф. Ажогин, Е. А. Ефимов. — М.: Металлургия, 1981. — 215 с.
Розенфельд И. Л. Защита металлов от коррозии лакокрасочными покрытиями / И. Л. Розенфельд, Ф. И. Рубинштейн, К. А. Жигалова. — М.: Химия, 1987. — 222 с.
Люблинский Е. Я. Электрохимическая защита от коррозии / Е. Я. Люблинский. — М.: Металлургия, 1987. — 96 с.
