Первые опыты аналитического применения атомно-абсорбционной спектроскопии были проведены Уолшем с пламенем и опубликованы в 1955 г. В дальнейшем пламенная атомно-абсорбционная спектрометрия получила широкое развитие, и в настоящее время она является одним из основных методов рутинного анализа в различных областях науки и техники. Развитие индустрии и большое число производственных отходов создают необходимость постоянного экологического контроля за состоянием окружающей среды. Загрязнение тяжелыми металлами во многом характеризует степень техногенного воздействия на природу.
Цель данной курсовой: раскрыть теоретические основы и особенности применения атомно-абсорбционного спектрохимического анализа.
Для реализации поставленной цели предлагается решение следующих задач:
- раскрыть природу спектров, структуру атомов, теоретические основы спектрального анализа;
- изучить методику атомно-абсорбционного анализа.
ГЛАВА 1.
СПЕКТРОСКОПИЯ, .1 Природа спектров и структура атомов
Спектр электромагнитного излучения — упорядоченная по длинам совокупность монохроматических волн, на которую разлагается свет или иное электромагнитное излучение. Типичный пример спектра — хорошо известная всем радуга.
Каждый атом и молекула имеют уникальное строение, которому соответствует свой уникальный спектр.
При электрическом или тепловом возбуждении атомы или молекулы различных сплавов способны излучать электромагнитные волны. Спектры излучения состоят из отдельных спектральных линий, которые закономерно могут быть объединены в серии.
Исследования спектров излучения разряженных газов (т.е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода [1].
Швейцарский ученый И. Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
= R’ (![]() —
— ![]() ) (n=3, 4, 5, …), (1)
) (n=3, 4, 5, …), (1)
где R’ = 1,10![]() — постоянная Ридберга.
— постоянная Ридберга.
Атомно-абсорбционная спектрометрия
... анализа. Ограничения метода – невозможность одновременного определения нескольких элементов при использовании линейчатых источников излучения и, как правило, необходимость переведения проб в раствор. 1.2. Схема атомно-абсорбционного спектрометра Приборы для атомно-абсорбционного анализа - атомно-абсорбционные ... Таким образом, спектр излучения лампы с полым катодом — это атомный спектр материала ...
Так как
ν = R (![]() ) (n=3, 4, 5, …), (2)
) (n=3, 4, 5, …), (2)
где R = R’c = 3,29 * ![]() — также постоянная Ридберга.
— также постоянная Ридберга.
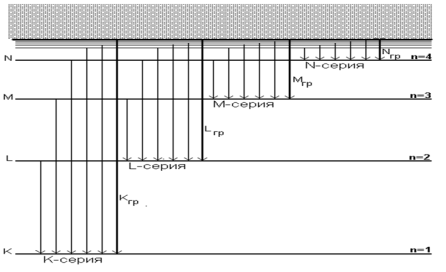
Из выражений (1) и (2) вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С увеличением nлинии серии сближаются; значение n=∞ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
ν = R (![]() ) (n=2, 3, 4, …).
) (n=2, 3, 4, …).
В инфракрасной области спектра были также обнаружены:
серия Пашена ν = R (![]() ) (n=4, 5, 6, …);
) (n=4, 5, 6, …);
серия Брэкета ν = R (![]() ) (n=5, 6, 7, …);
) (n=5, 6, 7, …);
серия Пфунда ν = R (![]() ) (n= 6, 7, 8, …);
) (n= 6, 7, 8, …);
серия Хэмфри ν = R (![]() ) (n= 7, 8, 9, …).
) (n= 7, 8, 9, …).
Риc. 1.1
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
ν = R (![]() ),
),
где m имеет в каждой данной серии постоянное значение, m= 1,2,3,4,5,6 (определяет серию), nпринимает целочисленные значения начиная с m+1 (определяет отдельные линии этой серии).
Исследование более сплошных спектров — спектров паров щелочных металлов (например, Li, Na, K) — показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно линиям бальмеровской серии [3].
Совокупность всех частот (длин волн) электромагнитного излучения называют электромагнитным спектром. Интервал длин волн разбивают на области:
- ультрафиолетовая (УФ);
- видимая;
- инфракрасная (ИК).

Рис.1.2 Области оптического излучения
Видимый спектр простирается от 750 нм (красная граница) до 400 нм (фиолетовая граница).
Свет этих длин волн воспринимается человеческим глазом, и именно на эту область приходится большое число спектральных линий атомов. Энергии, которую сообщают молекуле вещества излучения УФ- и видимой части спектра, достаточно, чтобы вызвать изменение электронного состояния молекулы. Энергия ИК-лучей меньше, поэтому ее оказывается достаточно только для того, чтобы вызвать изменение энергии колебательных и вращательных переходов в молекуле вещества. Таким образом, в различных частях спектра можно получить различную информацию о состоянии, свойствах и строении веществ.
Структура спектра атома, молекулы или образованной ими макросистемы определяется их энергетическими уровнями. Согласно законам квантовой механики, каждый энергетический уровень соответствует определенному квантовому состоянию. Электроны и ядра в таком состоянии совершают характерные периодические движения, для которых энергия, орбитальный момент количества движения и другие физические величины строго определены и квантованы, т.е. принимают лишь разрешенные дискретные значения, соответствующие целым и полуцелым значениям квантовых чисел. Если известны силы, связывающие электроны и ядра в единую систему, то по законам квантовой механики можно рассчитать ее уровни энергии и квантовые числа, а также предсказать интенсивности и частоты спектральных линий. С другой стороны, анализируя спектр конкретной системы, можно определить энергии и квантовые числа состояний, а также сделать выводы относительно действующих в ней сил. Таким образом, спектроскопия является основным источником сведений о квантово-механических величинах и о строении атомов и молекул.
Физика — ы : Два типа фазовых переходов и третье начало термодинамики
... термодинамики. Термодинамические основы фазовых превращений в металлах. Фазовые переходы первого и второго рода в термодинамике. Реферат на тему второе и третьи начало термодинамики. Изменение энтропии при фазовом переходе первого рода. Основные уравнения термодинамики фазовых переходов. Изменение внутренней энергии при фазовых переходах. ...
В атоме наиболее сильное взаимодействие между ядром и электронами обусловлено электростатическими, или кулоновскими силами. Каждый электрон притягивается к ядру и отталкивается всеми остальными электронами. Это взаимодействие определяет структуру энергетических уровней электронов. Внешние (валентные) электроны, переходя с уровня на уровень, испускают или поглощают излучение в ближней инфракрасной, видимой и ультрафиолетовой областях. Энергии переходов между уровнями внутренних оболочек соответствуют вакуумной ультрафиолетовой и рентгеновской областям спектра. Более слабым является воздействие электрического поля на магнитные моменты электронов. Это приводит к расщеплению электронных уровней энергии и, соответственно, каждой спектральной линии на компоненты (тонкая структура).
Кроме того, ядро, обладающее ядерным моментом, может взаимодействовать с электрическим полем орбитальных электронов, вызывая дополнительное сверхтонкое расщепление уровней энергии [9].
При сближении двух или более атомов между их электронами и ядрами начинают действовать силы взаимного притяжения и отталкивания. Итоговый баланс сил может привести к уменьшению полной энергии системы атомов — в этом случае образуется стабильная молекула. Строение молекулы в основном определяется валентными электронами атомов, а молекулярные связи подчиняются законам квантовой механики. В молекуле наиболее часто встречаются ионные и ковалентные связи. Атомы в молекуле испытывают непрерывные колебания, а сама молекула вращается как целое, поэтому у нее возникают новые энергетические уровни, отсутствующие в изолированных атомах. Энергии вращения меньше колебательных энергий, а колебательные — меньше электронных. Таким образом, в молекуле каждый электронный уровень энергии расщепляется на ряд близко расположенных колебательных уровней, а каждый колебательный уровень, в свою очередь, на тесно расположенные вращательные подуровни. В результате в молекулярных спектрах колебательные переходы имеют вращательную структуру, а электронные — колебательную и вращательную. Переходы между вращательными уровнями одного и того же колебательного состояния попадают в дальнюю инфракрасную и микроволновую области, а переходы между колебательными уровнями одного и того же электронного состояния соответствуют по частотам инфракрасной области. Благодаря расщеплению колебательных уровней на вращательные подуровни каждый переход распадается на множество колебательно-вращательных переходов, образуя полосы. Аналогично электронные спектры молекул представляют собой ряд электронных переходов, расщепленных тесно расположенными подуровнями колебательных и вращательных переходов.
Энергетический баланс процессов синтеза молекул кислорода, водорода и воды
... вторым и третьим энергетическими уровнями [1]. Рис. 3. Схема распределения энергий связи между электронами в молекуле кислорода Два атома кислорода соединяются в молекулу в состоянии ... переходе из газообразного в жидкое состояние атом кислорода в молекуле воды, должен уменьшить свой объём. Это произойдет, если кольцевые электроны атома кислорода опустятся на более низкие энергетические уровни ...
Вообще говоря, спектральные переходы могут происходить отнюдь не между всеми парами уровней энергии. Электрические дипольные переходы, сопровождающиеся наиболее сильными спектральными проявлениями, имеют место лишь при выполнении определенных условий (правил отбора).
Переходы, которые удовлетворяют правилам отбора, называются разрешенными, вероятность остальных переходов значительно меньше, они трудны для наблюдения и считаются запрещенными.
Спектроскопические исследования атомарного водорода — прекрасный пример теории и эксперимента, внесших огромный вклад в фундаментальную науку [1].
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия He + , двукратно ионизованного лития L++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze(для атома водорода Z = 1),
U(r) = — ![]()
где r — расстояние между электроном и ядром. Графически функция U(r) изображена рис. 1.3:
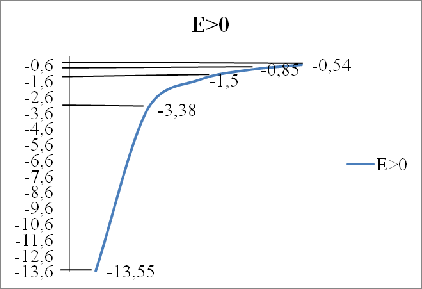
Рис. 1.3 Потенциальная энергия взаимодействия электрона с ядром
U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера:
ΔΨ + ![]() (E +
(E + ![]() )Ψ = 0,
)Ψ = 0,
где m — масса электрона, E — полная энергия электрона в атоме.
Решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е 1, Е2, Е3, … показаны на графике в виде горизонтальных прямых.
Самый нижний уровень Е 1, отвечающий минимальной возможной энергии, — основной, все остальные (Еn > Е1, n= 2, 3, …) — возбужденные.
В квантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции Ψ nlml (r, θ, φ), определяемые тремя квантовыми числами: главным n, орбитальным l и магнитным ml .
Главное квантовое число n определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы: n= 1, 2, 3, …
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т.е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
L l =ђ![]() ,
,
Механизмы действия высокоинтенсивного лазерного излучения на биологические ткани
... характеристики 6. Низкоинтенсивные лазеры, свойства, действие на биологические ткани Низкоинтенсивное лазерное излучение (НИЛИ) в дерматологии ... обратный первому и является процессом поглощения. Молекула, находящаяся в определенном состоянии энергии, ... вещества[19]. В газовых и жидкостных лазерах (см. гелий-неоновый лазер, лазер на красителях) используется накачка электрическим разрядом. Такие лазеры ...
где l — орбитальное квантовое число, которое при заданномn принимает значения, l= 0, 1, …, (n — 1), т.е. всего n значений, и определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует также, что вектор L l момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направление z внешнего магнитного принимает квантованные значения, кратные ђ:
L lz = ђml ,
где m l — магнитное квантовое число, которое при заданномl может принимать значения, ml = 0, ±1, ±2, …, ±l, т.е. всего 2l+1 значений.
Таким образом, магнитное квантовое число m l определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l+1 ориентаций.
Наличие квантового числа m l должно привести в магнитное поле к расщеплению уровня с главным квантовым числом n на 2l+1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. Действительно, расщепление энергетических уровней в магнитном поле было обнаружено в 1896 г. голландским физиком П. Зееманом и получило название эффекта Зеемана [10].
Квантовые числа n, l, m l позволяют более полно описать спектр испускания (поглощения) атома водорода.
В квантовой механике вводятся правила отбора, ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением света:
- изменение орбитального квантового числа Δl удовлетворяет условию Δl = ± l;
изменение магнитного квантового числа Δm l удовлетворяет условию Δml = 0, ±l.
В оптических спектрах указанные правила отбора в основном выполняются. Учитывая число возможных состояний, соответствующих данномуn, и правило отбора, серии Лаймана соответствуют переходы np → ls (n = 2, 3, …); серии Бальмера — np → 2s, ns → 2p, nd→ 2p (n = 3, 4, …) и т.д.
Переход электрона из основного состояния в возбужденное обусловлен увеличением энергии атома и может происходить только при сообщении атому энергии извне, например, за счет поглощением атомом фотона. Так как поглощающий атом находится обычно в основном состоянии, то спектр атома водорода должен состоять из линий, соответствующих переходам 1s→np (n = 2, 3, …), что находится в полном согласии с опытом[3].
2 Спектрофотометрия
Спектрофотометрия как метод исследования и анализа веществ основан на измерении спектров поглощения в оптической области электромагнитного излучения. Иногда под спектрофотометрией понимают раздел физики, объединяющий спектроскопию (как науку о спектрах электромагнитного излучения), фотометрию и спектрометрию (как теорию и практику измерения соответствующей интенсивности и длины волны (или частоты) электромагнитного излучения).
На практике спектрофотометрию часто отождествляют с оптической спектроскопией. По типам изучаемых систем спектрофотометрию обычно делят на молекулярную и атомную. Различают спектрофотометрию в ИК, видимой и УФ областях спектра.
Применение спектрофотометрии в УФ и видимой областях спектра основано на поглощении электромагнитного излучения соединениями, содержащими хромофорные и ауксохромные группы. Поглощение излучения в этих областях связано с возбуждением электронов s-, p-и n-орбиталей основного состояния и переходами молекул в возбужденные состояния.
Проектирование участка установки по абсорбции-десорбции сероводорода ...
... вещество). Эффективным поглотителем сероводорода является активный уголь. Присутствие в очищенном газе кислорода является необходимым условием реализации процесса, в котором наряду с поглощением ... В проекте представлены материалы по проектированию заключительной стадии утилизации сероводорода из серосодержащих газов вторичной переработки нефти — абсорбция и десорбции сероводорода моноэтаноламином. ...
Изолированные, не взаимодействующие между собой хромофоры, в молекуле поглощают независимо. В случае какого-либо взаимодействия между ними аддитивность спектров нарушается. По отклонениям от аддитивности можно судить о характере и величине взаимодействия. Поскольку положение полос в спектре определяется как разность энергий основного и возбужденного состояний молекул, можно определять структуру энергетических уровней молекул или по известной схеме энергетических уровней определять положение полос поглощения. Любому электронному состоянию молекул соответствует набор различных колебательных уровней энергии. Колебательная структура полосы, соответствующей переходу между электронными уровнями, может отчетливо проявляться не только в спектрах газов, но и в спектрах некоторых растворов, что дает возможность получать дополнительную информацию о взаимодействии молекул. Спектрофотометрическое исследование спектров молекул в видимой и УФ областях позволяет установить вид электронных переходов и структуру молекул. При этом часто исследуют влияние различных типов замещения в молекулах, изменения растворителей, температуры и других физико-химических факторов.
В ИК области проявляются переходы между колебательными и вращательными уровнями. Среди частот колебаний молекул выделяют так называемые характеристические, которые практически постоянны по величине и всегда проявляются в спектрах химических соединений, содержащих определенные функциональные группы (вследствие чего эти частоты иногда называют групповыми).
Теория колебаний сложных молекул позволяет расчетным путем предсказать колебательный спектр соединений, т. е. определить частоты и интенсивности полос поглощения [2].
Колебательные спектры молекул чувствительны не только к изменению состава и структуры молекул, но и к изменению различных физических и химических факторов, например, изменению агрегатного состояния вещества, температуры, природы растворителя, концентрации исследуемого вещества в растворе, различные взаимодействия между молекулами вещества. Поэтому ИК спектры широко используют для исследования, качественного и количественного анализа разнообразных веществ [8].
2.1 Спектральный анализ
Спектральный анализ как метод качественного и количественного определения состава веществ основан на исследовании их спектров испускания, поглощения, отражения и люминесценции.
В зависимости от цели исследования, свойств анализируемого вещества спектральный анализ подразделяют на ряд самостоятельных методов:
- атомно-абсорбционный анализ;
- атомно-флуоресцентный анализ;
- инфракрасная спектроскопия;
- молекулярная оптическая спектроскопия;
- спектрофотометрия;
- рентгеновская спектроскопия.
Молекулярный спектральный анализ (МСА) определяет молекулярный состав вещества по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света.
Излучения в производстве и защита от них
... атомов облучаемого вещества. Поскольку у человека и млекопитающих основную часть массы тела составляет вода (75%), первичные процессы во многом определяются поглощением излучения водой клеток, ионизацией молекул воды с ...
Атомный спектральный анализ (АСА) определяет элементный состав образца по атомным (ионным) спектрам испускания и поглощения.
Эмиссионный спектральный анализ производят по спектрам испускания атомов, ионов и молекул, возбуждённым различными источниками электромагнитного излучения.
Абсорбционный спектральный анализ осуществляют по спектрам поглощения анализируемых объектов (атомов, молекул, ионов вещества).
Пробу исследуемого вещества вводят в источник излучения, где происходят ее испарение, диссоциация молекул и возбуждение образовавшихся атомов (ионов).
Последние испускают характеристическое излучение, которое поступает в регистрирующее устройство спектрального прибора.
При качественном спектральном анализе спектры проб сравнивают со спектрами известных элементов, приведенных в соответствующих атласах и таблицах спектральных линий, и таким образом устанавливают элементный состав анализируемого вещества. При количественном анализе определяют количество (концентрацию) искомого элемента в анализируемом веществе по зависимости величины аналитического сигнала (плотность почернения или оптическая плотность аналитической линии на фотопластинке; световой поток на фотоэлектрический приемник) искомого элемента от его содержания в пробе [15].
Чувствительность и точность спектрального анализа зависят главным образом от физических характеристик источников излучения (возбуждения спектров) — температуры, концентрации электронов, времени пребывания атомов в зоне возбуждения спектров, стабильности режима источника и т.д. Для решения конкретной аналитической задачи необходимо выбрать подходящий источник излучения, добиться оптимизации его характеристик с помощью различных приемов — использование инертной атмосферы, наложение магнитного поля, введение специальных веществ, стабилизирующих температуру разряда, степень ионизации атомов, диффузионные процессы на оптимальном уровне и т.д.
Спектры регистрируют с помощью спектрографов и спектрометров (квантометров).
Имеется много типов этих приборов, различающихся светосилой, дисперсией, разрешающей способностью, рабочей областью спектра. Большая светосила необходима для регистрации слабых излучений, большая дисперсия — для разделения спектральных линий с близкими длинами волн при анализе веществ с многолинейчатыми спектрами, а также для повышения чувствительности анализа. В качестве устройств, диспергирующих свет, используют дифракционные решетки, имеющие от нескольких сотен до нескольких тысяч штрихов на миллиметр, значительно реже — кварцевые или стеклянные призмы.
С помощью спектрального анализа определяют как основные компоненты, составляющие 50-60% вещества анализируемых объектов, так и незначительные примеси в них (до 10 -5 — 10-8 % и менее).
Спектральный анализ — наиболее распространённый аналитический метод. С помощью этого метода выполняется 20- 30% всех анализов, в том числе контроль состава сплавов в металлургии, автомобильной и авиационной промышленности, технологии переработки руд, анализ экологических объектов и материалов высокой чистоты, химические, биологические и медицинские исследования [6].
2.2 Явление абсорбции света
Абсорбцией называют процесс поглощения газа жидким поглотителем, в котором газ растворим в той или иной степени. Обратный процесс — выделение растворенного газа из раствора — носит название десорбции.
Измерение концентрации растворов
... Количество света, проходящего сквозь раствор, указывает на концентрацию конкретных химических веществ, которые не пропускают свет. Поглощение света связано с взаимодействием ... спектрофотометра; Проведение измерений оптической плотности окрашенных растворов при помощи спектрофотоколориметра; Проведение измерений концентраций растворенных компонентов в двухкомпонентных окрашенных растворах при помощи ...
В абсорбционных процессах (абсорбция, десорбция) участвуют две фазы — жидкая и газовая и происходит переход вещества из газовой фазы в жидкую (при абсорбции) или, наоборот, из жидкой фазы в газовую (при десорбции).
На практике абсорбции подвергают большей частью не отдельные газы, а газовые смеси, составные части которых (одна или несколько) могут поглощаться данным поглотителем в заметных количествах. Эти составные части называют абсорбируемыми компонентами или просто компонентами, а не поглощаемые составные части — инертным газом.
Жидкая фаза состоит из поглотителя и абсорбируемого компонента. Во многих случаях поглотитель представляет собой раствор активного компонента, вступающего в химическую реакцию с абсорбируемым компонентом; при этом вещество, в котором растворен активный компонент, называется растворителем.
Инертный газ и поглотитель являются носителями компонента соответственно в газовой и жидкой фазах. Протекание абсорбционных процессов характеризуется их статикой и кинетикой.
Статика абсорбции, т. е. равновесие между жидкой и газовой фазами, определяет состояние, которое устанавливается при весьма продолжительном соприкосновении фаз. Равновесие между фазами определяется термодинамическими свойствами компонента и поглотителя и зависит от состава одной из фаз, температуры и давления.
Кинетика абсорбции, т. е. скорость процесса массообмена, определяется движущей силой процесса (т. е. степенью отклонения системы от равновесного состояния), свойствами поглотителя, компонента и инертного газа, а также способом соприкосновения фаз (устройством абсорбционного аппарата и гидродинамическим режимом его работы)[12].
Различают физическую абсорбцию и хемосорбцию (абсорбция, сопровождаемая химической реакцией).
При физической абсорбции растворение газа не сопровождается химической реакцией. В данном случае над раствором существует более или менее значительное равновесное давление компонента и поглощение последнего происходит лишь до тех пор, пока его парциальное давление в газовой фазе выше равновесного давления над раствором. Полное извлечение компонента из газа при этом возможно только при противотоке и подаче в абсорбер чистого поглотителя, не содержащего компонента. При хемосорбции абсорбируемый компонент связывается в жидкой фазе в виде химического соединения. При необратимой реакции равновесное давление компонента над раствором ничтожно мало и возможно полное его поглощение. При обратимой реакции над раствором существует заметное давление компонента, хотя и меньшее, чем при физической абсорбции.
Промышленное проведение абсорбции может сочетаться или не сочетаться с десорбцией. Если десорбцию не производят, поглотитель используется однократно. При этом в результате абсорбции получают готовый продукт, полупродукт или, если абсорбция проводиться с целью санитарной очистки газов. Сочетание абсорбции с десорбцией позволяет многократно использовать поглотитель и выделять абсорбируемый компонент в чистом виде. Для этого раствор после абсорбера направляют на десорбцию, где происходит выделение компонента, а регенерированный (освобожденный от компонента) раствор вновь возвращают на абсорбцию. При такой схеме (круговой процесс) поглотитель не расходуется, если не считать некоторых его потерь, и все время циркулирует через систему абсорбер — десорбер — абсорбер [5].
Дипломная работа поглощение бурового раствора
... Анализ мероприятий и методов предупреждения поглощений бурового раствора. 5. Анализ методов ликвидации поглощений бурового раствора. 6. Анализ зарубежного опыта ликвидации поглощений бурового раствора. 7. Постановка задачи развития технологии ликвидации поглощений бурового раствора при дальнейшем обучении в магистратуре. 1 Анализ геолого-технических условий на ...
2.3 Принципы атомно-абсорбционного анализа
Метод основан на поглощении ультрафиолетового или видимого излучения атомами газов. Чтобы провести пробу в газообразное атомное состояние, ее впрыскивают в пламя [2].
Превращение анализируемой пробы из твердого или жидкого состояния в атомный пар происходит в атомизаторе. Пар вводят в аналитическую зону атомизатора, просвечиваемую источником излучения с линейчатым спектром определяемого элемента.
В результате поглощения свободными атомами энергии падающего излучения происходит уменьшение потока света Ф ν 0 на частотах ν, соответствующих электронным переходам с основного на более высокие энергетические уровни. Величина потока света после поглощения описывается выражением
Ф ν = Фν 0 ![]() ,
,
где k ν — коэффициент поглощения на частоте ν; l — длина поглощающего слоя.
Наибольшее поглощение соответствует более вероятным резонансным частотам для переходов на ближайшие энергетические уровни. Величина k ν зависит от концентрации ng (g — газообразное состояние) свободных атомов в поглощающем слое и характеристик спектральной линии: силы осциллятора, параметров уширения с сверхтонкой структуры.
Ширина линии испускания δν э и поглощения δνа зависит от температуры, состава и давления газов в излучающем и поглощающем слое. При атомно-абсорбционных измерениях используются источники излучения, работающие при низком давлении заполняющего газа (≈ 103 Па), при этом δνэ составляет величину порядка 10-3 нм. Для атомизаторов при атмосферном давлении δνа порядка 10-2 нм. Таким образом обеспечивается условие δνэ <δνа , при котором коэффициент поглощения пропорционален концентрации атомов в поглощающем слое, kν ![]() ng .
ng .
А = lg (![]() ) = αNg ,
) = αNg ,
где α — коэффициент, зависящий от характеристик линии и геометрии поглощающего слоя.
При атомизации пробы на выход регистрирующего устройства поступает аналитический сигнал U(t), величина которого при отсутствии искажений со стороны электронной схемы пропорциональная измеряемой абсорбции.
Наиболее популярным источником для АА анализа является лампа с полым катодом, изготовленным из определяемого металла или его сплава. Спектрлинии металлов линии металлов катода и заполняющего лампу газа, обычно Ne. В практике атомно-абсорбционного анализа наибольшее распространение получили пламенные и электротермические атомизаторы. В пламенных атомизаторах аналитической зоной служит просвечиваемый участок непосредственно над газовой горелкой. Обычно раствор распыляют потоком газа и равномерно вводят в пламя в виде аэрозоля, регистрируя установившееся значение абсорбции. Электротермическими атомизаторами служат печи сопротивления — трубки, тигли, стержни, нити из тугоплавкого материала. В этих атомизаторах осуществляют полное импульсное испарение микропроб анализируемого вещества. Пары пробы переносятся через просвечиваемую полость трубки или зону над телом нагрева за счет диффузии, конвекции или с помощью потока инертного газа.
При неполной атомизации пробы появление в аналитической зоне молекул основного вещества и твердых частиц может сопровождаться спектральными помехами. Источником помех, кроме того, является собственное излучение атомизатора. Для электротермического атомизатора это излучение печи, имеющее спектр черного тела, для пламенного — излучение продуктов горения со структурой молекулярного спектра.
В атомно-абсорбционных спектрометрах используются монохроматоры с решетками 3000 — 2800 штр/мм, позволяющие выделять спектральную полосу шириной 0,2 — 2 нм в интервале 190 — 850 нм. Выделяемый интервал по ширине существенно превосходит линию источника, поэтому одновременно с потоком излучения на аналитической линии с частотой ν через монохроматор к фотоприемнику проходит поток постороннего излучения Ф, принадлежащего другим линиям и фону источника или атомизатора.
Излучение, проходящее через монохроматор, преобразуется в фототок. После усиления и логарифмирования фототоков i 0 f и if до и после поглощения света производят операцию вычитания lgi0 f -lgif . Соответствующий электрический сигнал в электронном преобразователе и регистрирующем устройстве подвергается искажениям, связанным с конечной шириной полосы пропускания схемы. Например, при постоянном значении абсорбции аналитический сигнал описывается с помощью выражения:
U(t)![]() ,
,
где τ RC — постоянная времени регистрирующей схемы,
U(t) — аналитический сигнал.
Для импульсных сигналов этими искажениями можно пренебречь только при условии τ RC ![]() τ (τ — среднее время пребывания частиц в аналитической зоне).
τ (τ — среднее время пребывания частиц в аналитической зоне).
В этом случае с учетом разного рода помех
U(t)![]()
где А m — абсорбция, обусловленная посторонними частицами; А — абсорбция определяемого элемента в поглощающем слое;f — искажающая функция, зависящая от соотношения полезного и мешающего потоков света.
Аналитический сигнал поступает на вход регистрирующего устройства в присутствии флуктуаций разного рода, среди которых наиболее существенны сравнительно медленные изменения яркости спектральной линии. Для того чтобы выделить из аналитического сигнала полезную составляющую, обусловленную атомным поглощением, необходимо устранить воздействие посторонних источников излучения, учесть помехи, исключить дрейф нулевой линии.
Для повышения интенсивности спектральных линий при сохранении достаточно малой их ширины применяют импульсное питание ламп с полым катодом или вводят в лампу дополнительный дуговой разряд[4].
Атомная абсорбция основана на измерении излучения, поглощенного нейтральными, невозбужденными атомами, находящимися в пламени, которых в пламени во много раз больше, чем возбужденных. Этим объясняется высокая чувствительность метода при определении элементов, имеющих высокую энергию возбуждения, т. е. трудно возбуждающихся [13].
ГЛАВА 2. ОСНОВЫ ФОТОКОЛОРИМЕТРИИ, .1 Закон Бугера-Ламберта-Бера
спектральный атомный абсорбционный фотоколориметрический
В основе спектроскопических методов анализа лежат два основных закона. Первый из них — закон Бугера — Ламберта, второй закон — закон Бера. Объединенный закон Бугера-Ламберта-Бера имеет следующую формулировку: поглощение монохроматического света окрашенным раствором прямо пропорционально концентрации поглощающего свет вещества и толщине слоя раствора, через который он проходит.
Закон Бугера — Ламберта — Бера является основным законом светопоглощения и лежит в основе большинства фотометрических методов анализа. Математически он выражается уравнением:
I =Ι 0 ·![]()
или ln = fx,
где f — коэффициент поглощения,
x — толщина поглощающего слоя (размер кюветы).
Величину ln называют оптической плотностью поглощающего вещества и обозначают буквой Е. Тогда закон можно записать так:
Е = ln = fx
Для разбавленных растворов:
f![]() E = kdc,
E = kdc,
где d — толщина поглощающего слоя (размер кюветы),
с — концентрация вещества,
k — коэффициент поглощения.
Отношение интенсивности потока монохроматического излучения, прошедшего через испытуемый объект, к интенсивности первоначального потока излучения называется прозрачностью, или пропусканием, раствора и обозначается буквой Т:
Т = —
Это соотношение может быть выражено в процентах. Величина Т, характеризующая пропускание слоя толщиной 1 см, называется коэффициентом пропускания. Оптическая плотность Е и пропускание Т связаны между собой соотношением:
Е = -lg Т.
Е и Т являются основными величинами, характеризующими поглощение раствора данного вещества с определенной его концентрацией при определенной длине волны и толщине поглощающего слоя.
Величина коэффициента поглощения k зависит от способа выражения концентрации вещества в растворе и толщины поглощающего слоя. Если концентрация выражена в молях на литр, а толщина слоя — в сантиметрах, то он называется молярным коэффициентом поглощения, или коэффициентом экстинкции и обозначается символом ε и равен оптической плотности раствора с концентрацией 1 моль/л, помещенного в кювету с толщиной слоя 1 см.
E = lg = εdc
Величина молярного коэффициента поглощения зависит:
- от природы растворенного вещества;
- длины волны монохроматического света;
- температуры;
- природы растворителя[7].
Поглощение света веществом характеризуется кривой поглощения (см. рис.2.1), которая строится на основе измерения интенсивностей поглощения света определенных длин волн, рассчитанных по закону Бугера-Ламберта-Бера. Если кривая поглощения построена в координатах ε — то положение ее максимума на оси абсцисс (λ,нм) характеризует спектральный цвет и является мерой энергии возбуждения, а положение максимума на оси ординат (εmax ) — интенсивность окраски и является мерой вероятности электронного перехода.
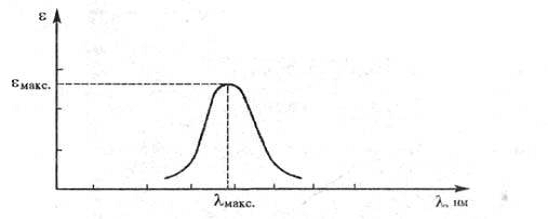
Рис.2.1 Спектральная кривая поглощения
С уменьшением энергии возбуждения λ max смещается в длинноволновую часть спектра, при этом окраска изменяется от желтой к оранжевой, красной и т. д. Такое изменение цвета называется его углублением или батохромным сдвигом. Увеличение энергии возбуждения, приводящее к смещению λmax в коротковолновую область и изменению окраски в обратной последовательности, называется повышением цвета или гипсохромным сдвигом [14].
Вид спектра поглощения определяется как природой образующих его атомов и молекул, так и агрегатным состоянием вещества. Спектр разреженных атомарных газов — ряд узких дискретных линий, положение которых зависит от энергии основного и возбужденных электронных состояний атомов. Спектры молекулярных газов — полосы, образованные тесно расположенными линиями, соответствующими переходам между колебательным и вращательным энергетическими уровнями молекул. Спектр вещества в конденсированной фазе определяется не только природой составляющих его молекул, но и межмолекулярными взаимодействиями, влияющими на структуру электронных уровней. Обычно такой спектр состоит из ряда широких полос различной интенсивности.
По спектрам поглощения проводят качественный и количественный анализ веществ. Абсорбционную спектроскопию широко применяют для изучения строения вещества. Она особенно эффективна при исследовании процессов в жидких средах. По изменениям положения, интенсивности и формы полос поглощения судят об изменениях состава и строения поглощающих свет частиц без их выделения из растворов.
Для наблюдения за процессами, происходящими в течение короткого промежутка времени (от нескольких секунд до ~ 10 -12 с), широко применяют методы кинетической спектроскопии. Они основаны на регистрации (с помощью фотопластинок или фотоэлектрических приемников) спектров поглощения или испускания исследуемой системы после кратковременного воздействия на нее, направленного быстрого смешения с реагентами или возбуждения внешним источником энергии — светом, потоком электронов, электрическим полем и т.п. Спектром сравнения служит спектр «невозбужденной» системы. Методы кинетической спектроскопии используют для изучения механизма реакций (в частности, для установления состава промежуточных продуктов), количественного определения скоростей реакций [11].
Причины несоблюдения закона Бyгера — Ламберта — Бера:
- закон выведен и справедлив только для монохроматического света, поэтому недостаточная монохроматизация может вызвать отклонение закона и тем в большей степени, чем меньше монохроматизация света.
- в растворах могут протекать различные процессы, которые изменяют концентрацию поглощающего вещества или его природу: гидролиз, ионизация, гидратация, ассоциация, полимеризация, комплексообразование и др.
- светопоглощение растворов существенно зависит от рН раствора. При изменении рН раствора могут изменяться:
- степень ионизации слабого электролита;
- форма существования ионов, что приводит к изменению светопоглощения;
- состав образующихся окрашенных комплексных соединений.
Поэтому закон справедлив для сильно разбавленных растворов, и область его применения ограничена [8].
2 Фотоколориметрический метод анализа
Интенсивность окраски растворов можно измерять различными методами. Среди них выделяют субъективные (визуальные) методы колориметрии и объективные, то есть фотоколориметрические.
Визуальными называют такие методы, при которых оценку интенсивности окраски испытуемого раствора делают невооруженным глазом. При объективных методах колориметрического определения для измерения интенсивности окраски испытуемого раствора вместо непосредственного наблюдения пользуются фотоэлементами. Определение в этом случае проводят в специальных приборах — фотоколориметрах, поэтому метод получил название фотоколориметрического.
Фотоколориметрия применяется для измерения поглощения света или пропускания окрашенными растворами. Приборы, используемые для этой цели, называются фотоколориметрами (ФК).
Фотоколориметрические методы измерения интенсивности окраски связаны с использованием фотоэлементов. В отличие от приборов, в которых сравнение окрасок производится визуально, в фотоколориметрах приемником световой энергии является прибор — фотоэлемент. В этом приборе световая энергия преобразуется в электрическую. Фотоэлементы позволяют проводить колориметрические определения не только в видимой, но также в УФ- и ИК-областях спектра. Измерение световых потоков с помощью фотоэлектрических фотометров более точно и не зависит от особенностей глаза наблюдателя. Применение фотоэлементов позволяет автоматизировать определение концентрации веществ в химическом контроле технологических процессов. Вследствие этого фотоэлектрическая колориметрия значительно шире используется в практике заводских лабораторий, чем визуальная [12].
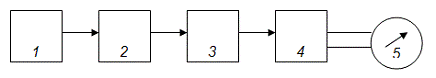
Рис. 2.2
На рисунке 2.2 показан обычный порядок расположения узлов в приборах для измерения пропускания или поглощения растворов.
Основные узлы приборов для измерения поглощения излучения: 1 — источник излучения; 2 — монохроматор; 3 — кюветы для растворов; 4 — преобразователь; 5 — индикатор сигнала [13].
Фотоколориметры в зависимости от числа используемых при измерениях фотоэлементов делятся на две группы: однолучевые (одноплечие) — приборы с одним фотоэлементом и двухлучевые (двуплечие) — с двумя фотоэлементами.
Точность измерений, получаемая на однолучевых ФЭК, невелика. В заводских и научных лабораториях наиболее широкое распространение получили фотоэлектрические установки, снабженные двумя фотоэлементами. В основу конструкции этих приборов положен принцип уравнивания интенсивности двух световых пучков при помощи переменной щелевой диафрагмы, то есть принцип оптической компенсации двух световых потоков путем изменений раскрытия зрачка диафрагмы.
Свет от лампы накаливания 1 с помощью зеркал 2 разделяется на два параллельных пучка. Эти световые пучки проходят через светофильтры 3, кюветы с растворами 4 попадают на фотоэлементы 6 и 6′, которые включены на гальванометр 8 по дифференциальной схеме. Щелевая диафрагма 5 изменяет интенсивность светового потока, падающего на фотоэлемент 6. Фотометрический нейтральный клин 7 служит для ослабления светового потока, падающего на фотоэлемент 6′ [14].
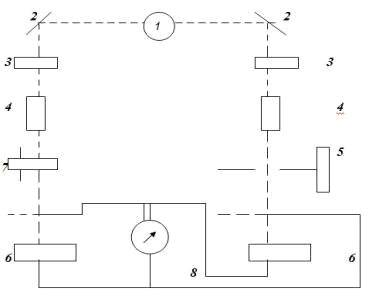
Рис. 2.3 Схема двулучевого фотоэлектроколориметра
Для определения концентрации анализируемых веществ в фотоколориметрии применяют:
- метод сравнения оптических плотностей стандартного и исследуемого окрашенных растворов;
- метод определения по среднему значению молярного коэффициента светопоглощения;
- метод градуировочного графика;
- метод добавок.
Метод сравнения оптических плотностей стандартного и исследуемого окрашенных растворов.
Для определения готовят эталонный раствор определяемого вещества известной концентрации, которая приближается к концентрации исследуемого раствора. Определяют оптическую плотность этого раствора при определенной длине волны. Затем определяют оптическую плотность исследуемого раствора при той же длине волны и при той же толщине слоя. Сравнивая значения оптических плотностей исследуемого и эталонного растворов, находят неизвестную концентрацию определяемого вещества.
Метод сравнения применим при однократных анализах и требует обязательного соблюдения основного закона светопоглощения.
Метод градуировочноro графика.
Для определения концентрации вещества этим методом готовят серию из 5-8 стандартных растворов различной концентрации. При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
- он должен охватывать область возможных измерений концентрации исследуемого раствора;
- оптическая плотность исследуемого раствора должна соответствовать примерно середине градуировочной кривой;
- желательно, чтобы в этом интервале концентраций соблюдался основной закон светопоглощения, то есть график зависимости был прямолинейным;
- величина оптической плотности должна находиться в пределах 0, 14 — 1,3.
Измеряют оптическую плотность стандартных растворов и строят график зависимости Е(С).
Определив Ех исследуемого раствора, по градуировочному графику находят Сх (рис. 2.4).
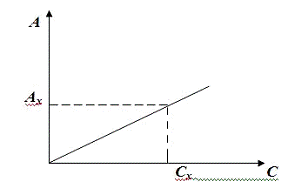
Рис.2.4 Зависимость оптической плотности раствора от концентрации (калибровочная кривая)
Этот метод позволяет определить концентрацию вещества даже в тех случаях, когда основной закон светопоглощения не соблюдается. В таком случае готовят большое количество стандартных растворов, отличающихся по концентрации не более чем на 10%.
Разновидность метода сравнения — метод добавок — основан на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известно количества определяемого вещества.
Применяют его для устранения мешающего влияния посторонних примесей, определения малых количеств анализируемого вещества в присутствии больших количеств посторонних веществ. Метод требует обязательного соблюдения основного закона светопоглощения [15].
ЗАКЛЮЧЕНИЕ
Явление поглощения широко используется в абсорбционном спектральном анализе смеси газов, основанном на измерениях спектров частот и интенсивностей линий (полос) поглощения. Структура спектров поглощения определяется составом и строением молекул, поэтому изучение спектров поглощения является одним из основных методов количественного и качественного исследования веществ.
Важным достоинством атомно-спектроскопического элементного анализа является возможность определения большого числа разных элементов одновременно. Это обстоятельство очень существенно для многоэлементного анализа проб малой массы и объема. Важной для анализа чистых веществ является возможность автоматизации всех основных звеньев аналитического процесса, благодаря чему повышается эспрессность, увеличивается производительность анализа. Не последнюю роль в оценке достоинств различных методов контроля высокочистых веществ и материалов играет экономичность этих методов — стоимость аппаратуры, расход энергии, трудовые затраты, продолжительность анализа.
В курсовой работе представлены теоретические основы и методика применения атомно-абсорбционного спектрохимического анализа. В работе решены следующие задачи:
- раскрыта природа спектров, структура атомов;
- изучены теоретические основы спектрального анализа и методика атомно-абсорбционного анализа.
В перспективе планируется апробация атомно-абсорбционного анализа на практике.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ ИНФОРМАЦИИ
[Электронный ресурс]//URL: https://inzhpro.ru/kursovaya/atomno-absorbtsionnaya-spektrometriya/
1. http://www.uwms.artefactworkshop.ru/spectroscopia/Атомная спектроскопия и спектральный анализ.
2. Трофимова Т.И. Курс физики. Учеб. Пособие для вузов — 3-е изд., М.: Высшая шк., 1990. — С. 386-389.,412-416.
- Дозоров В.А. Спектральный анализ чистых веществ — 2-е изд., перераб. и дополн. — СПб: Химия, 1994. — С. 191-207.
- http://dostup.at.ua/ Абсорбция.
- http://www.xumuk.ru/encyklopedia/ Спектральный анализ.
- http://www.myunivercity.ru/ Основной закон светопоглощения (Закон Бугера-Ламберта-Бера).
- http://www.chemport.ru/ Абсорбционная спектроскопия.
- http://dic.academic.ru/ Спектроскопия.
- http://sharifulin.pstu.ru Лекция №22 Современная физика атомов и молекул.
- http://www.ximicat.com Абсорбционная спектроскопия.
- Химическая энциклопедия: Цветность органических соединений.
- http://knowledge.allbest.ru/ Реферат «Спектрометрия и фотоколориметрия» Тамбов, 2009
