По данным ВОЗ на конец 2013 года в мире зарегистрировано около 40 миллионов ВИЧ-инфицированных. Пандемия инфекции, вызываемой вирусом иммунодефицита человека (ВИЧ), является в истории человечества крупнейшим событием конца XX века, которое можно поставить в один ряд с двумя мировыми войнами, как по числу жертв, так и по тому ущербу, который она наносит обществу. СПИД, как война, неожиданно обрушился на человечество и продолжает наступать, поражая новые страны и континенты.
Однако ранняя диагностика ВИЧ-инфекции является проблемой во всем мире. В то время как, своевременная диагностика ВИЧ-инфекции позволяет предотвратить осложнения, связанные с поздней стадией ВИЧ-инфекции, снизить риск трансмиссии ВИЧ-инфекции, своевременно назначить этиотропную терапию, снизить заболеваемость и летальность ВИЧ-инфицированных больных. Огромное значение имеет ранняя диагностика ВИЧ-инфекции для проведения противоэпидемических мероприятий.
Диагностика ВИЧ-инфекции по клиническим симптомам в начале болезни не возможна, так как клинические симптомы у ВИЧ-инфицированного пациента могут проявиться через несколько месяцев или даже лет после заражения, поэтому, ранняя диагностика ВИЧ-инфекции ложится на плечи лабораторной службы.
Лично для меня тема данной работы является очень актуальной. Я, как лабораторный техник, решил поставить перед собой следующую цель моей выпускной квалификационной работы: изучение роли лабораторного техника в диагностике ВИЧ-инфекции.
Задачи, необходимые для достижения поставленной цели:
- Изучить эпидемическую ситуацию по ВИЧ-инфекции, в мире, России, Дальнем Востоке, г. Хабаровске в настоящее время.
- Изучить этиологию, клинико-эпидемиологические особенности, принципы лечения и профилактики ВИЧ-инфекции на современном этапе.
- Ознакомиться с существующими в настоящее время методами лабораторной диагностики ВИЧ-инфекции.
- Изучить нормативную документацию по проблеме ВИЧ-инфекции.
- Изучить принципы соблюдения противоэпидемического режима при работе с ВИЧ-инфицированным материалом.
1.
Теоретическая часть, .1 Этиология ВИЧ-инфекции
инфекция эпидемиологический зараженность
ВИЧ-это вирус поражающий иммунную систему человека, этот вирус способствует развитию других инфекционных заболеваний, так как иммунная система теряет способность защитить организм от болезнетворных микроорганизмов.
Классификация:
Вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus).
Принципы ПЦР-диагностики
... диагностика, биологический контроль препаратов крови - вот неполный перечень направлений медицины с применением ПЦР. На сегодняшний день ПЦР-анализ остается наиболее распространенной и динамично развивающейся технологией. ... микроорганизмов - возбудителей заболеваний, так и для исследования генов человека. Себестоимость ПЦР-анализа неуклонно снижается, что способствует все более широкому использованию ...
Название Lentivirus происходит от латинского слова lente — медленный. Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период.
Родственные вирусы:
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10 −3 — 10−4 ошибок / (геном, цикл репликации), что на несколько порядков больше аналогичной величины у эукариот. Длина генома ВИЧ составляет примерно 104 нуклеотидов. Из этого следует, что практически каждый вирус хотя бы на один нуклеотид отличается от своего предшественника. В природе ВИЧ существует в виде множества квази-видов, являясь при этом одной таксономической единицей. В процессе исследования ВИЧ всё-таки были обнаружены разновидности, которые значительно отличались друг от друга по нескольким признакам, в частности различной структурой генома. Разновидности ВИЧ обозначаются арабскими цифрами. На сегодняшний день известны ВИЧ-1, ВИЧ-2, ВИЧ-3, ВИЧ-4.
- ВИЧ-1 — первый представитель группы, открытый в 1983 году. Является наиболее распространённой формой.
— ВИЧ-2 — другой вид вируса иммунодефицита человека, идентифицированный в 1986 году, генетически он очень близок к T-лимфотропному вирусу, и в меньшей степени (около 60%) к вирусу ВИЧ-1. Известно, что ВИЧ-2 менее патогенен и передается с меньшей вероятностью, чем ВИЧ-1. Отмечено, что люди, инфицированные ВИЧ-2, обладают также слабым иммунитетом к ВИЧ-1.
— ВИЧ-3 — редкая разновидность, об открытии которой было сообщено в 1988 году. Обнаруженный вирус не реагировал с антителами других известных групп, а также обладал значительными отличиями в структуре генома. Более распространённое наименование для этой разновидности — ВИЧ-1 подтип O.
- ВИЧ-4 — редкая разновидность вируса, обнаруженная в 1986 году.
Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. ВИЧ-2 распространён преимущественно в Западной Африке. ВИЧ-3 и ВИЧ-4 не играют заметной роли в распространении эпидемии.В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевается ВИЧ-1.
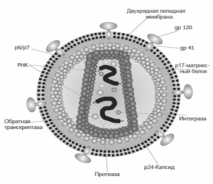
Рис. 1 Строение вириона
иммунодефицита человека представлено на рис. 1. Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100-120 нанометров. Это приблизительно в 60 раз меньше диаметра эритроцита. Капсид зрелого вириона имеет форму усечённого конуса. Иногда встречаются «многоядерные» вирионы, содержащие 2 или более нуклеоидов. В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов. Внутри капсида ВИЧ находится белковонуклеиновый комплекс: две нити вирусной РНК, вирусные ферменты (обратная транскриптаза, протеаза, интеграза) и белок p7. С капсидом также ассоциированы белки Nef и Vif (7-20 молекул Vif на вирион).
Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr. Сам капсид образован ~2,000 копий вирусного белка p24. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60-100:1, а p24:Pol примерно 10-20:1. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связываются -200 копий клеточногоциклофилина А, который вирус заимствует у заражённой клетки.Капсид ВИЧ окружен матриксной оболочкой, образованной -2,000 копий матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидноймембраной, являющейся наружной оболочкой вируса. Она образована молекулами, захваченными вирусом во время его отпочковывания из клетки, в которой он сформировался. В липидную мембрану встроены 72 гликопротеиновых комплекса, каждый из которых образован тремя молекулами трансмембранного гликопротеина (gp41 или TM), служащими «якорем» комплекса, и тремя молекулами поверхностного гликопротеина.С помощью gp120 вирус присоединяется к CD4 рецептору и корецептору, находящимсяна поверхности мембраны клеток.
Таблица 1. Названия и функции основных структурных белков ВИЧ-1:
|
Сокращение |
Описание |
Функции |
|
gp41 (TM, transmembrane) |
трансмембранный гликопротеин массой 41 кДа |
Располагается во внешнем слое липидной мембраны. Играет роль «якоря», удерживающего молекулы другого белка — gp120 |
|
gp120 (SU, surface) |
гликопротеин массой 120 кДа |
Наружный белок вириона. Нековалентносвязан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3 — 5 молекул gp120. Способен связываться с CD4 рецептором. Играет важную роль в процессе проникновения вируса в клетку. |
|
p24 (CA, capsid) |
белок массой 24 кДа |
белок, образующий оболочку нуклеоида (капсида) вируса |
|
p17 (MA, matrix) |
Матриксный белок массой 17 кДа |
Около двух тысяч молекул этого белка образуют слой толщиной 5 — 7 нм, располагающийся между внешней оболочкой и нуклеоидом вируса. |
|
p7 (NC, nucleocapsid) |
Нуклеокапсидный белок массой 7 кДа |
Белок, входящий в состав нуклеоида вируса. Образует комплекс с вирусной РНК. |
1.2 Эпидемиология
ВИЧ передается типичным для всех ретровирусов способами, то есть “вертикально” (ребенку от матери) и “горизонтально”, особенно при половых контактах. Кроме этого к “горизонтальному” пути передачи относятся парентеральный — инъекционный, при попадании любой биологической жидкости от ВИЧ-инфицированного на кожу и слизистые при наличии на них микротравм. Следует, правда, отметить, что в разных биологических жидкостях титр вируса может быть очень различен: максимальная концентрация наблюдается в сперме и крови, а, например, в слюне или слезной жидкости могут находиться лишь единичные экземпляры вируса. Еще одно обстоятельство влияющее на передачу инфекции: некоторые носители ВИЧ выделяют намного больше вируса чем другие, хотя титр вируса в зараженном материале измерить довольно трудно. Передача вируса определяется также другими факторами, такими как травмы, вторичные инфекции, эффективность эпителиальных барьеров, а также присутствие или отсутствие клеток с рецепторами для ВИЧ. Эти факторы позволяют объяснить, почему при одних обстоятельствах, например, при гомосексуальных контактах, вирус распространяется быстрее, чем при других. Важным фактором, влияющим на заразность, может быть стадия инфекции. При большинстве вирусных инфекций наивысшие титры вируса достигаются на ранних стадиях, еще до образования антител. В случае ВИЧ эту фазу трудно изучать, поскольку она обычно бессимптомна, а гуморальный противовирусный ответ еще слаб или вообще не выявляется. Тем не менее, эта стадия, по-видимому, наиболее опасна для окружающих. Есть также данные о том, что больной вновь становится более инфекционным, когда уже развивается СПИД. Суммируя все вышесказанное, можно выделить следующие факторы, влияющие на передачу ВИЧ-инфекции:
* титр вируса
* травма
* вторичная инфекция
* эпителиальные рецепторы
* интенсивность экспозиции
* фаза инфекции
1.3 Патогенез ВИЧ-инфекции
У разных индивидуумов “отзывчивость” организма на заражение ВИЧ неодинакова. Это зависит от специфики их системы гистосовместимости. У ВИЧ-инфицированных чаще, чем у других, встречается HLA-B35 фенотип. Установлено, что тот же фенотип — главный фактор риска для заражения ВИЧ наркоманов, вводящих наркотики внутривенно. В организме вирус внедряется в чувствительные клетки. Основные клетки мишени CD4-лимфоциты (хелперы), на их поверхности есть молекулы CD4-рецепторы, способные связываться с поверхностным белком ВИЧ — gp120. В меньшем числе они содержаться на мембранах макрофагов, еще в меньшем на мембранах В-лимфоцитов. Кроме того, ВИЧ проникает в ЦНС, поражая нервные клетки и клетки нейроглии, в хромаффинные клетки кишечника, в сперму.
1.4 Клинические проявления
Клиническая картина при заражении ВИЧ может быть весьма разнообразной, начиная от острой сероконверсии и кончая полностью выраженным истинным СПИДом много лет спустя. Инфекция может протекать бессимптомно или проявляться клинически. Начальный период после первого контакта с вирусом обычно бывает бессимптомным и может продолжаться до шести недель. Когда наконец появляются симптомы, они часто носят неспецифический характер. Возникает так называемая болезнь сероконверсии. В период острой сероконверсии наблюдается заболевание, сходное с воспалением желез: больной страдает от лихорадки, недомогания, вялости, болей в мышцах и суставах, катара горла, лимфаденопатии. В начальном периоде также может отмечаться обратимая энцефалопатия с потерей ориентации, памяти, сдвигами сознания, острый менингит, миелопатия и невропатия. Вероятно, не у всех, у кого произошла сероконверсия, дело дойдет до хронической инфекции. У многих возможен переход инфекции в латентную фазу. Тем не менее, и в эту фазу больной является инфекционным, хотя и не в такой степени как в период сероконверсии или в стадию выраженного СПИДа.Хроническая инфекция тоже может быть бессимптомной. Ее известные клинические признаки включают цитопению, минорные сопутствующие инфекции и кожные заболевания, лимфаденопатию, а также СПИД-ассоциированный комплекс.
Согласно классификации, предложенной В. И. Покровским в 2001 г., ВИЧ- инфекция в организме проходит 5 стадий:
. Стадия инкубации (стадия 1): с момента заражения до клинических проявлений острой инфекции и/или выработки антител (в среднем от 3 недель до 3 месяцев).
. Стадия первичных проявлений (стадия 2):
«А» — бессимптомная, когда клинические проявления ВИЧ-инфекции или оппортунистических заболеваний отсутствуют, а ответом на внедрение ВИЧ является выработка антител.
«Б» — острая ВИЧ-инфекция без вторичных заболеваний (разнообразные клинические проявления, в большинстве своем похожие на симптомы других инфекций).
«В» — острая ВИЧ-инфекция с вторичными заболеваниями (на фоне временного снижения CD4-лимфоцитов развиваются вторичные заболевания — ангина, бактериальная пневмония, кандидоз, герпес — как правило, хорошо поддающиеся лечению).
Продолжительность клинических проявлений острой ВИЧ-инфекции обычно составляет 2 — 3 недели.
Стадия латентная (стадия 3): Медленное прогрессирование иммунодефицита. Единственным клиническим проявлением является увеличение лимфоузлов, которое может и отсутствовать. Длительность латентной стадии от 2 — 3-х до 20 и более лет, в среднем 6 — 7 лет. Отмечается постепенное снижение уровня CD4-лимфоцитов.
. Стадия вторичных заболеваний (стадия 4): Продолжается репликация ВИЧ, приводящая к гибели CD4-лимфоцитов и к развитию на фоне иммунодефицита вторичных (оппортунистических) заболеваний, инфекционных и/или онкологических. Симптомы на этой стадии имеют обратимый характер, то есть могут проходить сами по себе или в результате лечения. В зависимости от тяжести вторичных заболеваний выделяют следующие стадии.
«Б» — более тяжелые и длительные кожные поражения, саркома Капоши, потеря веса, поражения периферической нервной системы и внутренних органов.
«В» — тяжелые, угрожающие жизни оппортунистические заболевания.
. Терминальная стадия (стадия 5): Поражение органов и систем носят необратимое течение. Даже адекватно проводимые противовирусная терапия и лечение оппортунистических заболеваний не эффективны, и больной погибает в течение нескольких месяцев.
Если у больного имеются какие-либо общие симптомы или признаки СПИДа без дополнительных инфекций или опухолей, встречающихся на поздних стадиях заболевания, то это состояние описывают как СПИД-ассоциированный комплекс. Этот термин охватывает широкий круг явлений. В настоящее время, когда разработан тест на антитела, это понятие имеет меньшее значение, однако оно все еще может быть полезным в клинической практике для выделения той группы больных, в которой можно ожидать перехода в стадию настоящего СПИДа. Более надежные клинические показатели для оценки прогноза будут рассмотрены чуть ниже.
Диагноз “СПИД-ассоциированный комплекс” ставиться в том случае, если пациент имеет более двух симптомов, сохраняющихся в течение трех или более месяцев, а также аномалии по данным более чем двух лабораторных тестов.
Два основных проявления СПИДа — это опухоли и ряд оппортунистических инфекций. Саркома Капоши — самый распространенный и описанный первым пример; в настоящее время выделяют и другие опухоли: неходжкиновскаялимфома (обычно экстранодальная) и плоскоклеточные карциномы ротовой полости и прямой кишки. У большинства больных вначале возникает пневмония, вызванная Pneumocystiscarinii, за которой следуют другие дополнительные инфекции и саркома Капоши. Разнообразные сопутствующие СПИДу инфекции затрагивают практически любую систему организма. Больше всего распространена и характерна для больных как в США, так и в Великобритании пневмоцистная пневмония. Возбудителями пневмонии у больных СПИДом могут быть и другие организмы (см. таблицу).У больных СПИДом в Африке саркома Капоши может сочетаться с так назывемой болезнью Слима (диарея) и другими оппортунистическими инфекциями. Более типичны для африканского континента — туберкулез, криптококкоз, криптоспоридиоз. Спектр клинических проявлений все время расширяется. Первоначально описанные проявления саркомы Капоши и певмоцистной пневмонии относились к болезни с коротким инкубационным периодом. Однако у тех больных, у которых СПИД развивается после более длительного периода, клиническая картина может быть иной. Это как будто уже наблюдается: например, появляются новые виды опухолей и неврологических заболеваний. Наконец, накапливаются данные в пользу того, что поздняя стадия болезни сопряжена с лимфоидной интерстициальной пневмонией, гранулематозным гепатитом и энтеропатией.
Средняя продолжительность жизни больных СПИДом после постановки диагноза варьирует в зависимости от имеющихся клинических проявлений. В Америке она составляет около 9 месяцев для больных с пневмоцистнойпневмонией и 31 месяц для больных с саркомой Капоши.Теперь опишем последовательность развития клинических симптомов при ВИЧ-инфекции.
Примерно через 2-4 недели после внедрения ВИЧ у половины зараженных появляется лихорадка, длящаяся от 2 до 10 дней, увеличиваются лимфатические узлы, печень и селезенка, снижается количество лимфоцитов в крови. Затем все проходит будто бы бесследно: инфицированный человек ни на что не жалуется. Однако через несколько месяцев (а чаще лет) у него медленно но неуклонно начинают обнаруживаться симптомы заболевания.
Отмечено, что при переливании крови, инфицированной ВИЧ, средняя продолжительность инкубационного периода составляет у детей два года, у пожилых лиц — пять лет, у людей среднего возраста — восемь.Обычно, прежде чем развернуться полной картине заболевания, у больного наступает пре-СПИД: постепенно повышается температура до 38-39шС, отмечается обильное потоотделение, особенно в ночное время, резкая утомляемость, разбитость, исчезает аппетит. Важный, а то и самый ранний признак — стойкое увеличение лимфатических узлов: шейных, подчелюстных, затылочных, но, как правило, не паховых. Расстраивается деятельность кишечника: частый водянистый стул. Происходит прогрессирующая потеря веса. Все эти симптомы рассматриваются как пре-СПИД только в том случае, если у больных установлено вирусоносительство и если при обследовании иммунной системы обнаруживается снижение количества Т-хелперов при относительно увеличенном или неизмененном количестве Т-супрессоров. В присутствии вируса особое значение имеет лимфаденопатия неясной этиологии. И чтобы исключить лимфомы, сифилис, туберкулез, делается биопсия лимфатических узлов.В дальнейшем болезненные симптомы начинают нарастать. Похудение может достигать 10-15 килограммов и более. Нередко присоединяются оппортунистические инфекции, и прежде всего пневмоцистная пневмония. У значительной части больных развивается саркома Капоши. Наличие ее у лиц моложе 60 лет в сочетании с положительными результатами лабораторных исследований (появление антител к ВИЧ, снижение числа Т-хелперов) служит несомненным доказательством СПИДа. Так же как лимфомы головного мозга. Злокачественные опухоли характерны для 40% больных СПИДом, причем из этой цифры 85% приходится на саркому Капоши и 10% на злокачественные лимфомы. Заболевание длится от нескольких месяцев до 4-5 лет. Исход его — смерть. При СПИДе могут быть периодические обострения и временные улучшения. У разных больных отмечается преобладание тех или иных симптомов: у одних поражаются преимущественно легкие, у других — нервная система, третьих мучает острая диарея и др. Но, как правило, самый ранний признак — лимфаденопатия, тем более если она продолжается больше двух месяцев без видимых причин. При диагностике принимаются во внимание эпидемиологические данные: особенно подозрительно, если саркома Капоши и лимфомы диагностируются у гомосексуалистов, наркоманов, лиц с беспорядочными половыми связями. В последние годы вызывают тревогу сопровождающие СПИД, а также пре-СПИД признаки поражения центральной нервной системы. Наиболее опасный и частый симптом — прогрессирующее слабоумие (деменция) как результат атрофии коры головного мозга. Этот симптом регистрируется сейчас примерно у 50% больных. По мнению многих специалистов, мозговые нарушения, преимущественно слабоумие, могут развиться у каждого человека, инфицированного ВИЧ. При вскрытии у 2/3 больных, умерших от СПИДа, наблюдалась атрофия ткани мозга. Предполагается, что у взрослых нарушения нервной деятельности могут наступить даже через 20-30 лет после заражения и что средняя продолжительность скрытого периода “зреющего” слабоумия составляет 15 лет. Отмечаются также поражения сосудов мозга, менингит. Больные часто жалуются на головную боль, снижение остроты зрения. Возникают абсцессы, вызванные токсоплазмами, микобактериями, грибами Candida.Размножение ВИЧ в клетках мозга приводит к утрате кратковременной памяти, нарушению координации, мышечной слабости, расстройству речи, психики. При этом поражение мозга не всегда сопровождается иммунодефицитом. При тщательном неврологическом обследовании те или иные “сбои” в работе мозговой деятельности — ослабленное внимание, затрудненная координация движений, замедленность реакций — удается распознать и у так называемых бессимптомных носителей. Поэтому чрезвычайно важно подвергать такому обследованию всех инфицированных лиц, тем более если от них зависит жизнь и здоровье других людей. В случае, если у них подтверждаются соответствующие изменения в функциях мозга, их отстраняют от работы.
Врачей очень тревожит, что эпидемия слабоумия распространится среди молодежи, инфицированной ВИЧ. Вместе с тем, самые ранние и выраженные мозговые нарушения наблюдаются у детей, особенно — у заразившихся в утробе матери или сразу после рождения.
2. Исследовательская часть, .1 Установление факта зараженности ВИЧ-инфекцией
этап — иммуноферментный анализ (ИФА): метод ИФА является скрининговым (отборочным) — отбор предположительно инфицированных лиц, то есть его целью является выявление подозрительных лиц и отсеивание здоровых лиц; антитела к ВИЧ выявляют с помощью других антител к искомым антителам (антитела против других антител).
Эти «вспомогательные» антитела метят ферментом. Все скрининговые тесты обязаны быть высокочувствительными, чтобы не пропустить больного. Из-за этого их специфичность не очень высокая, то есть ИФА может дать положительный ответ («вероятно болен») у неинфицированных людей (например, у больных аутоиммунными заболеваниями: ревматизм, системная красная волчанка и др.).
Частота ложноположительных результатов при использовании различных тест-систем колеблется от 0,02 до 0,5%. Если у человека ИФА дало положительный результат, то для подтверждения факта инфицирования ВИЧ необходимо обследоваться дальше. При проведении ИФА в 3 — 5% случаев возможны ложноотрицательные результаты — если инфицирование произошло относительно недавно и уровень антител еще очень низкий, или в терминальной стадии болезни, характеризующейся тяжелым поражением иммунной системы с глубоким нарушением процесса антителообразования. Поэтому при наличии данных, свидетельствующих о контакте с инфицированными ВИЧ обычно проводят повторные исследования через 2 — 3 месяца.этап — Имуноблоттинг (в модификации WesternBlot, вестерн-блот): является более сложным методом и служит для подтверждения факта инфицирования. Этот метод выявляет не комплексные антитела к ВИЧ, а антитела к отдельным его структурным белкам (p24, gp120, gp41 и др.).
Результаты иммуноблоттинга считаются положительными, если выявляются антитела хотя бы к трем белкам, один из которых кодируется генами env, другой — генами gag, третий — генами pol. Если обнаруживаются антитела к одному или двум белкам, результат считается сомнительным и требует подтверждения. В большинстве лабораторий диагноз ВИЧ-инфекции ставится, если одновременно выявляются антитела к белкам р24, р31, gp4l и gpl20/gp160. Суть метода: вирус разрушают на компоненты (антигены), которые состоят из ионизированных аминокислотных остатков, а потому все компоненты имеют отличающийся друг от друга заря; затем с помощью электрофореза (электрического тока) антигены распределяются на поверхности полоски — если в исследуемой сыворотке есть антитела к ВИЧ, то они будут взаимодействовать со всеми группами антигенов, а это можно выявить.Следует помнить, что антитела к ВИЧ появляются у 90-95% инфицированных в течение 3-х месяцев после заражения, у 5-9% инфицированных антитела к ВИЧ появляются через 6 месяцев и у 0,5-1% инфицированных антитела к ВИЧ появляются в более поздние сроки. В стадии СПИДа количество антител может снижаться, вплоть до полного исчезновения.В иммунологии существует такое понятие, как «серологическое окно» — период от инфицирования до появления такого количества антител, которое можно выявить. Для ВИЧ этот период обычно продолжается от 2 до 12 недель, в редких случаях дольше. В период «серологического окна» по анализам человек здоров, но на самом деле является зараженным ВИЧ. Установлено, что ДНК ВИЧ может находиться в геноме человека не менее трех лет без признаков активности и антитела к ВИЧ (маркеры ВИЧ-инфицирования) не появляются. В данный период («серологическое окно») выявить ВИЧ-инфицированного и даже через 1-2 недели после заражения возможно с помощью полимеразной цепной реакции (ПЦР).
Это чрезвычайно чувствительный метод — теоретически можно выявить 1 ДНК на 10 мл среды. Суть метода заключается в следующем: с помощью полимеразной цепной реакции получают много копий нуклеиновой кислоты (вирус является нуклеиновой кислотой -ДНК или РНК — в белковой оболочке), которые потом выявляют с помощью меченых ферментов или изотопов, а также по характерному строению. ПЦР является дорогостоящим методом диагностики, поэтому при скрининге и в плановом порядке не используется.
Определение стадии заболевания:
В основе развития СПИДа лежит, в первую очередь, разрушение Т-лимфоцитов-хелперов, маркируемыхмоноклональными антителами — кластерами дифференцировки — как CD4. В связи с этим проведение диагностики и наблюдение за прогрессированием заболевания невозможно без контроля субпопуляции Т-хелперов, который наиболее удобно осуществлять с помощью лазерного клеточного сортировщика. При слабо выраженной ВИЧ-инфекции количество Т-лимфоцитов — чрезвычайно вариабельный показатель. В целом, снижение числа клеток CD4 (абсолютное и относительное) обнаруживается у лиц, ВИЧ-инфицирование которых произошло не менее года назад. С другой стороны, на ранних стадиях инфекции нередко оказывается резко повышенным число Т-супрессоры (CD8) как в периферической крови, так и в увеличенных лимфоузлах.При выраженном СПИДе абсолютное большинство больных имеет сниженное общее число Т-лимфоцитов (менее 1000 в 1 мкл крови, в том числе лимфоцитов CD4 — менее чем 22 в 1 мкл, тогда как абсолютное значение содержания CD8 остаётся в пределах нормы).
Соответственно, резко снижается соотношение CD4/ CD8. Ответ Т-лимфоцитов invitro на стандартные антигены и митогены снижается в строгом соответствии с относительно сниженным числом CD4.Для поздних стадии СПИДа характерны общая лимфопения, нейтропения, тромбоцитопения (соответственно, снижение числа лимфоцитов, нейтрофилов и тромбоцитов), анемия. Эти изменения могут быть следствием центрального угнетения кроветворения за счёт поражения кроветворных органов вирусом, а также — аутоиммунного разрушения клеточных субпопуляции на периферии. Кроме того, для СПИДа характерно умеренное увеличение количества гамма-глобулинов с доминирующим увеличением содержания IgG. Больные с выраженными симптомами СПИДа нередко имеют повышенный уровень IgA. На некоторых стадиях заболевания существенно повышается уровень таких маркёров СПИДа, как в1-микроглобулин, кислотостабильныйб-интерферон, б1-тимозин. То же происходит с секрецией свободного неоптерина — метаболита макрофагов. Пока не представляется возможным оценить относительную значимость каждого из перечисленных тестов, число которых постоянно возрастает. Поэтому их следует рассматривать во взаимодействии с маркёрами ВИЧ-инфекции как иммуновирусологического, так и цитологического характера. Для клинического анализа крови характерны лейкопения, лимфопения (соответственно, снижение числа лейкоцитов и лимфоцитов).
Стадии:
— «стадия инкубации» — антитела к ВИЧ еще не выявляются; диагноз ВИЧ-инфекции на данной стадии ставится на основании эпидемиологических данных и лабораторно должен подтверждаться обнаружением в сыворотке крови пациента вируса иммунодефицита человека, его антигенов, нуклеиновых кислот ВИЧ;
— «стадия первичных проявлений» — в данном периоде уже имеется выработка антител:;
А — «бессимптомная» — ВИЧ-инфекция проявляется только выработкой антител;
Б — «острая ВИЧ-инфекция без вторичных заболеваний» — в крови больных могут обнаруживаться широкоплазменные лимфоциты — «мононуклеары» и часто отмечается транзиторное снижение уровня СD4-лимфоцитов (острая клиническая инфекция отмечается у 50-90% инфицированных лиц в первые 3 месяца после заражения; начало периода острой инфекции, как правило, опережает сероконверсию, т.е. появление антител к ВИЧ);
В — «острая ВИЧ-инфекция с вторичными заболеваниями» — на фоне снижения уровня СD4-лимфоцитов и развившегося вследствие этого иммунодефицита появляются вторичные заболевания различной этиологии (ангина, бактериальная и пневмоцистная пневмония, кандидозы, герпетическая инфекция и др.);
— «латентная» — в ответ на прогрессирование иммунодефицита происходит модификация иммунного ответа в виде избыточного воспроизводства СD4-клеток с последующим постепенным снижением уровня СD4-лимфоцитов, в среднем со скоростью 0,05-0,07×109/л в год; в крови обнаруживаются антитела к ВИЧ;
— «стадия вторичных заболеваний» — истощение лимфоцитов популяции CD4, концентрация антител к вирусу значительно снижается (в зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В);
— «терминальная стадия» — типично снижение количества СD4-клеток ниже 0,05×109/л; концентрация антител к вирусу значительно снижается или антитела могут не определяться.
2.1 Методы выявления ВИЧ-инфекции
Своевременная диагностика ВИЧ-инфекции позволяет предотвратить осложнения, связанные с поздней стадией ВИЧ-инфекции, снизить риск трансмиссии ВИЧ-инфекции, своевременно назначить ВААРТ, снизить заболеваемость и летальность ВИЧ-инфицированных больных.
Однако ранняя диагностика ВИЧ-инфекции является проблемой во всем мире. Так по данным центра по контролю заболеваемости, Атланта, у 41% ВИЧ- инфицированных больных СПИД развивается в течение 1 года после установления диагноза, что затрудняет предотвращение неблагоприятных исходов. Все диагностические тесты на ВИЧ можно условно разделить на 2 группы:
. Тесты, позволяющие установить факт инфицирования ВИЧ
. Тесты, позволяющие контролировать течение (мониторинг) ВИЧ-инфекции у инфицированного человека (установить стадию ВИЧ-инфекции, определить показания к началу терапии, оценить эффективность терапии).
. Установление факта инфицированности ВИЧ.
. Серологические тесты:
- определение антител к ВИЧ (ИФА, иммуноблот)
- определение антигена Р24
. Молекулярно-генетические тесты:
- Определение РНК вируса
- Определение ДНК провируса
В обычной (рутинной) практике для диагностики ВИЧ используется так называемый стандартный протокол серологического тестирования ВИЧ, в котором используются доступные и высокоточные тесты. Протокол включает проведение диагностики ВИЧ в 2 этапа: 1 -й этап (скрининговый) — определение антител к ВИЧ методом ИФА и при получении 2 положительных результатов выполняют 2 этап (подтверждающий тест) — иммуноблот, который позволяет определить наличие АТ к нескольким антигенам: сердцевины — р17, р24, р55, оболочки — gpl20, 160, 41, ферментам — рЗ 1, р51, рбб).
Чувствительность протокола — 98-99,8%, специфичность — 99,994%. Проблема «диагностического окна». Одна из важнейших проблем тестирования на ВИЧ — так называемый период диагностического окна. Это срок, который проходит с момента заражения ВИЧ до появления определимого уровня антител (Busch 1997).
Современные скрининг-тесты выявляют ВИЧ-инфекцию через 38 дней после заражения. Крайне редко ВИЧ-инфекция выявляется только через 3-6 месяцев после заражения. Чтобы сократить период диагностического окна, в скрининг-тестах четвертого поколения определяются и антитела к ВИЧ, и антиген р24.
Прямые тесты на ВИЧ. Диагноз ВИЧ-инфекции можно поставить не только на основании косвенных признаков (наличия антител к ВИЧ), но и на основании прямых доказательств присутствия вируса. К прямым тестам относят:
- Выделение вируса в культуре клеток — исследование, которое приберегают для особых случаев: оно требует специального оборудования и подготовки; в клинической практике не используется.
- Тест на антиген р24 (скрининг-тесты четвертого поколения помимо антител к ВИЧ выявляют и антиген р24);
- Вирусные нуклеиновые кислоты (то есть генетический материал ВИЧ) провирусную кДНК в лейкоцитах, вирусную РНК.
В связи с возможностью получения ложнопозитивных и ложнонегативных результатов при серологическом тестировании на ВИЧ у части обследуемых применяются молекулярно-генетические методы тестирования — определение вирусной РНК или провирусной ДНК ВИЧ методом ПЦР.
Пациенты, которым проводится диагностика ВИЧ с использованием ПЦР:
- новорожденные
- больные с агаммаглобулинемией
- больные находящиеся в периоде «серологического окна»
- острая ретровирусная инфекция
- доноры крови.
В РБ любой желающий может пройти анонимное обследование на ВИЧ- инфекцию в любом медицинском учреждении. Пациенту гарантируется полнаяконфендициальность, которая охраняется законом РБ. Кроме того, больные обследуются по клиническим показаниям при наличии признаков заболеваний подозрительных на проявление ВИЧ. Контингенты, подлежащие обязательному тестированию на ВИЧ определены в приказе М3 РБ №351, 1998.Контингенты, подлежащие обследованию на ВИЧ в РБ (Служебное письмо М3 РБ 18.12.2009 № 02-2-04/4037 «О медицинском освидетельствовании на ВИЧ»)
— Доноры, иностранные граждане, лица с клиническими симптомами заболеваний (лихорадка, лимфаденопатия, потеря массы тела, рецидивы пневмоний, серозный менингит неустановленной этиологии, энцефалит неустановленной этиологии, нейропатии, слабоумие и др.).
Больные с подозрением или подтвержденным диагнозом (рецидивы бактериальных инфекций, кандидоз, криптококкоз, туберкулез, сепсис, саркома, мононуклеоз, образования головного мозга, лимфомы и др.).
Новорожденные с задержкой развития, аномалии, маловесные, масса менее 2500. Больные парентеральными гепатитами, беременные, реципиенты препаратов крови, жидкостей, дети, рожденные ВИЧ-инфицированными, дети на гособеспечении, лица с ИППП, наркоманы, пенитенциарная система, наличие эпидпоказаний, анонимно.
Исследования, позволяющие осуществлять мониторинг ВИЧ-инфекции:
. Определение уровня лимфоцитов CD4+B сыворотке крови (иммунограмма методом моноклональных антител)
. Определение вирусной нагрузки ВИЧ в крови инфицированного (ПЦР)
. Определение мутаций резистентности ВИЧ к антиретровирусным препаратам (ПЦР, генетический анализ ВИЧ).
Данный метод позволяет определить состояние иммунной системы инфицированного человека. Уровень СD4+лимфацитов является одним из важнейших лабораторных показателей для решения вопроса о назначении ВААРТ и для оценки эффективности проводимой терапии. Нормальные диапазоны уровня СD4+лимфоцитов у взрослых находятся в пределах 500-1400 в 1 мкл. В случае отсутствия возможности определения показателя СD4+лимфоцитов (исследования являются дорогостоящими и требуют специально оборудованной лаборатории) при решении вопроса о назначении APT допустимо ориентироваться на абсолютное количество лимфоцитов в общем анализе крови. Показанием к назначению ВААРТ является абсолютное количество лимфоцитов менее 1,0х 10 /л.
Определение вирусной нагрузки (ВГ) ВИЧ в крови инфицированного (ПЦР).
Исследование так называемой вирусной нагрузки сегодня в клинической практике незаменимо:оно позволяет как оценивать прогноз, так и следить за эффективностью лечения. Знание исходного (до начала ВААРТ) уровня ВН пациента является дополнительным критерием начала ВААРТ. Считается, что уровень ВН выше 100 000 копий/мл — пороговый уровень для старта терапии у взрослых и детей старше 1 года жизни. Мониторинг ВН на фоне ВААРТ является критерием эффективности терапии. Так, при эффективной терапии уровень ВН должен снижаться и достигать неопределяемого уровня (менее 50 копий/мл).
Экспресс-тесты на ВИЧ. Сегодня выпускается множество экспресс-тестов на ВИЧ. Они известны как «тест на месте», «тест у постели больного» и «упрощенный экспресс-тест». В их основе лежит один из четырех методов- реакция агглютинации, ИФА на полимерных мембранах (тест-полоски) иммунологический фильтрационный анализ либо иммунохроматография (Giles 1999, Branson 2000).
Большинство таких тестов позволяет получить результат через 15-30 минут. Подобные экспресс-тесты полезны, когда результат необходимо получить быстро, например, в приемном отделении, перед срочными хирургическими вмешательствами, родами или после случайной травмы иглой. Основной проблемой применения экспресс-тестов — необходимость консультировать пациента перед тестированием и получать его согласие на проведение теста.
2 Техника выполнения методов диагностики
Иммуноферментный анализ:
Наиболее часто на практике используются три варианта твердофазного иммуноанализа — непрямой иммуноанализ, прямой иммуноанализ и иммуноанализ сэндвич-типа. Различия между этими типами иммуноанализа заключаются в следующем. В непрямом варианте иммуноанализа на первой стадии на поверхность лунок полистирольного планшета сорбируется антиген. После удаления несвязавшихся молекул антигена добавляется образец, содержащий специфичные к данному антигену антитела. Образовавшиеся комплексы антиген-антитело детектируются с помощью анти-видовых антител, конъюгированных с какой-либо меткой (Рис. 1А).
В прямом варианте иммунанализадетекция сорбированного антигена осуществляется непосредственно с помощью специфичных антител, конъюгированных с меткой (Рис. 1Б).
В иммуноанализесэндвич-типа на первой стадии на поверхность планшета сорбируется не антиген, а антитела, специфичные к исследуемому антигену (антитела подложки).
После удаления не связавшихся молекул антител добавляется образец, содержащий антиген. Для детекции образовавшегося комплекса антитела подложки-антиген добавляются вторые антитела, специфичные к другому, пространственно удаленному, эпитопу антигена, конъюгированные с какой-либо меткой. Использование в иммуноанализе сэндвич-типа антител, специфичных к двум различным эпитопам антигена, позволяет добиться высокой чувствительности и специфичности при определении антигена даже в таких гетерогенных образцах, как плазма крови. (рис. 2)
Непрямой иммуноферментный анализ (indirect ELISA).
Метод непрямого иммуноаналза характеризуется осуществлением 3-х стадийного процесса, на первой стадии которого антиген адсорбируется на специально подготовленном пластике, на второй с антигеном взаимодействуют специфичные к нему антитела, а на третьей в систему вводят антивидовые антитела, конъюгированные с ферментом, обуславливающим проведение индикаторной ферментативной реакции. В данной методике в качестве фермента используют пероксидазу хрена. Реакция проводится в специальных 96-луночных планшетах.
1.Сорбция антигена
В лунки 96-луночного планшета для проведения иммуноанализа сорбируют антиген 0,1-0,5 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS).
Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.
Отмывка (2-х кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером содержащим 0.1% Tween-20 (PBSТ).
. Блокировка
Для блокирования мест неспецифического связывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
3. Раститровка специфических антител
Раститровку можно проводить как по горизонтальным, так и по вертикальным рядам планшета. Необходимо отметить, что раститровка антител проводится в том случае, если необходимо подобрать оптимальную концентрацию антител или определить титр. В том случае, если оптимальная концентрация и/или титр антител определены, то используют рекомендованное для данных конкретных антител разведение.
При раститровке в первую лунку ряда вносят готовое разведение антител — в среднем 1-10 мкг в лунку, далее проводят последовательное разведение антител в лунках. Инкубацию со специфическими антителами проводят в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.
Отмывка осуществляется с помощью PBSТ 3 раза.
4. Добавление антивидовых антител, конъюгированных с ферментной меткой
В качестве детекторных (вторичных) антител используются антивидовыеполиклональные антитела, конъюгированные с пероксидазой хрена. Чаще всего используются козьи или кроличьи антитела, специфичные к целой молекуле или к Fc-фрагментам специфических антител. Концентрация детекторных антител как правило указывается производителем в виде разведения исходного раствора (например, 1:1000).
Инкубация со вторичными антителами проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.Отмывка осуществляется с помощью PBSТ 5-6 раз.
Пероксидаза хрена катализирует реакцию окисления субстрата перекисью водорода. В качестве субстрата пероксидазы хрена используется о-фенилендиамин (ОФД).
В результате прохождения реакции образуется окрашенный продукт окисления ОФД. Раствор субстрата: К 10 мл субстратного буфера (0.1 М Na-цитратный буфер, рН 4.5) добавить 0.01 мл 30% перекиси водорода и 0.2 мл 50х раствора ОФД (340 мг ОФД в 10 мл этилового спирта; хранить при -20 °С).Инкубация проводится в течение 10 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.
. Остановка ферментативной реакции
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0.5 М Н2SО4.В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0.5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
. Измерение оптической плотности
Оптическая плотность раствора окрашенного продукта измеряется при л=490 нм с использованием планшетного спектрофотометра.
Методика прямого иммуноанализа имеет лишь небольшие отличия по сравнению с методикой непрямого иммуноанализа. Так, стадии 1 и 2 одинаковы в обоих типах анализа. Отличие заключается в том, что в прямом варианте иммуноанализа на стадии 3 используют специфические антитела, конъюгированные с ферментной меткой. При необходимости также можно проводить раститровку специфических антител, конъюгированных с ферментной меткой, аналогично описанному ранее для неконъюгированных антител. Стадия 4 опускается, а дальнейшие стадии (5-7) проводятся аналогично описанному выше для непрямого варианта иммуноанализа.
Иммуноанализ сэндвич-типа:
В данном варианте иммуноанализа используется пара антител, специфичных к пространственно удаленнымэпитопам исследуемого антигена.
. Сорбция антител подложки
В лунки 96-луночного планшета для проведения иммуноанализа сорбируют антитела подложки 1-2 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS).
Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов.
Отмывка (2-х кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером содержащим 0.1% Tween-20 (PBSТ).
2.Блокировка
Для блокирования мест неспецифического связывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
.Инкубация с антигеном
В лунки планшета с преадсорбироваными антителами вносят по 50 мкл исследуемого раствора либо стандартных разведений антигена. Разведения антигена должны быть приготовлены на основе PBST, поскольку Tween-20 снижает неспецифическое связывание белковых молекул друг с другом и с поверхностью планшета. И исследуемый раствор, и стандартные разведения антигена вносят попарно (либо по 3 повторности), используя по две (три) лунки на каждое разведение белка. Инкубацию проводят при комнатной температуре в течение 30 мин при постоянном перемешивании.
Отмывка осуществляется раствором PBST 3 раза.
. Инкубация с антителами, конъюгированными с ферментной меткой
В лунки планшета вносят по 100 мкл раствора специфических антител, конъюгированных с ферментной меткой. Оптимальная концентрация конъюгированных антител как правило указывается производителем (обычно используют концентрацию 2-4 мкг/мл).Инкубация с антителами, содержащими ферментную метку, проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBSТ 5-6 раз.
. Проведение ферментативной реакции, сопровождающейся появлением окрашенного продукта
В лунки вносят по 100 мкл раствора субстрата и инкубируют в течение 10 мин при комнатной температуре и постоянном перемешивании.
6. Остановка ферментативной реакции
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0.5 М Н2SО4.В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0.5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
. Измерение оптической плотности
Оптическая плотность раствора окрашенного продукта измеряется при л=490 нм с использованием планшетного спектрофотометра.
Постановка ПЦР:
Общий объем реакции — 25 мкл, объем ДНК-пробы — 10 мкл. Проводится в ЗОНЕ 2 — комнате для подготовки и проведения ПЦР-амплификации.
Необходимое оборудование:
. Амплификатор (например, « Терцик » (ДНК — технология); «GeneAmpPCRSystem 2400», «GeneAmpPCRSystem 2700» (AppliedBiosystems); «GradientPalmCycler» (CorbettResearch); «Biometra».
. ПЦР-бокс
. Микроцентрифуга
. Отдельный набор автоматических пипеток переменного объема (5-40 мкл, 40-200 мкл).
. Штативы «рабочее место» для микропробирок на 0,5 мл.
. Одноразовые микропробирки для ПЦР на 0,5 мл или 0,2 мл.
. Одноразовые наконечники до 100 мкл с фильтрами в штативах для автоматических пипеток с переменным объемом.
. Отдельный халат и одноразовые перчатки.
. Емкость для сброса наконечников.
. Холодильник на 2- 8 °С; морозильник на минус 20 °С для хранения выделенной ДНК.
Необходимые реактивы
Таблица 2. Комплект «АмплиСенс»
|
Реактив |
АмплиСенс-100- R |
|
|
Объем (мл) |
Кол-во (шт.) |
|
|
ПЦР-смесь-1* |
0,005 |
110 |
|
ПЦР-смесь-2 |
1,1 |
1 |
|
Минеральное масло для ПЦР |
4,0 |
1 |
|
ДНК-буфер |
1,0 |
1 |
|
Рассчитан на 110 реакций |
||
* — ПЦР-смесь-1 помещена под воск.
Таблица 3. Контрольные образцы
|
Реактив |
Объем (мл) |
Количество (шт.) |
|
ПКО ДНК (положительный контрольный образец ДНК) |
0,1 |
1 |
|
ДНК-буфер (буфер для разведения и хранения ДНК) |
1,0 |
1 |
Во всех наборах для амплификации семейства АмплиСенс обязательно применяется «горячий старт», который обеспечивается разделением нуклеотидов и Taq -полимеразы прослойкой воска. Плавление воска и перемешивание реакционных компонентов происходит только при установке пробирок в амплификатор, нагретый до 950 С, что значительно снижает количество неспецифически затравленных реакций.
Подготовка пробирок для проведения ПЦР:
. Отобрать необходимое количество пробирок с ПЦР-смесью-1 и воском для амплификации ДНК исследуемых и контрольных проб.
. Внести по 10 мкл ПЦР-смеси-2, при этом она не должна проваливаться под воск и смешиваться с ПЦР-смесью-1.
. Сверху добавить по капле масла для ПЦР (примерно 15-25 мкл).
. Под масло или непосредственно на масло, используя наконечники с фильтрами внести по 10 мкл ДНК, выделенной из клинических проб или контролей этапа выделения.
. Дополнительные пробирки предназначаются для контролей этапа ПЦР (см. ниже):
а) отрицательный контроль (К-) вместо ДНК-пробы внести в подготовленную пробирку 10 мкл ДНК-буфера;
б) положительный контроль (К+) — внести в пробирку 10 мкл положительного контрольного образца ДНК (ПКО);
. Запустить на амплификаторе нужную программу (см. табл.).
Программы амплификации ДНК возбудителей инфекций, передаваемых половым путем.
. После окончания реакции пробирки отправить в комнату для анализа продуктов ПЦР (ЗОНУ 3).
Пробы после амплификации можно хранить в течение 16 часов при комнатной температуре, до одной недели при 2-8°С и длительно при минус 20°С (однако перед проведением электрофореза необходимо нагреть пробирки до комнатной температуры для размягчения воска).
Анализ продуктов амплификации проводится разделением фрагментов ДНК в агарозном геле. Иммуноблотинг — современный высокочувствительный аналитический метод, используемый для определения в образце специфичных белков с помощью антител.Идентификация исследуемого белка (например, онкобелки и др.) в сложных смесях или экстрактах различных тканей является одной из часто встречающихся задач. Используя такой инструмент как специфические антитела, можно определить исследуемый белок с минимумом временных и финансовых затрат. Имуноблоттинг используется в молекулярной биологии, биохимии, генетике.Метод основан на комбинации гель-электрофореза и иммунохимической реакции «антиген-антитело». С помощью гель-электрофореза белки разделяются в полиакриламидном геле. Далее белки переносят на нитроцеллюлозную или PVDF мембрану. Затем их детектируют с использованием антител методом «сэндвича»: сначала белки связываются с первичными (моно- или поликлональными) антителами, которые в свою очередь связываются со вторичными антителами, конъюгированными с ферментами (пероксидазой хрена или щелочной фосфатазой).
Визуализация исследуемого белка достигается путем проведения соответствующей биохимической реакции с образованием продукта, который определяется колориметрическим, хемилюминесцентным, флюоресцентным методами детекции. Количество белка может быть оценено с помощью денситометрии. Высокая степень разрешения достигается за счет электрофоретического разделения белков и специфичности моноклональных антител. В оптимально отработанных условиях Вестерн-блоттингом можно обнаруживать антиген в количествах менее 1нг.
Этапы иммуноблоттинга:
. Разделение белков методомгель-электрофореза
. Перенос белков на мембрану
. Блокирование
. Детекция
. Разделение белков методом гель-электрофореза. Наиболее распространенный способ разделения белков — электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (англ. SDS) по методу Лэммли. Подлежащие анализу белки в присутствии додецилсульфата натрия приобретают одинаковый отрицательный заряд, что делает возможным их разделение в зависимости только от молекулярной массы. Предварительно денатурированные белки вносят в карманы «треков» (дорожек) акриламидного геля с низкой концентрацией (концентрирующий гель), что позволяет их сконцентрировать перед переходом в разделяющий гель (с более высокой концентрацией), где происходит разделение белков в зависимости от молекулярной массы. Белки мигрируют в электрическом поле через акриламидный гель к аноду, при этом белки меньшего размера двигаются быстрее. Как правило, одну из «дорожек» оставляют для маркеров молекулярной массы (смеси белков с известными массами).
Отличия в скорости продвижения — электрофоретической подвижности приводит к разделению белков на полосы. Концентрация акриламида определяет разрешающую способность геля — чем выше концентрация акриламида, тем лучше разделение низкомолекулярных белков. Низкая концентрация акриламида улучшает разрешающую способность гель-электрофореза для высокомолекулярных белков.
. Перенос белков на мембрану. В методе электроблоттинга перенос белков из геля на мембрану (изготовленную из нитроцеллюлозы или поливинилиденфторида (англ. PVDF) происходит под действием электрического тока. Белки перемещаются из геля на мембрану с сохранением своего расположения. В результате этого процесса (от англ. Blotting-промокание) белки оказываются в тонком поверхностном слое мембраны и доступны для дальнейшего связывания с антителами. Оба варианта мембран используют из-за их свойства неспецифично связывать белки. Связывание белков основано как на гидрофобных взаимодействиях, так и на электростатических взаимодействиях между мембраной и белком.Эффективностьэлектроблоттинга значительно повышается при использовании системы Транс-блотTurbo, позволяющей существенно уменьшить время переноса белков из геля на мембрану (7мин против 2 часов).В связывании комплекса белок-SDS с нитроцеллюлозной мембраной принимают участие в основном силы электрической природы, причем данное взаимодействие является многоточечным и приводит к «распластыванию» белков на поверхности мембраны. Таким образом, после электропереноса мы получаем на нитроцеллюлозе реплику геля с белками, расположенными так же, как и в полиакриламидном геле.Эффективность переноса белков из геля на мембрану может быть проверена окрашиванием мембраны красителями Coomassieblue или Ponceau S. Предпочтительно используется краситель Ponceau S, который обладает большей чувствительностью и лучше растворим в воде, что упрощает последующую отмывку и нанесение антител.
. Блокирование. Блокирование неспецифичных связываний достигается инкубацией мембраны в разбавленном растворе белка — обычно бычьего сывороточного альбумина или обезжиренного сухого молока с небольшим процентом детергента типа Tween 20 или Triton X-100. Белок из разбавленного раствора связывается с мембраной в тех местах, где нет исследуемого белка. В результате антитела при их добавлении могут связываться только с специфичными сайтами связывания на исследуемых белках. Блокирование позволяет достигать чистого фона и исключает получение ложноположительных результатов.
. Детекция. После блокирования мембраны 3-х кратно отмывают буфером. Затем исследуемые белки детектируют с использованием антител методом «сэндвича»: сначала белки связываются с первичными (моно- или поликлональными) антителами, которые в свою очередь связываются со вторичными антителами, конъюгированными с ферментами (пероксидазой хрена или щелочной фосфатазой).
Визуализация исследуемого белка достигается путем проведения соответствующей биохимической реакции с образованием продукта, который определяется колориметрическим, хемилюминесцентным, флюоресцентным методами детекции. Хемилюминесцентнаядетекция обладает более высокой чувствительностью по сравнению с колориметрическим методом. Взаимодействие люминола и пероксида в присутствии пероксидазы хрена, конъюгированной с вторичными антителами, приводит к образованию окисленного люминола, который обладает люминесцентным свечением при 425 нм. Интенсивность хемилюминесценции пропорциональна количеству исследуемого белка (антигена).
Детекция хемилюминесценции (как и флуоресценции) осуществляется с помощью гель-документирующей системы ChemiDocMP, которая обладает высоким разрешением и чувствительностью. Система ChemiDocMP снабжена CCD камерами высокого разрешения и мощной системой охлаждения, что позволяет точно фиксировать нечеткие, расплывчатые полосы. Наличие программного обеспечения позволяет проводить качественный и количественный анализ полученных данных по сравнению со стандартными белками.
2.3 Анализ эпидемиологической ситуации
В мире:
По состоянию на конец 2011 года заразились ВИЧ-инфекцией 60 миллионов человек, из них:
- 25 миллионов умерли
- 35 миллионов живут с ВИЧ-инфекцией.
Из 35 миллионов живущих с ВИЧ-инфекцией часть в живых благодаря приёму антиретровирусной терапии. Необходимые лекарства получают менее половины из 9,5 млн носителей, нуждающихся в противовирусной терапии. Более двух третей ВИЧ-инфицированных населяют Африку к югу от пустыни Сахары. Эпидемия началась здесь в конце 1970-х — начале 1980-х. Центром считается полоса, протянувшаяся от Западной Африки до Индийского океана. Затем ВИЧ перекинулся южнее. За исключением стран Африки быстрее всего ВИЧ распространяется сегодня в Центральной Азии и Восточной Европе. С 1999 по 2002 годы количество инфицированных здесь почти утроилось. Эти регионы сдерживали эпидемию до конца 1990-х, а затем количество заражённых стало резко увеличиваться — в основном за счёт инъекционных наркоманов. Значительно ниже среднего распространенность ВИЧ-инфекции в Восточной Азии, Северной Африке и на Ближнем Востоке. В масштабе всей Земли эпидемия стабилизировалась: не возросла доля эпидемии в отношении всего населения, снижается количество новых случаев ВИЧ-инфекции (с 3,5 миллионов новых случаев в 1997 году до 2,7 миллионов в 2007 году).
В России:
На 1 января 2013 года в России зафиксировано 719 445 ВИЧ-инфицированных, в том числе детей до 14-ти лет — 6,306 тыс. В связи с отсутствием профилактики ВИЧ, за год число заразившихся ВИЧ россиян увеличилось на 69,28 тыс.. Показатель распространённости ВИЧ-инфекции среди взрослых достиг значения ~1,1%.. От болезней, связанных с ВИЧ и СПИД в 2006 году умерли 19 347 человек, среди них 353 ребёнка. На 1 декабря 2012 года в России зафиксировано 125 тыс. случаев смерти от СПИДа.Около 60% случаев ВИЧ-инфицирования среди россиян приходится на 11 из 86 российских регионов (Иркутская,Саратовская, Калининградская,
Ленинградская,Московская, Оренбургская, Самарская, Свердловская и Ульяновская области, Санкт-Петербург и Ханты-Мансийский автономный округ).
По данным на конец 2012 года: за последние 5 лет число ВИЧ-инфицированных увеличилось в 2 раза. Но многие люди могут и не знать, что болеют. По разным методам оценки, реальное количество ВИЧ-инфицированных может составлять от 950 тыс. до 1 млн 300 тыс. человек.
По данным на конец 2013 года, в России активизировался выход эпидемии из уязвимых групп населения в общую популяцию. В эпидемию вовлечены социально адаптированные люди трудоспособного возраста. Максимальная пораженность ВИЧ-инфекцией зарегистрирована среди женщин в возрастной группе 25-34 года, среди мужчин в возрастной группе 30-34 года. Основные пути заражения следующие:
- 58% — внутривенное введение наркотиков нестерильными инструментами
- 40% — гетеросексуальный контакт.
В Дальневосточном федеральном округе:
В последние годы существенно увеличился охват лечением ВИЧ-инфицированных пациентов ДВФО, что, в первую очередь, связано с реализацией приоритетного национального проекта в сфере здравоохранения.Так, в целом по округу в 2013 году из 2821 инфицированных, нуждающихся в лечении, его получили 2804 человека, или 99,4% (в 2007 г. — 88,3%, в 2008 г. — 98,9%, в 2009 г. — 99,4%, в 2010 г. — 99,2%, в 2011 г. — 99,1%, в 2012 г. — 99,3%) — табл. 9. На большинстве административных территорий Дальневосточного федерального округа охват лечением составил 100%.(Таблица 4).
По состоянию, на конец 2013 года подлежало диспансерному наблюдению 10444 ВИЧ-инфицированных пациентов ДВФО (в 2009 г. — 7384, в 2010 — 8394, в 2011 г. — 9024, в 2012 г. — 9514).
Из них 9312 человека (89,2%) было охвачено таким наблюдением. На территории Амурской, магаданской областей, Чукотского автономного округа, охват диспансерным наблюдением ВИЧ-инфицированных составил 100% (таблица 5).
Профилактика вертикального пути передачи ВИЧ-инфекции в ДВФО в 2013 году проводилась 188 беременным женщинам из 177 нуждающихся в ней, охват составил 94,2%. На территории республики Саха (Якутия), Камчатского и Хабаровского краев, Сахалинской и Амурской области охват химиопрофилактикой составил 100%. Из 189 ребенка, рожденного от ВИЧ-инфицированных матерей, химиопрофилактика была проведена 186 детям, что составило 98,4%. (таблица 6).
Одним из критериев оценки состояния иммунной системы и качества лечения ВИЧ-инфицированных пациентов является определение иммунного статуса и уровня вирусной нагрузки ВИЧ. В 2012 году в ДВФО на иммунный статус было обследовано 7557 ВИЧ-инфицированных, а определение вирусной нагрузки — 7359 ВИЧ-инфицированным (таблица 7).
Анализ результатов серологических исследований на антитела к ВИЧ за 2013г.
В 2013 году в Дальневосточном федеральном округе было проведено 1265277 обследований на антитела к ВИЧ (в 2011 г. — 1275893, в 2012 г. — 1297188, в 2013 г. — 1219560), число анализов составило 1369427.
Охват населения ДВФО тестированием на антитела к ВИЧ в 2012 г. составил 18,6%, в 2012 г. — 17,8%, в 2013 г. — 18,5%, в 2009 г. — 17,7%, в 2010 г. — 18,4%. Наибольший охват тестированием был в Магаданской, Сахалинской областях, Камчатском и Хабаровском краях, республике Саха (Якутия) — 23,7, 23,3, 21,7, 20,3, 19,6% соответственно (таблица 8).
В структуре населения ДВФО, обследованного на антитела к ВИЧ в 2012 году, так же, как и в предыдущие годы, преобладали лица, обследованные по клиническим показаниям, и лица из группы «Прочие» — 29% и 27,4% соответственно (таблица 9).
Достаточно высокий удельный вес среди обследованных пациентов продолжают занимать беременные (21,6%) и доноры (12,6%).
Доля обследованных лиц из мест лишения свободы и потребителей инъекционных наркотиков осталась практически на прежнем уровне (2,1 и 0,7% соответственно), при этом низким остается объем обследования ПИН, лиц с гомо- и бисексуальной ориентацией и лиц из очагов эпидемиологического обследования. При анализе структуры обследованных на ВИЧ-инфекцию детей, подростков и лиц, обследованных анонимно, выявляются определенные особенности (таблица 10).
Так, среди детей наибольший объем занимают лица, обследуемые по клиническим показаниям, а среди анонимно обследованных лиц — больные ИППП и группа «Прочие». Структура обследованных подростков более однородна, чем группа детей. Отмечается относительно высокий объем обследования подростков, обследованных по клиническим показаниям (37,9%), из группы «прочие» (36,7%), беременных (14,2%).Анализ эффективности обследования населения Дальневосточного федерального округа в 2013 году в целом показал некоторое ее увеличение по сравнению с 2012 годом (таблица 11).
Так, выявляемость антител к ВИЧ в реакции иммуноблота составила в 2005 году, в среднем, 90,82 на 100 тысяч обследований, в 2006 г. — 92,25, в 2007 г. — 89,76, в 2008 г. — 94,35, в 2009 г. — 101,6, в 2011 г. — 111,4, а в 2013 году аналогичный показатель составил 130,0 на 100 тысяч обследований. Наиболее высокой остается эффективность обследования населения Дальневосточного федерального округа при эпидемиологическом обследовании очагов ВИЧ-инфекции и среди лиц, употребляющих наркотические препараты, — соответственно 8404,7 и 1396,9 на 100 тысяч обследований в 2013 году. При этом эффективность обследования наркопотребителей увеличилась в сравнении с предыдущим годом. Обращает на себя внимание увеличение числа положительных находок при обследованиях в 2013 г. в таких группах, как потребители наркотиков, больные ИППП, лица из мест лишения свободы, медперсонал, работающий с ВИЧ-инфицированными, обследованные при эпидрасследовании и группа «прочие». Снижение эффективности обследования наблюдалось в группе беременных. Таким образом, наибольшая выявляемость антител к ВИЧ наблюдается среди контингентов, занимающих наименьший объем в структуре обследованного населения округа. Напротив, очень низкая эффективность обследования отмечается среди большого числа обследованных доноров, беременных, лиц с клиническими показаниями и лиц из группы «Прочие». В целом по ДВФО процент подтверждения положительного результата ИФА в реакции иммуноблота (таблица 12) составил в 2013 г. 25,1%, что несколько выше, чем в 2012 г. (24,4%).
Заключение
Все должны знать и понимать, что СПИД войдет с нами в XXI век. И для того, чтобы выжить, уменьшить риск заражения и распространения заболевания, как можно больше людей во всех странах должны многое знать о СПИДе — о развитии и клинических проявлениях заболевания, его профилактике и лечении, уходу за больными, психотерапии больных и инфицированных. Каждую минуту в мире не менее 15 человек заражаются вирусом иммунодефицита человека. Одновременно многие из них осознают крушение своей жизни и мрачно вглядываются в неопределенное будущее. Каждую минуту эти несчастные сталкиваются не только с собственным страхом, но и с непониманием со стороны родственников, друзей, коллег по работе. Да и общество начинает относиться к ним не как к обычным людям, а как к больным «СПИДом». ВИЧ-инфекция — это хроническая пожизненная инфекция, поэтому, сегодня необходимо решать две большие проблемы:
как противостоять распространению вируса иммунодефицита человека;
как относиться к людям, инфицированным ВИЧ;
Единственный способ противостоять распространению вируса — сделать акцент на профилактику, а единственным реальным средством профилактики как самой ВИЧ-инфекции, так и негативных ее последствий является изменение поведения на безопасное или менее опасное. Просветительной работе, касающейся ВИЧ и СПИДа, должно уделяться особое внимание, особенно работе с молодежью. В США уже требуют, чтобы в школах проводились занятия, посвященные ВИЧ/ СПИДу и занятия эти начинались с детьми 9-11- летнего возраста. Сегодня в средствах массовой информации преобладают сообщения о статистике эпидемии, чаще всего без какого-либо разъяснения, что нагоняет страх среди населения. Читая газету или глядя в телевизор, человек не должен испытывать чувство обреченности. Ведь науке удалось многого добиться. Благодаря глобальным эпидемиологическим исследованиям выяснено, как вирус передается от человека к человеку. К счастью, пути передачи ограничены, следовательно, эти факторы можно контролировать, а значит сдерживать и предотвращать распространение болезни — все зависит главным образом от сознательного поведения человека.
Отношение общества к людям, инфицированным ВИЧ, определяет успех или неудачу борьбы против инфекции на национальном уровне. Безусловно, эти люди должны находиться в обществе, по крайней мере, по двум причинам. Во-первых, они не представляют опасности для окружающих, если только не вступают в половые связи, не сдают кровь или не используют общих с другими игл и шприцев для инъекций. Во-вторых, изолировав ВИЧ-инфицированных от общества, или применив к ним более строгие меры, мы загоним болезнь внутрь и сведем на нет результаты санитарного просвещения. Чем сильнее мы стремимся изолировать ВИЧ-инфицированных и больных СПИДом, тем большей угрозе мы подвергаем общество. И задача российских средств массовой информации придерживаться именно такого подхода.В России разрабатывается проект «Профилактика, диагностика, лечение СПИДа». В мероприятия проекта включены три масштабные образовательные кампании, направленные на все население в целом, и специально — на молодежь, на определенные группы риска: потребителей наркотиков, лиц, оказывающих платные сексуальные услуги, гомосексуальное сообщество.В рамках просветительской работы проект предусматривает проведение рекламных кампаний по пропаганде безопасного секса среди молодежи, создания сетей региональных телефонных линий доверия, которые будут круглосуточно бесплатно предоставлять консультации населению по всем проблемам ВИЧ-инфекции и инфекций, передаваемых половым путем на анонимной основе.Идеологическая суть проекта заключается в том, чтобы путем активных целенаправленных мероприятий постепенно снять нарастающий страх людей перед ВИЧ-инфекцией и внушить им на основе приобретенных знаний трезвое, взвешенное отношение к проблеме в целом и собственному здоровью, прежде всего, это касается всего населения.Работа с группами риска будет проводиться индивидуально. Сегодня 90% ВИЧ-инфицированных в России — наркопотребители. Это в основном молодые люди, число которых уже превысило три миллиона человек. Совсем недавно сочли бы диким предложение обучить потребителей наркотиков их безопасному введению. Тем не менее, это — одна из реальных возможностей пресечь передачу инфекции в самой большой группе риска.Другой эффективный метод снижения вреда при потреблении наркотиков станет обмен шприцев. С одной стороны это исключает многократный обмен шприцев, а с другой — открывает возможность непосредственно вступить в прямой диалог с людьми из этой группы риска, обменяться с ними информацией об опасности заражения. Такая открытая работа на территории «противника», входя в его доверие, непременно приводит к позитивному результату.Таким образом, все компоненты проекта, а их количество весьма значительно, дают возможность решать проблему борьбы со СПИДом комплексно. «Заразишься или не заразишься — зависит только от тебя», — таков основной девиз международной профилактической кампании. Только таким путем каждый человек может избежать ВИЧ-инфицирования, сохранить здоровье и жизнь.
Список использованной литературы
[Электронный ресурс]//URL: https://inzhpro.ru/diplomnaya/meditsinskogo-laboratornogo-tehnika/
1. Голенков А.В. Причины негативного отношения медицинских работников к ВИЧ-инфицированным и пути его преодоления — 2008. -№8. -С. 8-11.
2. Голенков А.В., Андреева С.В. Взаимоотношения среднего медработника с ВИЧ-инфицированными — 2008.- №4.-С. 41-43.
. Плавинский С.Л., Савина В.А. Нозокомиальная передача гемоконтактных инфекций: Обзор литературы. — М., 2007. — 68 с.
. В.В. Покровский, Г.М.Кожевникова, О.П. Фролова и др., Эпидемиологический надзор за ВИЧ-инфекцией в Российской Федерации: Сборник нормативно-правовых актов и методических документов по вопросам диагностики, лечения, эпидемиологического и поведенческого надзора ВИЧ/СПИДа и сопутствующих заболеваний — М., 2007. — Том II. — 396 с.
5. Н.К. Шарова, А.Г. Букринская, Особенности взаимодействия белков в составе вирионов ВИЧ-1; Вопросы иммунологии, 1990, т.3, №3, с. 202-206.
6. Иванов С.М., “Возможно выделен новый тип вируса иммунодефицита человека — ВИЧ-3”; Вопросы вирусологии, 1990, т.35, №1, с. 82.
. Л.А. Кожемякин, В.Г. Бондаренко; Нестабильность генома и СПИД. Биохимия, 1992, т. 57, в. 9, с. 1417-1426.
. В.П. Кузнецов. Система интерферона при ВИЧ-инфекции. Вопросы вирусологии. 1991, т. 36, №2, с. 92-96.
. Папырин. А.С., Сильнее профилактики пока средства нет, Медицинская газета №62 2011.- 38 с.
. Бочаров. Е.Ф. О профилактике ВИЧ-инфицированности, Медицинская газета, №4 2012. — 17с.
. ШевелевА.С., СПИД — загадка века; М.,1991г.
. ВеркинБ.И., ВолянскийЮ.Л.,. Марчук Л.М и др., Синдром приобретенного иммунодефицита. Возможные механизмы взаимодействия вируса иммунодефицита человека с клетками организма; Харьков, 1988.
. М. Адлер, Азбука СПИДа; М.: Мир, 1991.
. Н.К. Шарова, А.Г. Букринская, Особенности взаимодействия белков в составе вирионов ВИЧ-1; Вопросы иммунологии, 1990, т.3, №3, с. 202-206.
. “Возможно выделен новый тип вируса иммунодефицита человека — ВИЧ-3”; Вопросы вирусологии, 1990, т.35, №1, с. 82.
. Л.А. Кожемякин, В.Г. Бондаренко; Нестабильность генома и СПИД. Биохимия, 1992, т. 57, в. 9, с. 1417-1426.
. В.П. Кузнецов. Система интерферона при ВИЧ-инфекции. Вопросы вирусологии. 1991, т. 36, №2, с. 92-96.
. Т.А. Бектимиров. Вирус иммунного дефицита человека типа 2. Вопросы вирусологии. 1990, т. 35, №3, с. 180-183.
. М.И. Букринский. Строение генома и экспрессия генов вируса иммунодефицита человека (обзор иностранной литературы).
Вопросы вирусологии. 1987, т.32, № 6, с. 649-656.
